Вопросы части С объединяют знание всех тем химии. В случае Задания С2 ЕГЭ по химии — знание всех классов неорганических веществ и их качественных реакции.
Дается конкретный химический эксперимент, ход которого нужно описать химическими реакциями.
Для таких реакции обычно предлагаются какие-то внешние проявления — выделения газа, выпадение осадка или изменение окраски раствора.
Таблица качественных реакций для газов
| Описание | Формула |
| Запах тухлых яиц | 1) взаимодействие серасодежащих веществ с кислородом 2) взаимодействие некоторых металлов с концентрированной серной кислотой |
| Газ с резким характерным запахом, растворимый в воде | |
| Газ, не поддерживающий горение, малорастворимый в воде, не ядовитый |
Таблица качественных реакций для щелочных металлов:
Т.к. все соединения щелочных металлов хорошо растворимы в воде, то их определяют по цвету пламени:
(указан так же цвет пламени некоторых щелочно-земельных металлов)
Таблица качественных реакций
— цвета осадков
Осадки белого цвета
нерастворимый в воде;
нерастворимый в HNO3
качественная реакция на соли серебра;
качественная реакция на хлорид-ионы;
нерастворимый в кислотах
качественная реакция на соли бария;
качественная реакция на сульфат-ионы;
образуется при пропускании газа без цвета с резким запахом через известковую воду;
растворяется при пропускании избытка газа;
растворяется в кислотах
растворение в кислотах:
CaSO3 + 2H + → SO2↑ + H2O + Ca 2+
образуется при добавлении щелочи;
растворяется в избытке щелочи
избыток щелочи : Al(OH)3 + NaOH =Na[Al(OH) 4 ];
образуется при пропускании газа без цвета и запаха через известковую воду;
растворяется при пропускании избытка газа;
растворяется в кислотах
растворение в кислотах:
Осадок светло-желтого цвета
(осадок кремового цвета)
образуется при приливании AgNO3;
нерастворим в HNO3;
качественная реакция на бромид-ионы;
(качественная реакция на соли серебра);
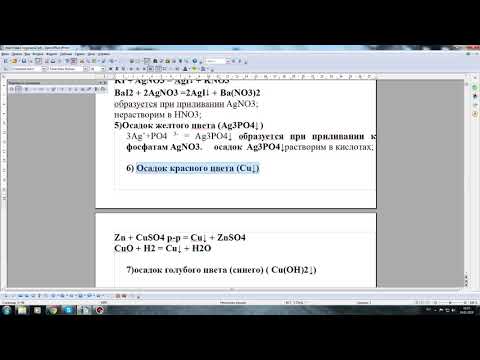
Осадок желтого цвета
образуется при приливании AgNO3;
нерастворим в HNO3;
качественная реакция на иодид-ионы;
(качественная реакция на соли серебра);
Осадок желтого цвета
образуется при приливании AgNO3;
растворим в кислотах;
Осадки коричневых цветов
Осадок бурого цвета
образуется при взаимодействии с растворами щелочей;
качественная реакция на соли железа
Осадки синих и зеленых цветов
Осадки зеленого цвета
Осадок голубого цвета
(осадок синего цвета)
образуется при взаимодействии с растворами щелочей
качественная реакция на соли меди ( II)
Осадок синего цвета
образуется при взаимодействии с раствором красной кровяной и желтой кровяной соли
качественная реакция на соли железа ( II) — с красной кровяной солью;
качественная реакция на соли железа ( III) — с желтой кровяной солью;
Осадки черного цвета
Осадок черного цвета
Образуется при взаимодействии с сульфидами или с H2S
качественная реакция на сульфид-ионы
Еще на эту тему:
Видео:ЛУЧШАЯ стратегия использования Таблицы Растворимости (химия с нуля)Скачать

Обсуждение: «Таблицы качественных реакций»
а какого цвета осадок тетрагидроксоалюмината натрия?
а это не осадок, это растворимое вещество
Любой осадок возможно растворим другим веществом. В данной среде вещество ведет себя пассивно от того и осаждается.
порода, до этого промытая кислотами, была залита мною аптечным йодом и прокипела в нём целую ночь. После остывания была добавлена вода, раствор отстоялся и был декантирован. Раствор представляет собой очень тёмный, чёрно-коричневый золь. В луче фонаря видна мельчайшая, не оседающая, не фильтрующаяся пыль. При добавлении в золь соляной к-ты выпадает красно-коричневый осадок, а раствор светлеет до тёмно красного. В растворе появляется свободный йод обнаруживаемый крахмалом, до прибавления солянки йод не обнаруживался. Так вот, выпавший осадок не растворяется ни в кислотах, ни в щелочах, не реагирует с хлором, растворить его больше ни в чём не получается, на частицы породы уже не похож. Напоминает по цвету осадок смеси гидроксидов железа II и III, однако нерастворим в кислотах. Что это может быть, хотя бы класс соединения узнать? Подскажите пожалуйста.
напишите хотя бы примерно что за порода…
Это глинистая порода светло коричневого цвета. После травления указанной породы смесью соляной к-ты с гипохлоритом натрия был получен жёлтый раствор. Раствор был нейтрализован и осаждён гидрокарбонатом натрия, осадок отправлен на спектральный анализ, вот результат в массовых долях:
13Al 5.420±0.061
14Si 1.136±0.023
15P 0.597±0.019
16S 0.279±0.010
17Cl 77.974±0.066
20Ca 5.778±0.014
22Ti 0.157±0.017
26Fe 8.506±0.026
29Cu 0.152±0.002
Да, результат более чем странный, но ведь лаборатория анализ делала! В общем, эта же порода (поскольку растворилась лишь незначительная, незаметная на глаз её часть) была промыта водой и обработана указанным выше способом. Больше ничего не знаю))) Подскажите хотя бы возможные варианты полученного осадка.
После обработки смесью гипохлорита и соляной все указанные элементы должны были перейти в раствор. После реакции с гидрокарбонатом могло получиться:
Al(OH)3, CaCO3, Ca(OH)2, Ti(OH)2, возможно, Ti(OH)CO3, Fe(OH)2, Fe(OH)3, Cu(OH)2, возможно очень небольшие кол-ва карбонатов, хотя, после промывания водой они должны были раствориться
Дело в том, что полученный раствор после травления солянкой с гипохлоритом был декантирован с породы и только тогда обработан гидрокарбонатом, там действительно могли образоваться указанные вами осадки хоть это и противоречит результатам лаб. анализа. Но не в этом дело. Состав этого раствора я привёл лишь для понимания какие элементы могут там содержаться. Сама порода была промыта водой и затем обработана аптечным йодом, как я писал ранее в первом посте, вот осадок полученный после йода меня интересует.
Указанные осадки как раз по составу соответствуют анализу, ну да ладно. Смотрите по таблице растворимости, что дает с йодом осадок
Видео:Как понять что вещество выпадает в осадок или образуется газСкачать

Цвета осадков и газов в неорганической химии
Для сдачи ОГЭ необходимо знать и предсказывать по формуле цвет осадка или газа, а также характерные запахи, которыми обладают газы. В данном документе собраны необходимые данные по этому вопросу.
Осадки бывают разных цветов и разной консистенции. Все это является частью описания признака реакции.
Задание 13 ОГЭ по химии.

Автор: Фрундина Дарья Андреевна, учитель химии.
Видео:Осадки: цвета и качественные реакцииСкачать

Качественные реакции
О чем эта статья:
Видео:Осадки для ЕГЭ по химииСкачать

Что такое качественная реакция
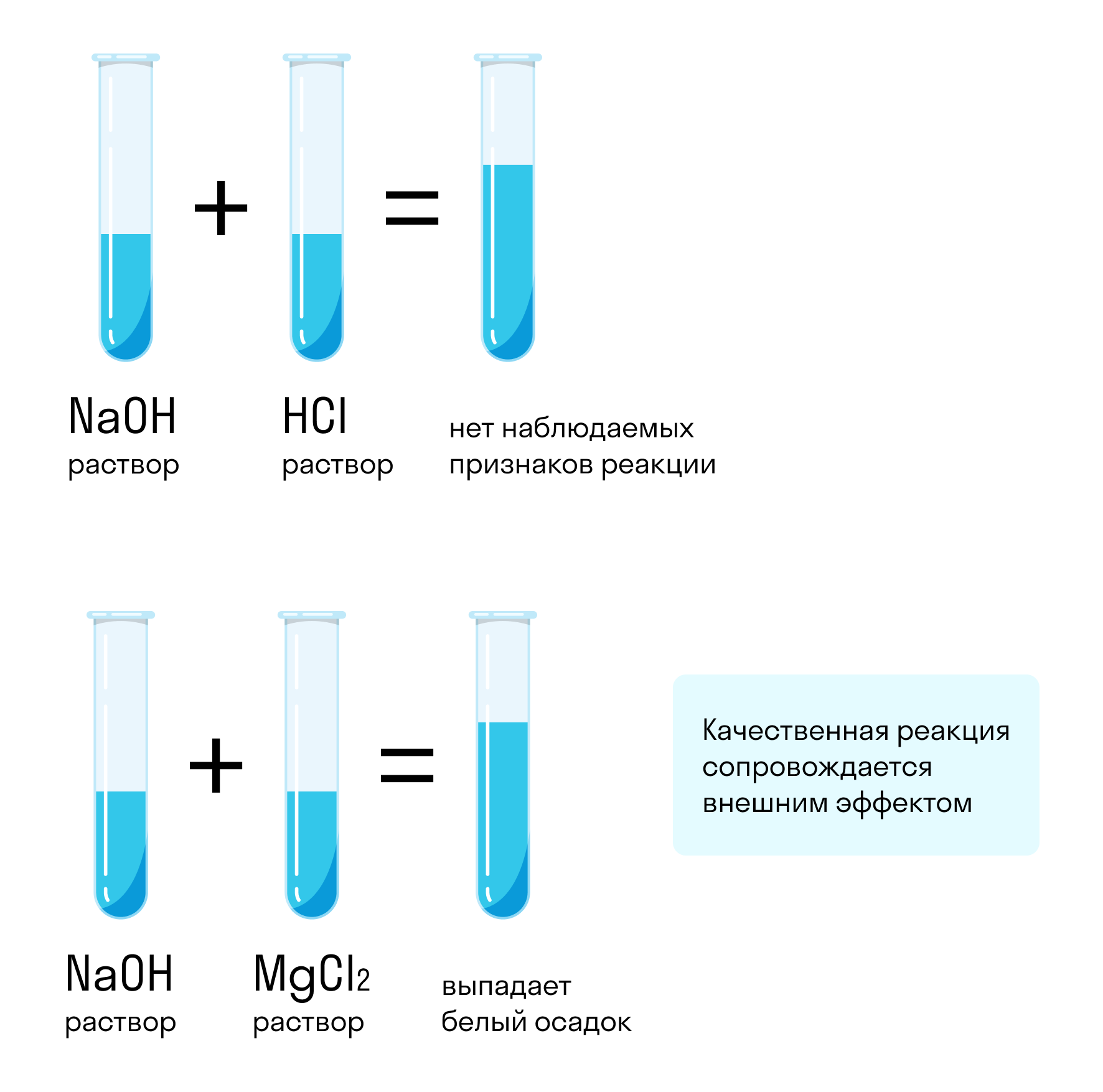
Предположим, у нас есть две пробирки — с водой и с гидроксидом натрия (каустической содой). Можно ли отличить один раствор от другого? Можно, если подобрать правильный реагент, с которым один раствор будет реагировать, а другой нет, или на который эти вещества будут реагировать по-разному.
Для таких целей подойдут не все реагенты. Например, если смешать гидроксид натрия с соляной кислотой, реакция произойдет: NaOH + HCl = NaCl + H2O. Но внешне она никак не проявится — два прозрачных раствора образуют такой же прозрачный третий. Такой реагент не подходит.
Если же смешать гидроксид натрия с хлоридом магния, результат химической реакции будет заметен невооруженным глазом. Характерным признаком станет образование белого осадка: 2NaOH + MgCl2 = Mg(OH)2 + 2NaCl. При смешивании хлорида магния с водой белый осадок не образуется. Значит, этот реагент позволяет отличить один раствор от другого.
Качественными называются реакции, позволяющие идентифицировать в исследуемом объекте определенные атомы, молекулы, функциональные группы и т. д. Идентификация происходит по внешним проявлениям, которые сопровождают реакцию: выделение газа, изменение цвета раствора, образование осадка, появление специфического запаха и др.
Качественные реакции — это простой и быстрый способ узнать качественный состав раствора или другого сложного вещества.
Видео:Что такое ИНДИКАТОРЫ и как их ЗАПОМНИТЬ?Скачать

Качественный анализ
Определение состава того или иного вещества с помощью качественной реакции называют качественным анализом. В химии он часто используется перед количественным анализом, а также для того, чтобы понять, как можно разделить смесь.
Исследуемые объекты могут представлять собой твердые, жидкие или газообразные вещества, и в зависимости от этого качественный анализ проводится разными методами:
сухим способом — например, если внести пробу вещества в пламя горелки и отследить, как изменился цвет пламени;
мокрым способом — путем преобразования вещества в раствор.
Русский химик Ф. М. Флавицкий также предложил сухой метод растирания твердого исследуемого объекта с реактивом. Если реакция будет качественной, появятся характерные признаки: изменение цвета смеси, выделение газа и т. д.
Видео:Цветные осадки и другие признаки протекания реакции.Скачать
Правила растворимости химических соединений
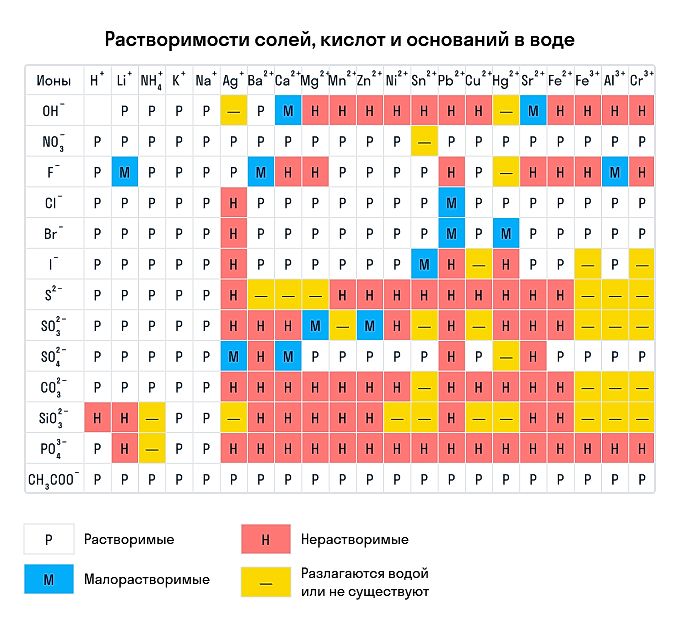
Сухим способом обычно проводят анализ в полевых условиях, а в лабораториях чаще использую растворы. Поэтому для изучения качественных реакций в химии (неорганической и органической) желательно знать правила растворимости сложных веществ. Наизусть учить, конечно, их не стоит — можно воспользоваться таблицей растворимости, которая приведена ниже.
Растворимы:
абсолютно все нитраты;
большинство солей аммония, натрия, калия (но есть исключения, например — гексанитритокобальтат (III) калия K3[Co(NO2)6]);
соли йодидной, хлороводородной и бромоводородной кислоты (но галогениды свинца (II), ртути (I) и серебра обладают умеренной растворимостью);
почти все сульфаты, кроме BaSO4, SrSO4, PbSO4 (при этом CaSO4 и Ag2SO4 умеренно растворимы).
Нерастворимы:
любые сульфиды, кроме сульфидов щелочных и щелочноземельных металлов, а также (NH4)2S;
любые гидроксиды, кроме гидроксидов щелочных металлов (умеренной растворимостью отличаются Sr(OH)2, Ca(OH)2, Ba(OH)2);
Видео:Как пользоваться таблицей растворимости. Как ее можно применятьСкачать

Качественные реакции органических веществ
В органической химии качественные реакции позволяют за считанные минуты определить класс соединения — узнать, относится ли исследуемый объект к спиртам, углеводам, альдегидам и т. д. По внешним эффектам судят о присутствии функциональных групп органических соединений в смеси или в растворе.
Белковые соединения при горении издают запах жженой шерсти. При добавлении концентрированной азотной кислоты они окрашивают раствор в ярко-желтый цвет, также характерно образование желтого осадка (ксантопротеиновая реакция). А если соединить в растворе белки со свежеосажденным гидроксидом меди (II), получится сине-фиолетовая смесь.
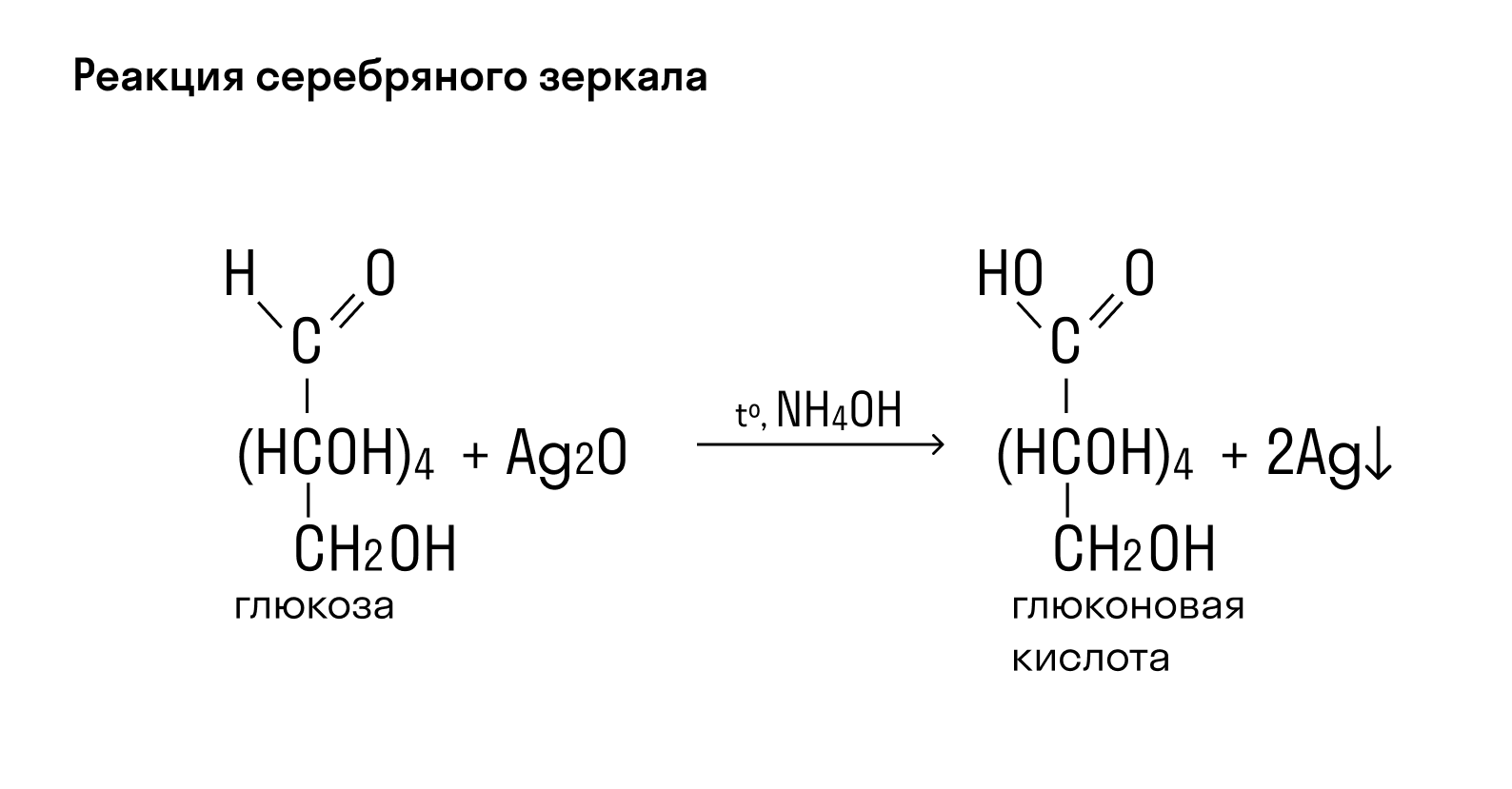
Глюкоза благодаря содержанию альдегидной группы в реакции с аммиачным раствором оксида серебра образует на стенках пробирки «серебряное зеркало». Вместе со свежеосажденным гидроксидом меди (II) она окрашивает раствор в синий цвет, а если данный раствор нагреть — происходит образование красно-оранжевого осадка.
СН2ОН — (СНОН)4 — СОН + Ag2O = СН2ОН — (СНОН)4 — СООН + 2Ag↓ — реакция «серебряного зеркала».
HOСН2 — (СНOH)4 — СН = O + 2Cu(OH)2 ⇒ HOСН2 — (СНOH)4 — СOOH + Cu2O + 2H2O — реакция глюкозы с гидроксидом меди (II).
Фенол с бромной водой образует белый осадок. Также он вступает в качественную реакцию с раствором соли трехвалентного железа — окрашивает его в фиолетовый цвет.
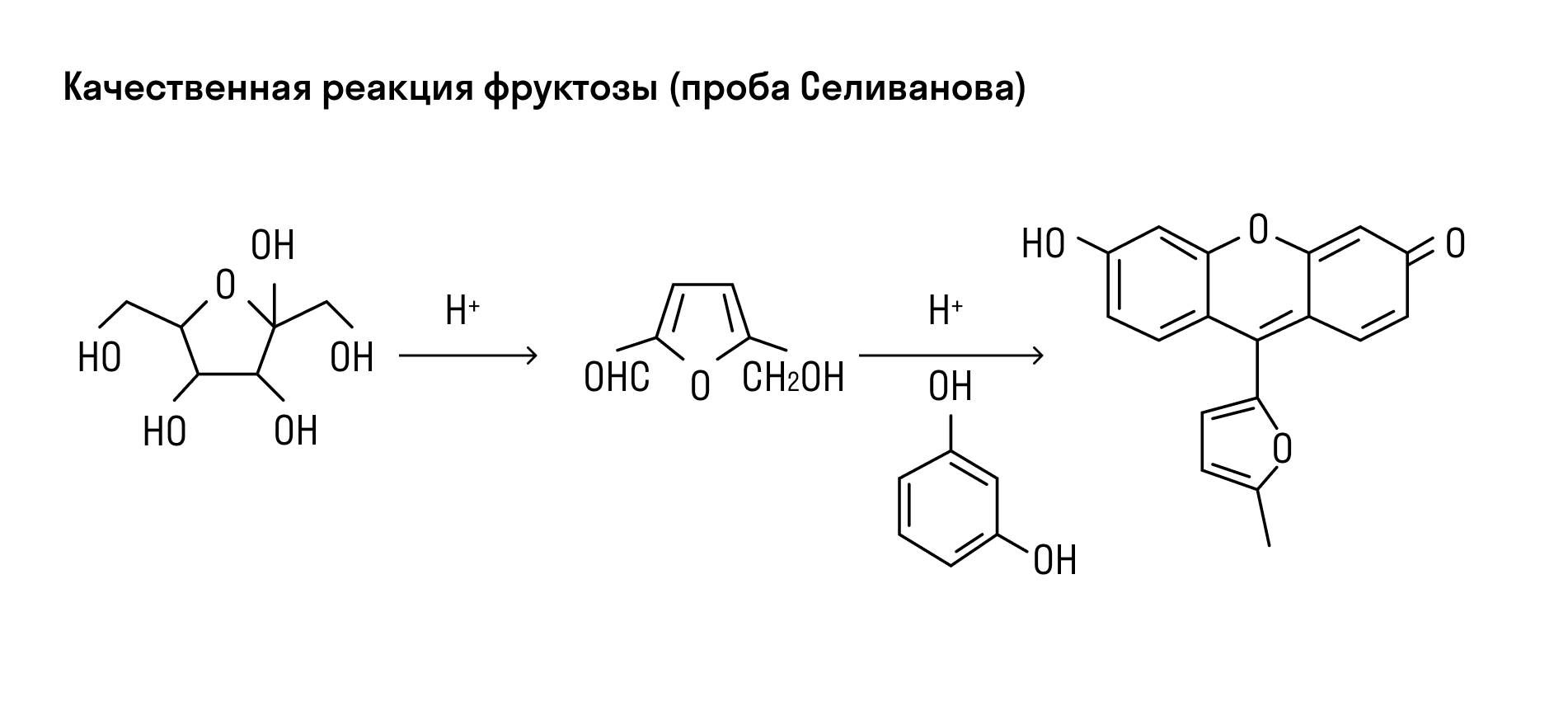
Углеводы с содержанием крахмала можно узнать по синему цвету раствора при добавлении йода. После нагревания такой раствор теряет цвет, но при охлаждении снова становится синим. Фруктозу можно идентифицировать по реакции с резорцином в растворе c соляной кислотой — смесь приобретает вишневый цвет (проба Селиванова).
Все качественные реакции с органическими соединениями в рамках статьи описать невозможно, но в таблице ниже указаны самые важные из них.
💥 Видео
Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Качественные реакции на ОГЭ по химии | УмскулСкачать

ОГЭ. Задание 22. Решение задач. Часть 1. Растворы и осадки.Скачать

Расчет выхода продукта от теоретически возможного. 10 класс.Скачать

ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

#2.Правило определения взаимодействия веществ друг с другом.Правило Бертолле. Реакции ионного обменаСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Химия ПростоСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Гидролиз солей. 9 класс.Скачать

Химия 9 класс — Как определять Степень Окисления?Скачать

Качественные реакции на катионы. 9 класс.Скачать

8 класс. Массовая доля растворенного вещества. Решение задач.Скачать