Материалы портала onx.distant.ru
Определение характера среды водных растворов веществ. Индикаторы.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Среда водных растворов
Вода и водные растворы окружают нас повсюду. В воде и в водных растворах присутствуют ионы Н + и ОН — . Избыток или недостаток этих ионов определяет среду раствора.
В нейтральном растворе количество ионов водорода Н + равно количеству гидроксид-ионов ОН – .
[ Н + ] = [ ОН – ]
Если количество ионов водорода Н + больше количества гидроксид-ионов ОН – , то среда раствора кислая:
[ Н + ] > [ ОН – ]
Если количество ионов водорода Н + меньше количества гидроксид-ионов ОН – , то среда раствора щелочная:
[ Н + ] ОН – ]
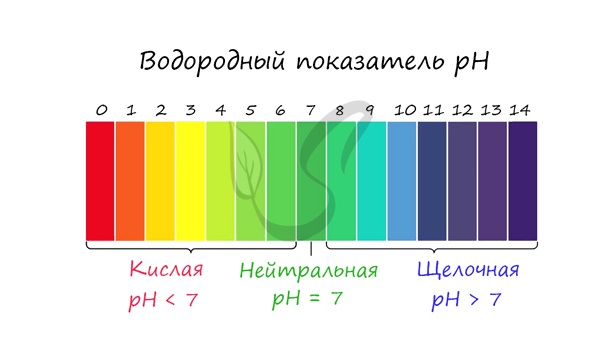
Для характеристики кислотности среды используют водородный показатель рН. Он определяется, как отрицательный десятичный логарифм концентрации ионов водорода. В нейтральной среде рН равен 7, в кислой — меньше 7, в щелочной — больше 7.
| Кислая среда | Нейтральная среда | Щелочная среда |
| [Н + ] > [ОН – ] | [Н + ] = [ОН – ] | [Н + ] – ] |
| pH | pH = 7 | pH > 7 |
Видео:Примеры решения задач на водородный показатель pH растворов. 11 класс.Скачать

Индикаторы
Для определения среды раствора используют специальные вещества, которые изменяют цвет в зависимости от среды раствора: индикаторы. В зависимости от среды эти вещества могут переходить в разные формы с различной окраской.
Чаще всего используют следующие индикаторы: лакмус, метилоранж, фенолфталеин.
Окраска индикаторов в различных средах:
| Индикатор/среда | Кислая | Нейтральная | Щелочная |
| Лакмус | Красный | Фиолетовый | Синий |
| Метилоранж | Красный | Оранжевый | Желтый |
| Фенолфталеин | Бесцветный | Бесцветный | Малиновый |
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Растворы кислот и оснований
Характер среды определяется процессами, которые происходят с веществами в растворе. Кислот, основания и соли в воде диссоциируют на ионы. Кислоты диссоциируют на катионы водорода H + и анионы кислотных остатков:
HA = H + + A –
При этом в растворе возникает избыток катионов водорода Н + , поэтому среда водных растворов кислот — кислая (что вполне логично).
Сильные кислоты диссоциируют в разбавленных растворах практически полностью, поэтому среда разбавленных растворов сильных кислот, как правило, сильно кислотная. Некоторые кислоты (слабые) диссоциируют частично, поэтому среда водных растворов слабых кислот — слабо кислая.
Основания диссоциируют на катионы металлов и гидроксид-анионы ОН – :
МеОH = Ме + + ОН –
При этом в растворе возникает избыток катионов гидроксид-анионов ОН – , поэтому среда водных растворов оснований — щелочная. Сильные основания (щелочи) хорошо растворимы в воде, поэтому среда их водных растворов — сильно щелочная. Нерастворимые основания в воде практически не растворяются, поэтому в водном растворе оказывается лишь небольшое количество ионов ОН – . Среда водного раствора аммиака слабо щелочная.
Видео:Гидролиз солей. 9 класс.Скачать

Растворы солей
Среда водных растворов солей определяется не только диссоциацией, но и особенностями взаимодействия катионов металлов и анионов кислотных остатков с водой — гидролизом солей .
Попадая в воду, соли диссоциируют на катионы металлов (или ион аммония NH4 + ) и анионы кислотных остатков.
Катионы металлов, которым соответствуют слабые основания, притягивают из воды ионы ОН – , при этом в воде образуются избыточные катионы водорода Н + . Протекает гидролиз по катиону. Катионы металлов, которым соответствуют сильные основания, с водой таким образом не взаимодействуют.
Например , катионы Fe 3+ подвергаются гидролизу:
Fe 3+ + HOH ↔ FeOH 2+ + H +
Анионы кислотных остатков, которым соответствуют слабые кислоты, притягивают из воды катионы Н + , при этом в воде остаются гидроксид-анионы ОН – . Протекает гидролиз по аниону. Анионы кислотных остатков сильных кислот таким образом с водой не взаимодействуют.
Например , ацетат-ионы (остаток уксусной кислоты CH3COOH) подвергаются гидролизу:
CH3COO — + HOH ↔ CH3COOH + OH —
В зависимости от состава соли водные растворы солей могут иметь кислую, нейтральную или щелочную среду.
Типы гидролиза солей в водных растворах:
| Катио н/анион | Катион сильного основания | Катион слабого основания |
| Анион сильной кислоты | Гидролиз не идет | Гидролиз по катиону |
| Анион слабой кислоты | Гидролиз по аниону | Гидролиз по катиону и аниону |
Среда водных растворов солей:
| Катио н/анион | Катион сильного основания | Катион слабого основания |
| Анион сильной кислоты | Нейтральная | Кислая |
| Анион слабой кислоты | Щелочна я | Нейтральная* |
* на практике среда водных растворов солей, образованных слабым основанием и слабой кислотой, определяется силой кислоты и основания
Тип гидролиза и среда водных растворов некоторых солей:
| Катио н/анион | Na + | NH4 + |
| Cl – | NаCl, гидролиз не идет, среда нейтральная | (NH4)2CO3 гидролиз по катиону, среда щелочная |
| CO3 2 – | Na2CO3, гидролиз по аниону, среда щелочна я | Na2CO3, гидролиз по катиону и аниону, среда определяется силой кислоты и основания |
Индикаторы будут по-разному окрашиваться в водных растворах таких солей, в зависимости от среды. Таким образом, с помощью индикаторов можно различить водные растворы некоторых солей.
Окраска лакмуса в водных растворах солей, в зависимости от строения соли:
| Катио н/анион | Катион сильного основания | Катион слабого основания |
| Анион сильной кислоты | Лакмус фиолетовый | Лакмус красный |
| Анион слабой кислоты | Лакмус синий | Окраска лакмуса зависит от силы кислоты и основания |
Окраска лакмуса в водных растворах некоторых солей:
| Катио н/анион | Na + | NH4 + |
| Cl – | NаCl, лакмус фиолетовый | (NH4)2CO3 лакмус красный |
| CO3 2 – | Na2CO3, лакмус синий | Na2CO3, окраска лакмуса зависит от силы кислоты и основания |
Добавить комментарий
Этот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Гидролиз
Гидролиз (греч. hydor — вода и lysis — разрушение) — процесс расщепления молекул сложных химических веществ за счет реакции с молекулами воды.
В химии, как и в жизни, разрушается чаще всего нестойкое и слабое (стойкое и сильное выдерживает удар). Запомните, что гидролиз (вода) разрушает «слабое» — это правило вам очень пригодится.
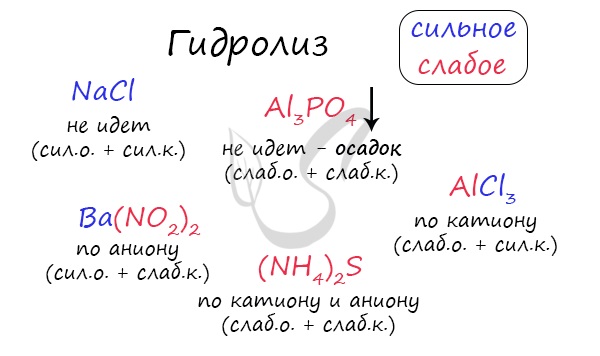
Любая соль состоит из остатка основания и кислоты. Абсолютно любая:
- NaCl — производное основания NaOH и кислоты HCl
- KNO3 — производное основания KOH и кислоты HNO3
- CuSO4 — производное основания Cu(OH)2 и кислоты H2SO4
- Al3PO4 — производное основания Al(OH)3 и кислоты H3PO4
- Ca(NO2)2 — производное основания Ca(OH)2 и кислоты HNO2
Чтобы успешно решать задания по теме гидролиза и писать реакции, вам следует запомнить, какие основания и кислоты являются слабыми, а какие — сильными.
При изучении гидролиза я рекомендую ученикам сохранить на гаджет схему, которую вы видите ниже. Для того, чтобы приобрести нужный опыт — она незаменима. Пользуйтесь ей как можно чаще, подглядывайте в нее и она незаметно окажется в вашем интеллектуальном составляющем 😉
По катиону, по аниону или нет гидролиза?
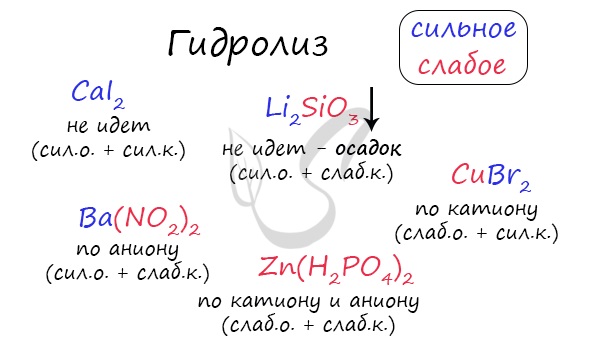
Итак, если в состав соли входит остаток сильного основания и остаток сильной кислоты — гидролиза не происходит. Примеры: NaCl, KBr, CaSO4. Также гидролиза не происходит, если соль нерастворима (вне зависимости от того, чем она образована): AlPO4, FeSO3, CaSO3.
Если в состав соли входит остаток слабого основания и остаток сильной кислоты, то гидролиз идет по катиону. Помните, что гидролиз разрушает слабое, в данном случае — катион. Примеры: AlCl3, MgBr2, Cr2SO4, NH4NO3.
Катион NH4 + и его основание NH4OH , несмотря на растворимость, является слабым, поэтому гидролиз будет идти по катиону в соли NH4Cl. Замечу также, что Ca(OH)2 считается растворимым основанием, поэтому гидролиза соли CaCl2 не происходит.
Если в состав соли входит остаток сильного основания и остаток слабой кислоты, то гидролиз идет по аниону. Примеры: K3PO4, NaNO2, Ca(OCl)2, Ba(CH3COO)2, Li2SiO3.
Если соль образована остатком слабого основания и слабой кислоты, то гидролиз идет и по катиону, и по аниону. Примеры: Mg(NO2)2, Al2S3, Cr2(SO3)3, CH3COONH4.
Среда раствора
Среда раствора может быть нейтральной, кислой или щелочной. Определяется типом гидролиза. Некоторые задания могут быть построены так, что, увидев соль, вы должны будете определить ее тип раствора.
Обрадую вас: если вы усвоили тему гидролиза, сделать это проще простого. В случае, когда гидролиз не идет или идет и по катиону, и по аниону среда раствора — нейтральная.
Если гидролиз идет по катиону (разрушается остаток основания) среда — кислая, если гидролиз идет по аниону (разрушается остаток кислоты), то среда раствора будет щелочная. Изучите примеры.
Однако замечу, что в дигидрофосфатах, гидросульфитах и гидросульфатах среда всегда кислая из-за особенностей диссоциации. Примеры: NH4H2PO4, LiHSO4. В гидрофосфатах среда щелочная из-за того, что константа диссоциации по третьей ступени меньше, чем константа гидролиза. Примеры: K2HPO4, Na2HPO4.
Попробуйте определить среду раствора для соединений из самостоятельного задания, которое вы только что решили. Ниже будет располагаться решение.
С целью запутать в заданиях часто бывают даны синонимы. Так «среду раствора» могут заменить водородным показателем pH.
Запомните, что кислая среда характеризуется pH 7.
Например, в соли CaCl2 среда раствора будет нейтральной (pH=7), а в растворе AlCl3 — кислой (pH
Видео:Составление ур-й окислительно-восст. реакций методом ионно-электронного баланса. 1ч. 10 класс.Скачать

1.4.7. Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная.
Для того, чтобы понять, что такое гидролиз солей, вспомним для начала, как диссоциируют кислоты и щелочи.
Общим между всеми кислотами является то, что при их диссоциации обязательно образуются катионы водорода (Н + ), при диссоциации же всех щелочей всегда образуются гидроксид-ионы (ОН − ).
В связи с этим, если в растворе, по тем или иным причинам, больше ионов Н + говорят, что раствор имеет кислую реакцию среды, если ОН − — щелочную реакцию среды.
Если с кислотами и щелочами все понятно, то какая же реакция среды будет в растворах солей?
На первый взгляд, она всегда должна быть нейтральной. И правда же, откуда, например, в растворе сульфида натрия взяться избытку катионов водорода или гидроксид-ионов. Сам сульфид натрия при диссоциации не образует ионов ни одного, ни другого типа:
Тем не менее, если бы перед вами оказались, к примеру, водные растворы сульфида натрия, хлорида натрия, нитрата цинка и электронный pH-метр (цифровой прибор для определения кислотности среды) вы бы обнаружили необычное явление. Прибор показал бы вам, что рН раствора сульфида натрия больше 7, т.е. в нем явный избыток гидроксид-ионов. Среда раствора хлорида натрия оказалась бы нейтральной (pH = 7), а раствора Zn(NO3)2 кислой.
Единственное, что соответствует нашим ожиданиям – это среда раствора хлорида натрия. Она оказалась нейтральной, как и предполагалось.
Но откуда же взялся избыток гидроксид-ионов в растворе сульфида натрия, и катионов-водорода в растворе нитрата цинка?
Попробуем разобраться. Для этого нам нужно усвоить следующие теоретические моменты.
Любую соль можно представить как продукт взаимодействия кислоты и основания. Кислоты и основания делятся на сильные и слабые. Напомним, что сильными называют те кислоты, и основания, степень диссоциации, которых близка к 100%.
примечание: сернистую (H2SO3) и фосфорную (H3PO4) чаще относят к кислотам средней силы, но при рассмотрении заданий по гидролизу нужно относить их к слабым.
Кислотные остатки слабых кислот, способны обратимо взаимодействовать с молекулами воды, отрывая от них катионы водорода H + . Например, сульфид-ион, являясь кислотным остатком слабой сероводородной кислоты, взаимодействует с ней следующим образом:
S 2- + H2O ↔ HS − + OH −
Как можно видеть, в результате такого взаимодействия образуется избыток гидроксид-ионов, отвечающий за щелочную реакцию среды. То есть кислотные остатки слабых кислот увеличивают щелочность среды. В случае растворов солей содержащих такие кислотные остатки говорят, что для них наблюдается гидролиз по аниону.
Кислотные остатки сильных кислот, в отличие от слабых, с водой не взаимодействуют. То есть они не оказывают влияния на pH водного раствора. Например, хлорид-ион, являясь кислотным остатком сильной соляной кислоты, с водой не реагирует:
То есть, хлорид-ионы, не влияют на pН раствора.
Из катионов металлов, так же с водой способны взаимодействовать только те, которым соответствуют слабые основания. Например, катион Zn 2+ , которому соответствует слабое основание гидроксид цинка. В водных растворах солей цинка протекают процессы:
Zn 2+ + H2O ↔ Zn(OH) + + H +
Zn(OH) + + H2O ↔ Zn(OH) + + H +
Как можно видеть из уравнений выше, в результате взаимодействия катионов цинка с водой, в растворе накапливаются катионы водорода, повышающие кислотность среды, то есть понижающие pH. Если в состав соли, входят катионы, которым соответствуют слабые основания, в этом случае говорят что соль гидролизуется по катиону.
Катионы металлов, которым соответствуют сильные основания, с водой не взаимодействуют. Например, катиону Na + соответствует сильное основание – гидроксид натрия. Поэтому ионы натрия с водой не реагируют и никак не влияют на pH раствора.
Таким образом, исходя из вышесказанного соли можно разделить на 4 типа, а именно, образованные:
1) сильным основанием и сильной кислотой,
Такие соли не содержат ни кислотных остатков, ни катионов металлов, взаимодействующих с водой, т.е. способных повлиять на pH водного раствора. Растворы таких солей имеют нейтральную реакцию среды. Про такие соли говорят, что они не подвергаются гидролизу.
2) сильным основанием и слабой кислотой
В растворах таких солей, с водой реагируют только кислотные остатки. Среда водных растворов таких солей щелочная, в отношении солей такого типа говорят, что они гидролизуются по аниону
Примеры: NaF, K2CO3, Li2S и т.д.
3) слабым основанием и сильной кислотой
У таких солей с водой реагируют катионы, а кислотные остатки не реагируют – гидролиз соли по катиону, среда кислая.
4) слабым основанием и слабой кислотой.
С водой реагируют как катионы, так и анионы кислотных остатков. Гидролиз солей такого рода идет и по катиону, и по аниону. Нередко такие соли подвергаются необратимому гидролизу.
Что же значит то, что они необратимо гидролизуются?
Поскольку в данном случае с водой реагируют и катионы металла (или NH4 + ) и анионы кислотного остатка, в раcтворе одновременно возникают и ионы H + , и ионы OH − , которые образуют крайне малодиссоциирующее вещество – воду (H2O).
Это, в свою очередь, приводит к тому, что соли образованные кислотными остатками слабых оснований и слабых кислот не могут быть получены обменными реакциями, а только твердофазным синтезом, либо и вовсе не могут быть получены. Например, при смешении раствора нитрата алюминия с раствором сульфида натрия, вместо ожидаемой реакции:
Наблюдается следующая реакция:
Тем не менее, сульфид алюминия без проблем может быть получен сплавлением порошка алюминия с серой:
При внесении сульфида алюминия в воду, он также как и при попытке его получения в водном растворе, подвергается необратимому гидролизу.
🎥 Видео
Проклятая химическая реакция 😜 #shortsСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Гидролиз солей. Классификация солей. Решение примеров.Скачать

Определение реакции среды растворов солей с помощью индикаторовСкачать

Решаем жгучий ПРОБНИК ЕГЭ ПО ХИМИИ 2024Скачать

Гидролиз солей. Среда растворов (кислая, нейтральная, щелочная)Скачать

Гидролиз солей. Теория для задания 23 ЕГЭ по химии.Скачать

Гидролиз солей. Опыт 2. Определение реакции среды в растворах солейСкачать

ГИДРОЛИЗ и определение СРЕДЫ РАСТВОРОВ! НОВОЕ 21 задание в ЕГЭ по ХИМИИ 2022Скачать

11 класс. Гидролиз солей.Скачать

"Видеоурок по химии № 2. Среды растворов солей"Скачать

ГИДРОЛИЗ СОЛЕЙ и ОПРЕДЕЛЕНИЕ СРЕДЫ РАСТВОРА #химияегэ #умскул #богданчагин #химияСкачать

Гидролиз солей. 1 часть. 11 класс.Скачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать