Соляная кислота
Физические свойства:
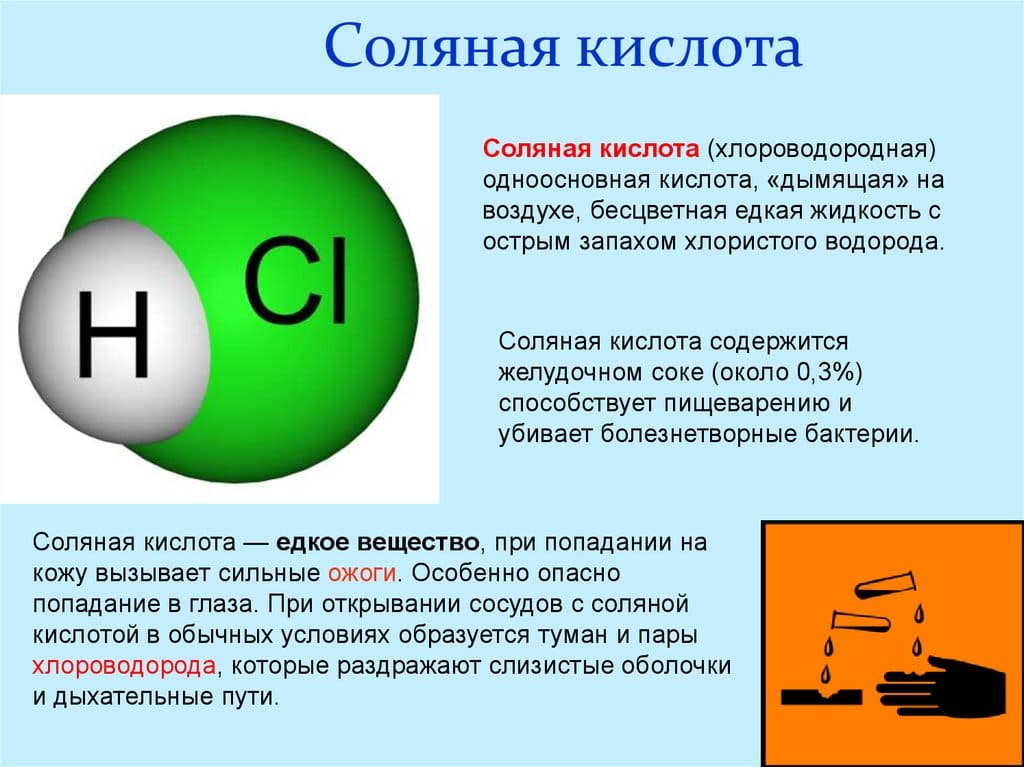
Концентрированная соляная кислота – это бесцветный раствор, сильно дымящий во влажном воздухе, с резким запахом.
Получение соляной кислоты:
Соляная кислота HCl получается при растворении газа хлороводорода воде. Хлороводород можно получить действием концентрированной серной кислоты на поваренную соль.
NaCl + H 2 SO 4 = HCl↑ + NaHSO 4 (хлороводород + гидросульфат натрия)
Химические свойства:
Раствор хлороводорода в воде — соляная кислота — сильная кислота:
1) реагирует с металлами , стоящими в ряду напряжений до водорода:
2Al + 6HCl = 2AlCl 3 + 3H 2
3) с оксидами металлов :
MgO + 2HCl = MgCl 2 + H 2 O
4) с основаниями и аммиаком :
HCl + KOH = KCl + H 2 O
3HCl + Al(OH) 3 = AlCl 3 + 3H 2 O
HCl + NH 3 = NH 4 Cl
5) с солями :
CaCO 3 + 2HCl = CaCl 2 + H 2 O + CO 2 ↑
HCl + AgNO 3 = AgCl↓ + HNO 3
Образование белого осадка хлорида серебра — AgCl, нерастворимого в минеральных кислотах используется в качестве качественной реакции для обнаружения анионов Cl — в растворе.
Хлориды металлов — соли соляной кислоты, их получают взаимодействием металлов с хлором или реакциями соляной кислоты с металлами, их оксидами и гидроксидами; путем обмена с некоторыми солями
2Fe + 3Cl 2 = 2FeCl 3
Mg + 2HCl = MgCl 2 + H 2
Fe + 2HCl = FeCl 2 + H 2
CaO + 2HCl = CaCl 2 + H 2 O
Ba(OH) 2 + 2HCl = BaCl 2 + 2H 2 O
Pb(NO 3 ) 2 + 2HCl = PbCl 2 ↓ + 2HNO 3
Большинство хлоридов растворимы в воде (за исключением хлоридов серебра, свинца и одновалентной ртути).
Применение соляной кислоты и ее солей:
1. Соляная кислота входит в состав желудочного сока и способствует перевариванию белковой пищи у человека и животных.
2. Хлороводород и соляная кислота используются для производства лекарств, красителей, растворителей, пластмасс.
3. Применение основных солей соляной кислоты:
KCl — удобрение, используется также в стекольной и химической промышленности.
HgCl 2 — сулема — яд, используется для дезинфекции в медицине, для протравливания семян в сельском хозяйстве.
Hg 2 Cl 2 — каломель — не ядовита, слабительное средство.
NaCl — поваренная соль — сырье для производства соляной кислоты, гидроксида натрия, водорода, хлора, хлорной извести, соды. Применяется в кожевенной и мыловаренной промышленности, в кулинарии и консервировании.
ZnCl 2 — для пропитки древесины против гниения, в медицине, при паянии.
AgCl — применяется в черно-белой фотографии, так как обладает светочувствительностью — разлагается на свету с образованием свободного серебра: 2AgCl = 2Ag + Cl 2
Задания для повторения и закрепления
№1. Осуществите превращения по схеме:
HCl → Cl 2 → AlCl 3 → Al(OH) 3 → Al 2 O 3 → AlCl 3 → Cl 2
№2. Расставьте коэффициенты методом электронного баланса в следующей реакции:
HCl + KClO 3 → KCl + H 2 O + Cl 2
Укажите окислитель и восстановитель; процессы окисления и восстановления.
Какое количество алюминия прореагирует с избытком соляной кислоты для получения 5,6 л водорода (н.у.)?
- Практическая работа 3. Получение соляной кислоты и изучение ее свойств.
- Получение соляной кислоты
- Химические свойства соляной кислоты
- Распознавание соляной кислоты и её солей
- Получение соляной кислоты
- Химические свойства соляной кислоты
- Распознавание соляной кислоты и её солей
- Описание соляной кислоты: формула, свойства и применение
- Формула и другие названия соляной кислоты
- Физические свойства
- Химические свойства
- Получение соляной кислоты
- Области применения
- В химической промышленности
- В металлургии
- В пищевой промышленности
- В быту
- В сельском хозяйстве
- В медицине
- В строительстве
- Интересные факты
- 🌟 Видео
Видео:распознавание растворов соляной, азотной и серной кислотСкачать

Практическая работа 3. Получение соляной кислоты и изучение ее свойств.
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Получение соляной кислоты
Соберите прибор, как показано на рисунке 13 (см. с. 56).
В пробирку насыпьте 2-3 г поваренной соли и прилейте концентрированную серную кислоту (2:1), чтобы она смочила всю соль. Закройте пробирку пробкой с газоотводной трубкой. Конец газоотводной трубки опустите в пробирку с водой так, чтобы он находился на расстоянии примерно 0,5-1,0 см от поверхности воды. Затем осторожно нагревайте смесь в первой пробирке в течение 5-6 мин. Следите, чтобы кислоту не перебросило в пробирку с водой!
Напишите уравнения химических реакций, протекающих между концентрированной серной кислотой и хлоридом натрия при обычных условиях (образуется гидрокарбонат натрия) и при сильном нагревании.
Чем вызвано появление во второй пробирке тонких струек, опускающихся вниз?
Почему конец газоотводной трубки должен находиться на расстоянии 0,5-1,0 см от поверхности воды?
Видео:Распознавание растворов соляной, азотной и серной кислот Сисекенова М МСкачать

Химические свойства соляной кислоты
Полученную при растворении хлороводорода в воде соляную кислоту разлейте поровну в шесть пробирок. В первую пробирку опустите лакмусовую бумагу, во вторую пробирку положите кусочек цинка или магниевые стружки, а в третью — кусочек меди. В четвёртую пробирку поместите немного оксида меди (II) и нагрейте раствор. В пятую пробирку поместите немного свежеприготовленного гидроксида меди (II), в шестую — немного мела или другого карбоната.
Со всеми ли металлами реагирует соляная кислота? Составьте уравнения реакций, протекающих между соляной кислотой и указанными металлами.
Как объяснить образование в четвёртой и пятой пробирках растворов синего цвета, а в шестой – выделение газа? Составьте уравнения соответствующих реакций.
Видео:Соляная кислота. Свойства и особенности. То чего вы не знали.Скачать

Распознавание соляной кислоты и её солей
В одну пробирку налейте 1-2 мл разбавленной соляной кислоты, во вторую — столько же раствора хлорида натрия, а в третью — раствор хлорида кальция. Во все пробирки добавьте по нескольку капель раствора нитрата серебра (I) или нитрата свинца (II) Pb(NO3)2. Проверьте, растворяется ли выпавший осадок в концентрированной азотной кислоте.
Напишите уравнения соответствующих реакций и подумайте, как можно отличить: а) соляную кислоту от других кислот; б) хлориды от других солей; в) растворы хлоридов от соляной кислоты.
Почему вместо раствора нитрата серебра (I) можно также использовать раствор нитрата свинца (II)?
Напишите уравнения проведенных реакций и ответьте на вопрос, что является реактивом на соляную кислоту и её соли.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Получение соляной кислоты
Реакция протекающая между концентрированной серной кислотой и хлоридом натрия при обычных условиях:
NaCl + H2SO4 ⇄ NaHSO4 + HCl
Реакция протекающая между концентрированной серной кислотой и хлоридом натрия при сильном нагревании:
2NaCl + H2SO4 t ⟶ Na2SO4 + 2HCl↑
Появление струек вызвано растворением хлороводорода в воде, образовавшаяся соляная кислота плотнее воды, поэтому она опускается на дно пробирки.
Конец газоотводной трубки должен находиться на расстоянии 0,5-1,0 см от поверхности воды, для того, чтобы не засосало воду в пробирку, где хлорид натрия реагирует с серной кислотой.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Химические свойства соляной кислоты
Соляная кислота окрашивает лакмусовую бумагу в красный цвет.
Соляная кислота реагирует с цинком, наблюдается выделение газа:
Zn + 2HCl ⟶ ZnCl2 + H2↑
Соляная кислота реагирует с магнием, наблюдается выделение газа:
Mg + 2HCl ⟶ MgCl2 + H2↑
Соляная кислота не реагирует с медью, т. к. в ряду напряжений металлов медь стоит после водорода.
Соляная кислота реагирует с оксидом меди (II), наблюдается окрашивание раствора в синий цвет (из-за ионов меди Cu 2+ ):
CuO + 2HCl t ⟶ CuCl2 + H2O
Соляная кислота реагирует с гидроксидом меди (II), наблюдается окрашивание раствора в синий цвет (из-за ионов меди Cu 2+ ):
Cu(OH)2 + 2HCl ⟶ CuCl2 + 2H2O
Соляная кислота реагирует с мелом, наблюдается выделение газа:
CaCO3 + 2HCl ⟶ CaCl2 + H2O + CO2↑
Видео:Хлороводородная кислота. 9 класс.Скачать

Распознавание соляной кислоты и её солей
При добавлении нитрата серебра (I) в пробирки с растворами хлороводорода, хлорида натрия и хлорида кальция, наблюдается выпадение белого творожистого осадка:
HCl + AgNO3 ⟶ HNO3 + AgCl↓
NaCl + AgNO3 ⟶ NaNO3 + AgCl↓
CaCl2 + 2AgNO3 ⟶ Ca(NO3)2 + 2AgCl↓
Выпавшие осадки растворяются в концентрированной азотной кислоте.
а) Соляную кислоту от других кислот можно отличить с помощью нитрата серебра (I), в результате реакции должен выпасть белый творожистый осадок хлорида серебра (I).
б) Хлориды от других солей можно отличить с помощью нитрата серебра (I), в результате реакции должен выпасть белый творожистый осадок хлорида серебра (I).
в) Растворы хлоридов от соляной кислоты можно с помощью лакмуса, в соляной кислоте он окрасится в красный цвет.
Вместо раствора нитрата серебра (I) можно также использовать раствор нитрата свинца (II) потому, что он с галогенидами тоже образует нерастворимое соединение – хлорид свинца (II).
Реактивом на соляную кислоту и её соли является нитрат серебра (I) или нитрат свинца (II).
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Описание соляной кислоты: формула, свойства и применение
Кислоты – это химические соединения способные отдавать протон или принимать электронную пару с образованием ковалентной связи. Данный класс веществ имеет различные классификации: по числу атомов водорода, по происхождению, по силе. Соляная кислота является сильной, одноосновной неорганической кислотой.
Видео:как проверить концентрацию кислотыСкачать

Формула и другие названия соляной кислоты
В состав соляной кислоты входят два химических элемента: хлор и водород. Данная кислота состоит из двух атомов и имеет формулу: HCl. Стоит отметить, что соляная кислота – это тривиальное название (т.е. название, применяемое в обиходной речи химиков, не отражающее состава). По международной номенклатуре ИЮПАК вещество с формулой HCl принято называть хлороводородной кислотой. Иногда HCl называют хлористоводородной кислотой или хлористым водородом, также приемлемо название – хлорид водорода.
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Физические свойства
Физические свойства HCl коррелируют с концентрацией данного соединения в растворе. Для того, чтобы не перегружаться цифрами, рассмотрим физические свойства хлористого водорода на примере его концентрированной формы (около 36%):
- низкая температура кипения (t=48 градусов по Цельсию);
- высокая температура плавления (t=30 градусов по Цельсию);
- плотность составляет 1,18 г/см 3 ;
- хлорид водорода обладает способностью к ионизации в водных растворах.
- при низкой температуре приобретает гидратную оболочку: HCL*H20 или HCl*2H2O;
- растворы хлороводородной кислоты бесцветные;
- в чистом виде находится в газообразном агрегатном состояние (а в растворах в жидкой форме);
- во влажном воздухе концентрированные растворы HCl могут сильно дымиться;
- соляная кислота – вещество, обладающее резким запахом.
Видео:Опыты по химии. Реакция нейтрализацииСкачать

Химические свойства
Химические свойства хлорида водорода можно подразделить на общие (характерные для всех соединений, основным свойство которых является отдача протона) и специфические (характерные только для HCl). Общие свойства:
- Изменение окраски индикаторов за счет присутствия в растворе H + .
- Взаимодействует с металлами, стоящими до водорода в электрохимическом ряду напряжения металлов, с образованием газообразного водорода: Mg + 2HCL = MgCl2 + H2(газ).
- Взаимодействует с растворами щелочей – реакция нейтрализации (образование соли и воды посредством взаимодействия кислоты и основания): 2NaOH + 2HCl = H2O + 2NaCl.
- Реагирует с основными оксидами с образование соли и воды: MgO + 2HCL = H2O + MgCl.
- Реагирует с растворами солей (реакция обмена): 2HCL + Na2SO4 = H2SO4 + 2NaCl.
- Взаимодействует с большинством органических соединений (спирты, алкены, алкины, галогенпроизводные и так далее): CH2=CH2 + HCl = CH3-CH2-Cl.
Специфические свойства соляной кислоты:
- Реагирует нитратом серебра (качественная реакция): AgNO3: AgNO3 + HCl = AgCl (осадок белого цвета) + HNO3;
- Вступает в реакцию с сильными окислителями (оксид марганца, перманганат калия и другие): MnO2+4HCl=4Cl2+MnCl2+2H2O. Данная реакция протекает в условия нагревания.
Видео:Химические свойства соляной кислотыСкачать

Получение соляной кислоты
Промышленный способ получения хлористого водорода заключается в горении водорода в хлоре и последующим растворением образовавшегося вещества в воде. Существует и другой способ получения хлороводородной кислоты, применяемый в лабораторных условиях. Суть способа заключается в реакции поваренной соли(NaCl) с концентрированно серной кислотой при нагревании. В результате получаются следующие соединения: гидросульфат натрия и хлорид водорода, если провести химическое взаимодействие между образовавшимися продуктами, то образуется сульфат натрия и 2 молекулы хлористого водорода. Приведем общее уравнение реакции: 2NaCl + H2SO4 = Na2SO4 + 2HCl.
Видео:Начинаем решать 10-й вариант сборника Добротина (номера 1-28)Скачать

Области применения
Хлорид водорода является ключевым реагентом в химической промышленности, однако данное соединение нашло себе применение во многих отраслях человеческого деятельности.
В химической промышленности
В химической промышленности хлористый водород применяют для синтез хлорорганических соединений, а хлорсодержащих солей различных металлов.
В металлургии
В металлургии HCl используется с целью очистки металла после лужения (процесса нанесения олова с целью защиты металла от коррозии).
В пищевой промышленности
33% раствор HCl активно применяют в пищевом производстве в качестве регулятора pH, предназначенного для очистки воды.
В быту
В домохозяйстве HCl используют в составе моющих, хлорсодержащих средств.
В сельском хозяйстве
В сельскохозяйственной деятельности HCl применяется в составе хлорорганических веществ, которые используются в качестве органических ядохимикатов.
В медицине
В медицинской практике применяют слабые растворы хлористого водорода с целью улучшения пищеварения.
В строительстве
В строительстве HCl используют для очистки красного кирпича от грязи. Также использование растворов HCl повышает морозостойкость и влагостойкость бетонных конструкций, что способствует постройке более долгоживущих зданий.
Видео:Опыты по химии. Соляная кислота и металлыСкачать

Интересные факты
Приведем ряд фактов о хлороводородной кислоте, которые удивят обывателя:
- Хлористый водород способен полностью исправиться. Дело в том, что при высоких температурах соединение переходит в свое основное агрегатное состояние – газообразное и насыщает атмосферу молекулами хлора и водорода.
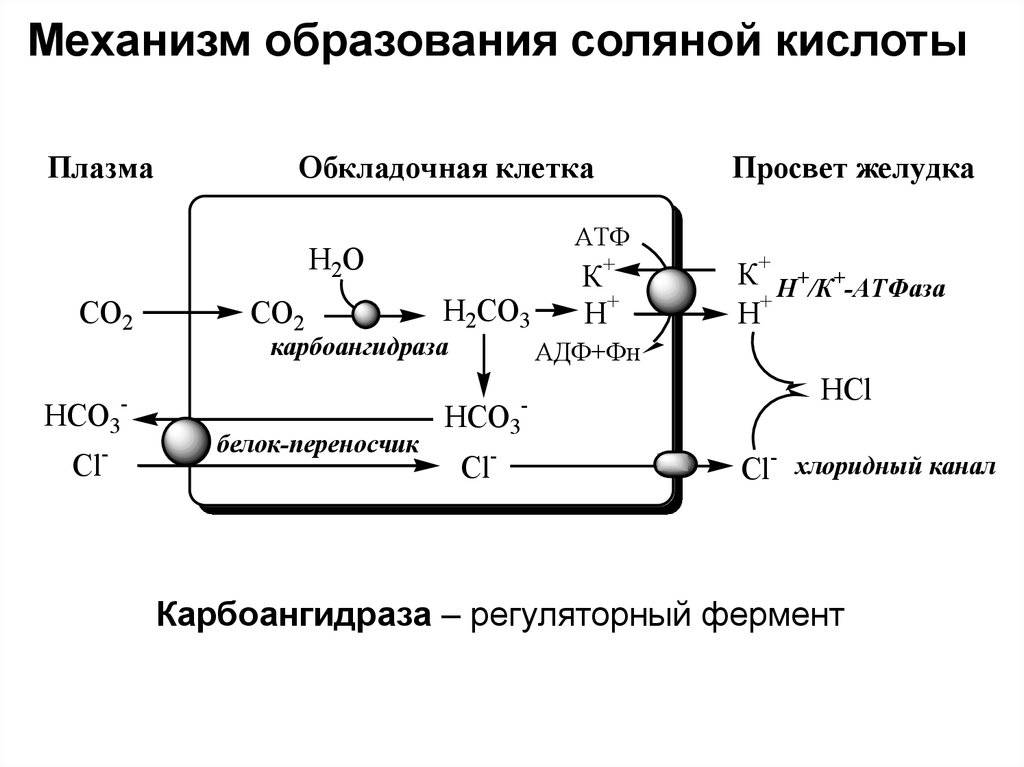
- Соляная кислота вырабатывается париетальными клетками желудка человеческого организма в небольшой концентрации (0,3%). Она создает необходимую кислотность среды, в которой наиболее активно протекают ферментативные процессы расщепления питательных веществ.
- При пониженной кислотности желудка, в нем развиваются лактобактерии. Данный факт указывает на еще одно свойство HCl – способность уничтожать бактерии. Данное свойство выражает в еще одной её функции в организме человека – бактерицидной.
🌟 Видео
Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

СОЛЯНАЯ КИСЛОТА ИЗ ВОДЫ И СОЛИ! ПРОЩЕ НЕ ПРИДУМАТЬ...Скачать

Как сделать соляную кислоту. Самый простой способ.Скачать

Химия 9 класс — Как определять Степень Окисления?Скачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

СОЛИ ХИМИЯ 8 КЛАСС: Химические Свойства Солей и Получение // Реакция Солей с Кислотами и МеталламиСкачать