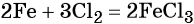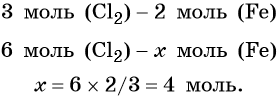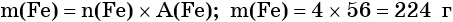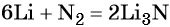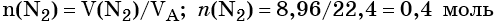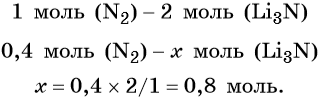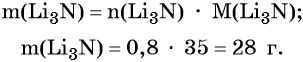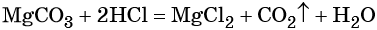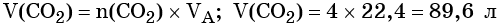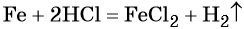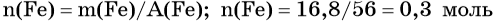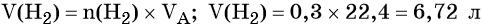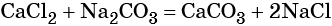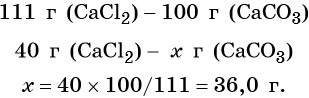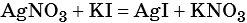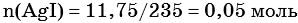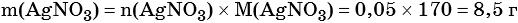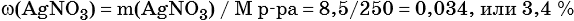Основой для проведения количественных расчётов в химии является закон сохранения массы. Согласно этому закону масса реагентов равна массе продуктов реакции.
Отсюда следует, что для любой химической реакции массы реагентов и продуктов реакции относятся между собой как молярные массы веществ, умноженные на их стехиометрические коэффициенты.
Для расчёта по химическим уравнениям можно использовать два эквивалентных способа: через количество вещества или через пропорцию. Подчеркнём ещё раз: официального запрета на использование метода пропорций при решении задач на ОГЭ и ЕГЭ нет!
Для определения массы (или количества вещества) продуктов реакции или исходных веществ по уравнениям химических реакций вначале составляют уравнение химической реакции и устанавливают стехиометрические коэффициенты; затем определяют молярную массу, массу и количество вещества известных реагентов химической реакции; составляют и решают пропорцию, в которую в зависимости от условий задачи вводят числовые значение величин: молярные массы, массы, количества веществ или их объёмы (для газов).
При этом в одном столбце пропорций должны находиться одинаковые характеристики вещества с одной и той же размерностью.
Пример 1. Масса железа, вступившего в реакцию с 6 моль хлора, равна _________ г. (Ответ запишите с точностью до целого числа.)
Решение. Составляем уравнение химической реакции:
Из этого уравнения следует, что 3 моль Cl2 реагируют с 2 моль Fe, т. е.:
Определяем массу железа:
Пример 2. Масса нитрида лития, образовавшегося в результате его реакции с азотом объёмом 8,96 л, равна_______________ г.
Решение. Составляем уравнение химической реакции:
Определяем количество вещества азота, вступившего в реакцию:
Из уравнения реакции следует, что из 1 моль N2 образуется 2 моль Li3N, т. е.:
Определим массу Li3N:
Пример 3. Объём углекислого газа, образовавшегося в результате разложения карбоната магния количеством вещества 4 моль избытком соляной кислоты, равен________ л.
Решение. Составляем уравнение химической реакции:
Из этого уравнения следует, что количество вещества углекислого газа и карбоната магния равны между собой, т. е. n(CO2) = 4 моль.
Пример 4. Объём водорода, который выделится при растворении 16,8 г железа в избытке разбавленной соляной кислоты, равен _________ л.
Решение. Составляем уравнение химической реакции:
Определим количество вещества железа:
Количество вещества железа и водорода в данном уравнении реакции равны между собой. Следовательно, количество вещества водорода также равно 0,3 моль.
Вычислим объём водорода:
Пример 5. Масса осадка, который образуется в результате взаимодействия 40,0 г хлорида кальция с избытком карбоната натрия, равна _________г.
Решение. Составляем уравнение реакции:
Согласно уравнению химической реакции составим пропорцию и решим её:
Пример 6. 250 г раствора нитрата серебра смешали с избытком раствора йодида калия. Выпал осадок массой 11,75 г. Вычислите массовую долю нитрата серебра в исходном растворе.
Элементы ответа (допускаются иные формулировки ответа, не искажающие его смысла)
1) Составлено уравнение химической реакции:
2) По массе осадка йодида серебра рассчитано его количество вещества, а затем в соответствии с уравнением реакции — количество вещества и масса нитрата серебра, содержащегося в исходном растворе:
Из уравнения реакции следует, что n(AgI) = n(AgNO3) = 0,05 моль, тогда:
3) Вычислена массовая доля нитрата серебра в исходном растворе:
| Критерии оценивания | Баллы |
| Ответ правильный и полный, включает все названные элементы | 3 |
| Правильно записаны два первых элемента из названных выше | 2 |
| Правильно записан один из названных выше элементов (1-й или 2-й) | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 3 |
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Тренировочные задания
1. К 300 г раствора нитрата бария прибавили избыток раствора сульфата натрия. Масса выпавшего осадка составила 23,3 г. Определите концентрацию соли в исходном растворе.
2. К 150 г раствора сульфата натрия прибавили избыток раствора хлорида бария. Масса выпавшего осадка составила 23,3 г. Определите концентрацию соли в исходном растворе.
3. К 300 г раствора силиката натрия прибавили избыток раствора нитрата кальция. Масса выпавшего осадка составила 12,0 г. Определите концентрацию соли в исходном растворе.
4. К 150 г раствора карбоната калия прибавили избыток раствора соляной кислоты. При этом выделился газ объёмом 3,36 л (н. у.). Определите концентрацию соли в исходном растворе.
5. К 250 г раствора гидрокарбоната натрия прибавили избыток раствора бромоводородной кислоты. При этом выделился газ объёмом 5,6 л. Определите концентрацию соли в исходном растворе.
6. К 50 г раствора карбоната натрия прибавили избыток раствора хлорида бария. Масса выпавшего осадка составила 7,88 г. Определите концентрацию соли в исходном растворе.
7. К 200 г раствора хлорида бария прибавили избыток раствора карбоната калия. Масса выпавшего осадка составила 7,88 г. Определите концентрацию соли в исходном растворе.
8. К 200 г раствора хлорида железа (II) прибавили избыток раствора гидроксида калия. Масса выпавшего осадка составила 18,0 г. Определите концентрацию соли в исходном растворе.
9. К 400 г раствора нитрата свинца прибавили избыток раствора йодида натрия. Масса выпавшего осадка составила 23,05 г. Определите концентрацию соли в исходном растворе.
10. К 300 г раствора йодида натрия прибавили избыток раствора нитрата свинца. Масса выпавшего осадка составила 23,05 г. Определите концентрацию соли в исходном растворе.
11. Определите массу осадка, который выпадет при взаимодействии 150 г 14,8%-ного раствора хлорида кальция с избытком раствора карбоната натрия.
12. Определите объём газа (н. у.), который выделится при взаимодействии 120 г 8,8%-ного раствора карбоната натрия с избытком раствора соляной кислоты.
13. Определите массу соли, которая выпадет в осадок при взаимодействии 140 г 13,5%-ного раствора нитрата цинка с избытком раствора сульфида натрия.
14. Определите массу осадка, который выделится при взаимодействии 200 г 18,8%-ного раствора нитрата меди с избытком раствора сульфида натрия.
15. Определите массу осадка, который выпадет при взаимодействии 200 г 6,1%-ного раствора силиката натрия с избытком раствора хлорида цинка.
16. Определите массу осадка, который выделится при взаимодействии 200 г 12,7%-ного раствора хлорида железа (II) с избытком раствора сульфида натрия.
17. Определите массу осадка, который выделится при взаимодействии 50 г 17%-ного раствора нитрата серебра с избытком раствора бромида калия.
18. Определите массу осадка, который образуется при взаимодействии 200 г 6,1%-ного раствора силиката натрия с избытком раствора нитрата кальция.
19. Определите массу осадка, который образуется при взаимодействии 50 г 5,8%-ного раствора хлорида магния с избытком раствора фосфата натрия.
20. Определите объём газа, который выделится при взаимодействии 200 г 6,9%-ного раствора карбоната калия с избытком раствора соляной кислоты.
21. Оксид фосфора (V) массой 21,3 г растворили в растворе гидроксида калия, в результате чего был получен раствор средней соли массой 500 г. Определите концентрацию фосфата калия в конечном растворе.
22. Раствор хлорида железа (II) полностью прореагировал со 120 г раствора гидроксида натрия, в результате чего образовалось 6,0 г осадка. Определите массовую долю гидроксида натрия в исходном растворе.
23. Какой объём аммиака (н. у.) может полностью прореагировать со 150 г 20%-ного раствора серной кислоты с образованием средней соли?
24. В 200 г 20%-ного раствора соляной кислоты растворили магний до прекращения выделения газа. Определите объём выделившегося при этом водорода (н. у.).
25. Аммиак объёмом 10 л (н. у.) пропустили через раствор серной кислоты с массовой долей 8% до образования средней соли. Определите массу исходного раствора.
26. Определите объём сероводорода (н. у.), который необходимо пропустить через 130 г 6%-ного раствора хлорида меди (II) до полного осаждения сульфида меди (II).
27. Сероводород объёмом 3,36 л (н. у.) пропустили через раствор гидроксида натрия, в результате чего получили 180 г раствора сульфида натрия. Определите массовую долю соли в полученном растворе.
28. Алюминий массой 8,1 г может нацело прореагировать с 250 г раствора серной кислоты. Определите массовую долю серной кислоты в исходном растворе.
29. К 250 г раствора нитрата серебра добавили раствор хлорида калия до прекращения выделения осадка, масса которого составила 14,35 г. Определите массовую долю нитрата серебра в исходном растворе.
30. К 300 г 5%-ного раствора хлорида магния добавили избыток раствора фосфата калия. Вычислите массу выпавшего при этом осадка.
Видео:Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

Как определить массу вещества по уравнению реакции
В условиях задач такого типа указаны массы или объёмы двух реагирующих веществ, одно из которых дано в избытке, поэтому при решении таких задач нужно определить, какое вещество взято в избытке. Расчёт массы или объёма продукта реакции ведётся по данным вещества взятого в недостатке.
I. Алгоритм решения задачи: «Вычисление массы или количества продукта реакции, если один из реагентов взят в избытке»
Пример 1. Смешали два раствора, содержащих соответственно 33,3г хлорида кальция и 16,4г фосфата натрия. Вычислите массу осадка.
Последовательность выполнения действий
Оформление решения задачи
1. Записываем условие задачи
2. Вычислим молярные массы для формул, записанных вдано
3. Вычислим количества веществ, масса которых дана в условии
4. Запишем УХР. Расставим коэффициенты.
Под формулами напишем стехиометрические соотношения, отображаемые уравнением реакции.
5. Определим, какой из реагентов взят в избытке. Для этого сравним дроби.
CaCl2 – взят в избытке, расчёт ведём по недостатку, т.е. поNa3PO4.
6. Вычислим количество вещества, массу которого нужно найт
7.Вычислим искомую массу
8. Запишем ответ
Пример 2. Вычислите объём водорода (н.у.), который образуется при взаимодействии 6,5 г цинка с соляной кислотой массой 7,5 г.
Последовательность выполнения действий
Оформление решения задачи
1. Записываем условие задачи
2. Вычислим молярные массы для веществ с известной массой, записанных в дано
3. Вычислим количества веществ, масса которых дана в условии
ν(Zn) = m/M= 6,5/65г/моль=0,1моль
4. Запишем УХР. Расставим коэффициенты.
Под формулами напишем стехиометрические соотношения, отображаемые уравнением реакции.
5. Определим, какой из реагентов взят в избытке. Для этого сравним дроби.
НCl – взят в избытке, расчёт ведём по недостатку, т.е. по Zn.
6. Вычислим количество вещества, объём которого нужно найти
7.Вычислим искомый объём
8. Запишем ответ
II. Алгоритм решения задач на «Избыток — недостаток» (в общем виде)
Расчёты по уравнению реакции, если один из реагентов взят в избытке
Дано: m (ν, V, W) реагентов
Найти: m (ν, V, W) продукта
1. Составляем уравнение реакции
2. Нахождение количества вещества реагентов ν(А) и ν(В):
3. Сравнение дробей – нахождение недостатка:
Если, ν(А)/a > ν(В)/b, то вещество В в недостатке, расчёт ν(С) ведём по ν(В)
© 2017 Персональный сайт учителя химии Кардаевой Татьяны Александровны. Все права защищены.
Hекоторые файлы и информация, находящиеся на данном сайте, были взяты из методической литературы, найдены в сети Интернет, как свободно распространяемые (авторство данных материалов сохранено). Если Вы являетесь правообладателем той или иной продукции или информации, и условия, на которых она представлена на данном ресурсе, не соответствуют действительности, просьба сообщить об этом с целью устранения правонарушения.
Видео:ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Как решать задачи по химии. Расчет по уравнениям химических реакций.
Как решать задачи по химии? Как проводить простейшие расчеты по уравнениям химических реакций? Сколько выделяется газа, образуется воды, выпадает осадка или сколько получается конечного продукта реакций? Сейчас мы постараемся разобрать все нюансы и ответить на эти вопросы, которые очень часто возникают при изучении химии.
Решение задач в химии является неотъемлемой частью в изучении этой сложной, но очень интересной науки.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Химия ПростоСкачать

Алгоритм решения задач по химии
- Прочитать условия задачи (если они есть). Да, об этом все знают — как же решить задачу без условий — но все же, для полноты инструкции, мы не могли не указать этот пункт.
- Записать данные задачи. На этом пункте мы не будем заострять внимание, так как требования различных учебных заведений, учителей и преподавателей могут значительно отличаться.
- Записать уравнение реакции. Теперь начинается самое интересное! Здесь нужно быть внимательным! Обязательно необходимо верно расставить коэффициенты перед формулами веществ. Если вы забудете это сделать, то все наши усилия буду напрасны.
- Провести соответствующие расчеты по химическому уравнению. Далее рассмотрим, как же сделать эти самые расчеты.
Для этого у нас есть два пути, как решить задачу по химии. Условно, назовем их правильным (используя понятия количества вещества) и неправильным (используя пропорции). Конечно же, мы бы рекомендовали решать задачи правильным путем. Так как у неправильного пути имеется очень много противников. Как правило, учителя считают, что ученики, решающие задачи через пропорции, не понимают самой сути протекания процессов химических реакций и решают задачи просто математически.
Видео:МОЛЯРНАЯ МАССА ХИМИЯ // Урок Химии 8 класс: Относительная Молекулярная МассаСкачать

Расчет по уравнениям химических реакций с использованием понятия количества вещества
Суть данного метода, состоит в том, что вещества реагируют друг с другом в строгом соотношении. И уравнение реакции, которое мы записали ранее, дает нам это соотношение. Коэффициенты перед формулами веществ дают нам нужные данные для расчетов.
Для примера, запишем простую реакцию нейтрализации серной кислоты и гидроксида натрия.
H_SO_ + NaOH → Na_SO_ + H_O
H_SO_ + 2NaOH → Na_SO_ + 2H_O
Исходя из этого уравнения, мы видим, что одна молекула серной кислоты взаимодействует с двумя молекулами гидроксида натрия. И в результате этой реакции получается одна молекула сульфата натрия и две молекулы воды.
Сейчас мы немного отступим от разбора задач, чтобы познакомиться с основными понятиями, которые пригодятся нам в решении задач по химии.
Рассчитывать количество молекул, например в 98 граммах серной кислоты — это не самое удобное занятие. Числа будут получаться огромными ( ≈ 6,022140857⋅10 23 молекул в 98 граммах серной кислоты) . Для этого в химии ввели понятие количества вещества (моль) и молярная масса.
1 Моль (единица измерения количества вещества) — это такое количество атомов, молекул или каких либо еще структурных единиц, которое содержится в 12 граммах изотопа углерода-12. Позднее выяснилось, что в 12 граммах вещества углерод-12 содержится 6,022140857⋅10 23 атомов. Соответственно, можно сказать, что 1 моль, это такая масса вещества, в которой содержится 6,022140857⋅10 23 атомов (или молекул) этого вещества.
Но ведь молекулы и атомы имеют различный состав и различное строение. Разные атомы содержат разное количество протонов и нейтронов. Соответственно 1 моль для разных веществ будет иметь разную массу, имея при это одинаковое количество молекул ( атомов). Эта масса называется молярной.
Молярная масса — это масса 1 моля вещества.
Используя данные понятия, можно сказать, что 1 моль серной кислоты реагирует с 2 молями гидроксида натрия, и в результате получается 1 моль сульфата натрия и 2 моль воды. Давайте запишем эти данные под уравнением реакции для наглядности.
beginH_SO_ & + & 2NaOH & → & Na_SO_ & + & 2H_O \ 1 : моль & & 2 : моль & & 1 : моль & & 2 : моль end
Следом запишем молярные массы для этих веществ
begin H_SO_ & + & 2NaOH & → & Na_SO_ & + & 2H_O \ 1 : моль & & 2 : моль & & 1 : моль & & 2 : моль \ 98 : г& & 40 : г & & 142 : г & & 18 : г end
Теперь, зная массу одного из веществ, мы можем рассчитать, сколько нам необходимо второго вещества для полного протекания реакции, и сколько образуется конечных продуктов.
Для примера, решим по этому же уравнению несколько задач.
Задача. Сколько грамм гидроксида натрия (NaOH) необходимо для того, чтобы 49 грамм серной кислоты (H2SO4) прореагировало полностью?
Итак, наши действия: записываем уравнение химической реакции, расставляем коэффициенты. Для наглядности, запишем данные задачи над уравнением реакции. Неизвестную величину примем за Х. Под уравнением записываем молярные массы, и количество молей веществ, согласно уравнению реакции:
begin49 : г & & X : г & & & & \ H_SO_ & + & 2NaOH & → & Na_SO_ & + & 2H_O \ 1 : моль & & 2 : моль & & 1 : моль & & 2 : моль \ 98 : г& & 40 : г & & 142 : г & & 18 : г end
Записывать данные под каждым веществом — не обязательно. Достаточно это будет сделать для интересующих нас веществ, из условия задачи. Запись выше дана для примера.
Примерно так должны выглядеть данные, записанные по условиям задачи. Не претендуем на единственно правильное оформление, требования у всех разные. Но так, как нам кажется, смотрится все довольно наглядно и информативно.
Первое наше действие — пересчитываем массу известного вещества в моли. Для этого разделим известную массу вещества (49 грамм) на молярную массу:
4998=0,5 моль серной кислоты
Как уже упоминалось ранее, по уравнению реакции 1 моль серной кислоты реагирует с 2 моль гидроксида натрия. Соответственно с 0,5 моль серной кислоты прореагирует 1 моль гидроксида натрия.
n(NaOH)=0.5*2=1 моль гидроксида натрия
Найдем массу гидроксида натрия, умножив количество вещества на молярную массу:
1 моль * 40 г/моль = 40 грамм гидроксида натрия.
Ответ: 40 грамм NaOH
Как видите, в решении задачи по уравнению реакции нет ничего сложного. Задача решается в 2-3 действия, с которыми справятся ученики начальных классов. Вам необходимо всего лишь запомнить несколько понятий.
Видео:Химия. 9 класс. Вычисление массы вещества по уравнению реакции, если известна масса другого веществаСкачать

Решение задач по химии через пропорцию
Ну и расскажем про второй способ вычислений по уравнениям химических реакций — вычисления через пропорцию. Этот способ может показаться немного легче, так как в некоторых случаях можно пропустить стадию перевода массы вещества в его количество. Чтобы было более понятно, объясню на том же примере.
Так же, как и в прошлом примере, запишем уравнение реакции, расставим коэффициенты и запишем над уравнением и под уравнением известные данные.
Для этого способа, нам так же понадобится записать под уравнением реакции, следом за молярной массой, массу вещества, соответствующую его количеству по уравнению. Если проще, то просто перемножить две строки под уравнением реакции, количество моль и молярную массу. Должно получиться так:
begin49 : г & & X : г & & & & \ H_SO_ & + & 2NaOH & → & Na_SO_ & + & 2H_O \ 1 : моль & & 2 : моль & & 1 : моль & & 2 : моль \ 98 : г& & 40 : г & & 142 : г & & 18 : г \ 98 : г & & 80 : г & & 142 : г & & 36 : г end
А теперь внимание, начинается магия! Нас интересует строка данных над уравнением, и самая нижняя строка под уравнением. Составим из этих данных пропорцию.
Далее находим неизвестное значение Х из пропорции и радуемся полученному значению:
Х=49*80/98=40 грамм
Как видим, получается тот же результат. Прежде всего, при решении задач в химии, главное все же — понимание химических процессов. Тогда решение задачи не станет для вас проблемой!
🌟 Видео
Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Молярная масса. 8 класс.Скачать

8 класс.Ч.1.Решение задач по уравнению реакций.Скачать

Решаем два варианта Добротина за 2 часаСкачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Закон сохранения массы веществ. 8 класс.Скачать

Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 1 ч. 9 класс.Скачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Решение задач на термохимические уравнения. 8 класс.Скачать

Задачи на примеси. 1 часть. 9 класс.Скачать

7. Решение задач по химическим уравнениям. Как найти массу, объем и количество вещества по реакции?Скачать

Химия 8 класс (Урок№7 - Закон сохранения массы веществ. Химические уравнения.)Скачать

Вычисление массы продукта реакции по изв-ной массе исходного вещ-ва, сод-го примеси. 10 класс. 1ч.Скачать