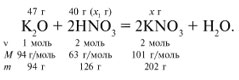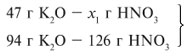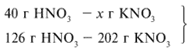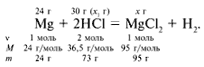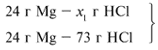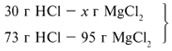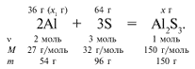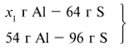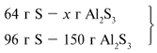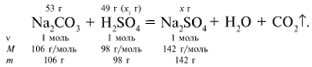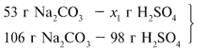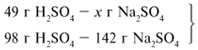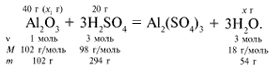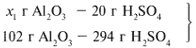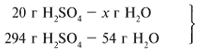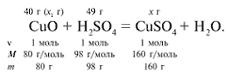на «избыток–недостаток»
в курсе основной
общеобразовательной школы
Умение решать химические задачи – важная составляющая знаний по предмету. Согласно государственному стандарту образования по химии учащиеся, оканчивающие школу, должны уметь решать более десятка типов стандартных задач. Среди них и задачи на «избыток–недостаток».
Предлагаю свой вариант подачи материала по решению таких задач в курсе химии 9-го класса.
На изучение этой темы отвожу 2–2,5 урока, в зависимости от уровня способностей учеников класса. Ознакомление с алгоритмом решения задач данного типа происходит в рамках изучения темы «Теория электролитической диссоциации». Однако если класс сильный, то в рамках эксперимента этот тип задач иногда изучаем и в конце 8-го класса в главе «Галогены», а высвободившееся время можно потратить на изучение органической химии в курсе 9-го класса.
На первом уроке разбираю два типа задач на «избыток–недостаток»:


В качестве домашнего задания обязательно предлагаются две-три задачи, подобные изученным на уроке.
На втором уроке закрепляю и углубляю изученный материал, ввожу понятия «процентная концентрация растворов веществ», вступивших в реакцию, «плотность растворов». Кроме того, усложняю задачи, вводя «процентное содержание примесей в исходном веществе» и т. д. Такой прием позволяет повторить элементы уже изученного материала, сэкономить время. В конце второго урока изучения темы или в начале третьего провожу небольшую самостоятельную работу на закрепление изученного материала, включающую одну-две задачи, причем самостоятельная работа предлагается в трех уровнях сложности, в зависимости от способностей ученика.
- Урок 1
- Решение задач на «избыток–недостаток»
- Домашнее задание
- Химия, Биология, подготовка к ГИА и ЕГЭ
- 4.3.5. Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси).
- Пример задачи на избыток и недостаток
- Пример задачи на расчет количества продукта, зная массу реагента с примесями
- 🌟 Видео
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Урок 1
Видео:Задачи на ИЗБЫТОК и НЕДОСТАТОК | Самое простое объяснениеСкачать

Решение задач на «избыток–недостаток»
Цели.
- научить алгоритму решения задач нового типа;
- закрепить навыки устного счета;
- повторить правила расчета относительных молекулярных масс веществ;
- закрепить правила грамотного оформления условия задачи;
- формировать навыки химического мышления, логики, а также способствовать воспитанию гармоничной, всесторонне развитой личности.
ХОД УРОКА

Решая химические задачи, следует не забывать о правилах их грамотного оформления по схеме: дано, найти, решение, ответ.
ЗАДАЧА 1. На 47 г оксида калия подействовали раствором, содержащим 40 г азотной кислоты. Найдите массу образовавшегося нитрата калия.
Решение
Рассчитаем относительные молекулярные массы интересующих нас веществ:
Для удобства расчета за х1 примем массу НNО3 и найдем, какое из веществ, вступивших в реакцию, дано в избытке, какое – в недостатке.
Следовательно, азотная кислота дана в недостатке, т. к. по условию ее 40 г, а по расчету необходимо 63 г, поэтому расчет ведем по HNO3:
ЗАДАЧА 2. На 24 г металлического магния подействовали 100 г 30%-го раствора соляной кислоты. Найдите массу образовавшегося хлорида магния.
m(Mg) = 24 г,
m(р-р HCl) = 100 г, 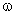
Решение
Рассчитаем относительные молекулярные массы интересующих нас веществ:
Для удобства расчета за х1 примем массу соляной кислоты и найдем, какое из веществ, вступивших в реакцию, дано в избытке, какое – в недостатке.
Из расчета видно, что соляная кислота дана в недостатке, т. к. по условию задачи ее дано 30 г, а для реакции требуется 73 г. Следовательно, расчет ведем по соляной кислоте:

ЗАДАЧА 1. На 36 г алюминия подействовали 64 г серы. Найдите массу образовавшегося сульфида алюминия.
Решение
Примем массу Al за х1 и найдем, какое из веществ, вступивших в реакцию, дано в избытке, какое – в недостатке.
В данном случае вещества, вступившие в реакцию, взяты в стехиометрических количествах, поэтому расчет можно вести по любому из них:
ЗАДАЧА 2. На раствор, содержащий 53 г карбоната натрия, подействовали раствором, содержащим 49 г серной кислоты. Найдите массу образовавшейся соли.
Решение
Рассчитаем относительные молекулярные массы интересующих нас веществ:
Примем за х1 массу cерной кислоты, чтобы узнать, какое вещество дано в избытке, какое – в недостатке.
В данном случае оба вещества взяты в стехиометрических количествах, поэтому расчет можно вести по любому из них:
Однако учитель, подбирая задачи для решения в классе, должен помнить, что в некоторых случаях (например, если кислота или кислотный оксид дан в избытке) решение задачи не ограничивается расчетом двух пропорций, т. к. реакция будет протекать дальше с образованием кислой соли. Это повысит сложность материала. На первых уроках при решении задач данного типа я не включаю в материал задачи на прохождение реакций с образованием кислых или основных солей.
Видео:Задачи на "избыток" и "недостаток". 1 часть. 10 класс.Скачать

Домашнее задание
ЗАДАЧА 1. На 200 г 10%-го раствора серной кислоты подействовали 40 г оксида алюминия. Найдите массу образовавшейся воды.
M(р-р H2SO4) = 200 г, 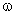
m(Al2O3) = 40 г.
Решение
Рассчитаем относительные молекулярные массы интересующих нас веществ:
Найдем, какое из вступивших в реакцию веществ дано в избытке, а какое – в недостатке.
Из расчета видно, что Al2O3 дан в избытке, следовательно, расчет ведем по кислоте:
ЗАДАЧА 2. На 40 г оксида меди(II) подействовали раствором серной кислоты, содержащим 49 г безводного вещества. Найдите массу образовавшейся соли.
Решение
Найдем, какое из веществ, вступивших в реакцию, дано в избытке, а какое – в недостатке.
Cогласно уравнению данной реакции вещества взяты в стехиометрических количествах, поэтому расчет можно вести по любому из них:
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Химия ПростоСкачать

Химия, Биология, подготовка к ГИА и ЕГЭ
Задачи такого типа (точнее, это может быть даже не самой задачей, а частью задачи) есть в части С ГИА, они входят в часть С ЕГЭ, теперь они появились и в части B.
Классический пример задачи на избыток и недостаток.
Этапы решения задачи:
1. Записываем уравнение реакции и уравниваем его:
2. Находим количество моль тех веществ, массы которых нам даны в условии:
n(Cu) = mAr =3.2 г 63.5 гмоль = 0,05 моль
m(Hg(NO3)2) = mMr = 20 324 = 0,06 моль
3. Сравниваем количество моль веществ и определяем недостаток:
0,05 моль 0,06 моль
по уравнению реакции меди и нитрат ртути реагируют 1:1, значит, их количество моль тоже должно быть одинаковым
0,05 моль ПО НЕДОСТАТКУ
Почему по недостатку? Это аналогично вопросу — «сколько целых яблок можно сложить из 5 половинок? «
4. Вычисляем массу продукта по количеству моль, соответствующему недостатку:
0,05 моль ——> 0,05 моль
m(Hg)= n*Ar = 0,05 моль * 200 гмоль = 10 г
______________________________________________________________________________________
Пример задачи на избыток и недостаток,
где вещества в другом соотношении:
те же самые этапы решения:
1. Записываем уравнение реакции и уравниваем его:
2. Находим количество моль тех веществ, массы которых нам даны в условии:
n(N2 ) = mMr = 1428=0.5 моль
3. Сравниваем количество моль веществ и определяем недостаток:
0.5 моль 0.5 моль
в этом уравнении все не так очевидно, как в предыдущем, поэтому нужно просто прикинуть:
- если считать по азоту (0.5 моль), то по соотношению коэффициентов (2:5) кислорода должно быть в 2.5 раза больше, т.е. (0.5*2.5) 1,25 моль, а у нас только 0.5, значит, O2 в недостатке;
- если бы количество моль азота оказалось бы меньше, значит, считали бы по азоту
4. Вычисляем массу продукта по количеству моль, соответствующему недостатку:
m(N2O5) = n*Mr = 2* 0.55 моль * 108 гмоль = 21 г
______________________________________________________________________________________
Есть задачи, очень похожие на задачи избыток-недостаток,
1. Записываем уравнение реакции и уравниваем его:
здесь у нас возможно 2 варианта — образование средней и кислой соли:
2. Находим количество моль тех веществ, массы которых нам даны в условии:
n(CO2 ) = V22.4 лмоль = 24.9 22.4 = 1,11 моль
n(NaOH)= mMr = 44.440 = 1,11 моль
т.к. количество моль веществ одинаково, то делаем вывод, что реакция протекает по схеме образования кислой соли:
4. Вычисляем массу продукта по количеству моль:
m ( NaHCO3) = n*Mr = 1,11 * 84 = 93,24 г
_____________________________________________________________________________________ _
Задачи на избыток и недостаток не трудные, зачастую они являются частью более сложных задач, поэтому все, что нужно сделать, это натренироваться — порешать как можно больше таких примеров, внимательно уравнивая и работая с коэффициентами.
Видео:КАК РЕШАТЬ ЕГЭ ПО ХИМИИ? — Задачи на избыток и недостаток #shorts #youtubeshortsСкачать

4.3.5. Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси).
Очень часто при проведении реакции между веществами оказывается, что один реагент прореагировал полностью, а другой нет. В таком случае говорят, что вещество, которое полностью израсходовалось, было в недостатке, а то вещество, которое осталось – в избытке. Поскольку избыток реагента не участвует в реакции, количество продукта зависит только от количества вещества, которое было в недостатке.
Предположим, что осуществляется реакция между веществами А и B, которая протекает в соответствии с уравнением:
Для осуществления этой реакции было взято количество вещества A, равное nA, и количество вещества B, равное nB. Определить то, какое вещество в избытке, а какое в недостатке, можно, сравнив выражения:
В зависимости от того, какое выражение окажется меньше, то вещество соответственно и будет в недостатке.
Примечание: распространенной ошибкой является то, что вместо выражений (1) сравнивают просто количества веществ. Так делать категорически не допускается! Если n(A) > n(B), то это еще не значит, что вещество A в избытке!
После того, как будет установлено то, какое вещество было в недостатке, расчеты ведутся по его количеству аналогично рассмотренным в главе 4.3.3.
Пример задачи на избыток и недостаток
Нагрели смесь 54 г алюминия и 80 г серы. Вычислите массу образовавшегося сульфида алюминия.
Решение
Запишем уравнение реакции:
Рассчитаем количества веществ алюминия и серы:
n(Al) = m(Al)/M(Al) = 54/27 = 2 моль;
n(S) = m(S)/M(S) = 80/32 = 2,5 моль
Для того чтобы выяснить, какое из исходных веществ в недостатке, разделим количества молей веществ на коэффициенты перед этими веществами в уравнении и сравним рассчитанные выражения:
и n(S)/k(S) = 2,5/3 ≈ 0,833
Значит сера в недостатке. Расчеты далее ведем по количеству вещества серы.
Исходя из уравнения реакции
следует, что количество прореагировавшей серы и образовавшегося в результате реакции сульфида алюминия связаны выражением:
где 3 и 1 – коэффициенты перед S и Al2S3 соответственно. Отсюда:
Следовательно, масса сульфида алюминия будет равна:
В случае, если в задаче дается масса реагента, содержащего примеси (mр-та с прим.), прежде всего следует рассчитать массу чистого реагента без примесей (mр-та ). Если дается масса реагента с примесями и указана массовая доля этого реагента ωр-та , то масса чистого реагента рассчитывается по формуле:
В случае, если вместо массовой доли чистого вещества дается массовая доля примесей, то учитывая, что:
мы можем записать, что:
Пример задачи на расчет количества продукта, зная массу реагента с примесями
Какой объем углекислого газа (н.у.) выделится при действии избытка соляной кислоты на технический карбонат кальция массой 150 г, содержащий 10% некарбонатных примесей.
Решение:
Запишем уравнение взаимодействия карбоната кальция с соляной кислотой:
Массовая доля примесей в техническом карбонате кальция составляет 10%, значит массовая доля чистого карбоната кальция будет составлять:
ω(CaCO3) = 100% — ω(прим.) = 100% — 10% = 90%.
Масса чистого карбоната кальция будет равна:
m(CaCO3) = ω(CaCO3) ∙ m(CaCO3 техн.)/100% = 90% ∙ 150 г/100% = 135 г,
Следовательно, количество вещества карбоната кальция равно:
n(CaCO3) = m(CaCO3)/M(CaCO3) = 135 г / 100 г/моль = 1,35 моль
В соответствии с уравнением реакции:
Количества веществ карбоната кальция и углекислого газа равны (одинаковые коэффициенты в уравнении), следовательно:
Тогда, зная, что один моль любого газа при нормальных условиях занимает объем 22,4 л, мы можем рассчитать объем выделившегося CO2:
V(CO2) = n(CO2) ∙ Vm = 1,35 моль ∙ 22,4 л/моль = 30,24 л
🌟 Видео
Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 1 ч. 9 класс.Скачать

6.Задачи на избыток и недостаток. Подготовка к олипиадам по химии 8-9 классСкачать

Задача на избыток и недостаток №1Скачать

ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Количество вещества, расчеты по реакциям, избыток и недостаток | ЕГЭ по химии 2022Скачать

Новые задачи №28 на выход реакции. ЕГЭ по химии 2023 | Екатерина СтрогановаСкачать

Задачи на ТЕПЛОВОЙ ЭФФЕКТ | Термохимические уравненияСкачать

Стехиометрия и "избыток - недостаток"Скачать

Задачи на "избыток" и "недостаток". 2 часть. 10 класс.Скачать

Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 2 ч. 9 класс.Скачать

Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 3 ч. 9 класс.Скачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Химия. Объяснение темы "Задачи на избыток и недостаток"Скачать

Задачи по химии на избыток и недостатокСкачать

Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать