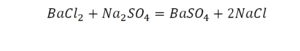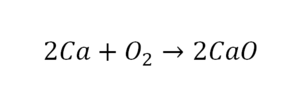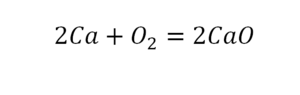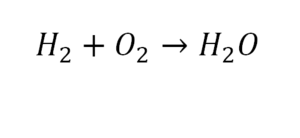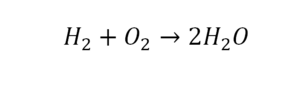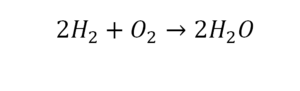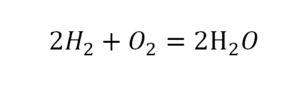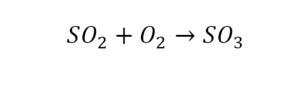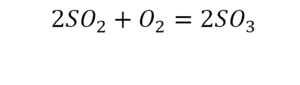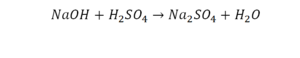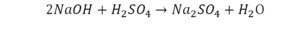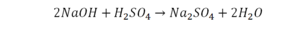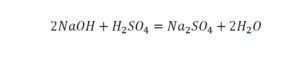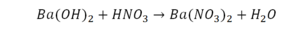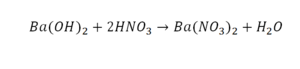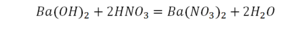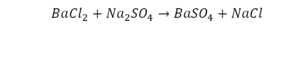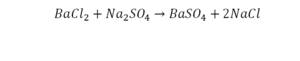По коэффициенту можно узнать, сколько всего молекул или атомов принимают участие в реакции. Индекс показывает, сколько атомов входит в молекулу. Уравнением реакции называется запись химического процесса с помощью химических формул и математических знаков.
В такой науке, как химия, такая запись называется схемой реакции. Если возникает знак «=», то называется «уравнение». Давайте расставлять коэффициенты. В Са одна частица, так как коэффициент не стоит. Индекс здесь тоже не написан, значит, единица. Справа уравнения Са тоже один. По Са нам не надо работать. Смотрим следующий элемент. Это кислород.
Индекс говорит о том, что здесь две частицы кислорода, а справа без индексов. То есть слева 2 молекулы, а с правой одна молекула. Что делаем? Никаких дополнительных индексов или исправлений в химическую формулу вносить нельзя, так как она написана правильно.
- Коэффициенты
- Реакция нейтрализации
- Видео
- Как расставлять коэффициенты в химических уравнениях
- Пример разбора простых реакций
- Пример разбора сложной реакции
- Видео
- Как определить индекс в химических уравнениях
- Химическая формула — это условная запись состава вещества посредством химических знаков и индексов.
- Формульная единица
- Видео
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Коэффициенты
Коэффициенты – это то, что написано перед молекулами. Они уже имеют право меняться. Для удобства саму формулу не переписываем. Справа 1 умножаем на 2, чтобы получить и там 2 частицы кислорода.
После того как мы поставили коэффициент, получилось две частицы кальция. Слева же только одна. Значит, теперь перед кальцием мы должны поставить 2.
Теперь проверяем итог. Если количество молекул элементов равно с обеих сторон, то можем поставить знак «равно».
Следующий пример.
2 водорода слева, и после стрелочки у нас тоже 2 водорода. Смотрим дальше. Два кислорода до стрелочки, а после стрелочки индексов нет, значит, 1 атом. Слева больше, а справа меньше. Выходим из положения и ставим коэффициент 2 перед водой.
Умножили всю формулу на 2, и теперь у нас изменилось количество водорода. Умножаем индекс на коэффициент, и получается 4. А с левой стороны осталось две частицы водорода. Вот чтобы получить 4, мы должны водород умножить на 2.
Проверяем. Если везде одинаково, то ставим «равно».
Последний пример в элементарных реакциях.
Вот как раз случай, когда элемент в одной и в другой формуле с одной стороны до стрелочки. 1 атом серы слева и один — справа. Два атома кислорода да еще плюс два кислорода.
- с левой стороны 4 кислорода;
- с правой же стороны находится 3 кислорода;
То есть с одной стороны получается четное число атомов, а с другой — нечетное. Если же мы умножим нечетное в два раза, то получим четное число. Доводим сначала до четного значения. То есть сначала умножаем на 2 всю формулу после стрелочки. После умножения получаем 6 атомов кислорода, да еще и два атома серы. С левой же стороны имеем 1 атом серы. Уравниваем теперь серу. Ставим с левой стороны уравнения перед серой 2.
Видео:Как расставлять индексы в соединенияхСкачать

Реакция нейтрализации
Второй пример более сложный, так как здесь больше элементов вещества.
Эта реакция называется реакцией нейтрализации. Что здесь надо уравнивать в первую очередь?
- с левой стороны 1 атом натрия;
- с правой же стороны индекс говорит о том, что здесь два атома натрия;
Напрашивается вывод, что надо умножить всю формулу на два.
Теперь дальше смотрим, сколько есть серы. С левой и правой стороны по 1 атому серы. Дальше смотрим на кислород. С левой стороны мы имеем 6 атомов кислорода. С другой стороны – 5. Меньше справа, больше слева. Нечетное количество надо довести до четного значения. Для этого формулу воды умножаем на 2, то есть из одного атома кислорода делаем два.
Теперь с правой стороны уже 6 атомов кислорода. С левой стороны тоже 6. Кислород уравнен. Проверяем водород. Два водорода и еще два водорода будет 4 водорода с левой стороны. Смотрим с другой стороны. Здесь также 4 водорода. Все элементы уравнены. Ставим знак «равно».
Следующий пример:
Он интересен тем, что появились скобки. Скобки говорят о том, что если множитель стоит за скобкой, то каждый элемент, стоящий в скобках, умножается на этот множитель. Здесь надо начать с азота, так как его меньше, чем кислорода и водорода. Слева азот 1, а справа, с учетом скобок, его два.
Справа же 2 атома водорода, а нужно 4. Мы просто выходим из положения и умножаем воду на 2, в результате чего получили 4 водорода. Отлично, водород уравняли. Если все элементы не уравнены, нельзя сказать что-то однозначно. Остался не уравненным кислород. До реакции присутствует 8 атомов кислорода, после – тоже 8.
Отлично, все элементы уравнены, можем ставить «равно».
Смотрим барий. Барий уравнен, его трогать не нужно. До реакции присутствуют два хлора, после — всего 1. Что же нужно сделать? Поставить 2 перед хлором после реакции.
Теперь за счет коэффициента, который только что поставили, после реакции два натрия, до реакции его тоже 2. Отлично, все остальное уравнено.
Видео:Как расставить индексы в формулеСкачать

Видео
Из этого видео вы узнаете, как правильно расставлять коэффициенты в химических уравнениях.
Видео:Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать

Как расставлять коэффициенты в химических уравнениях
Содержание:
Все химические реакции, проходящие в окружающем мире можно описать при помощи специальных уравнений, представляющих собой химические формулы и математические знаки с коэффициентами. И от правильно расставленных коэффициентов в химических уравнениях порой зависит не много не мало, а то какой собственно и будет химическая реакция и будет ли она вообще. В нашей статье мы расскажем о том, как правильно расставлять коэффициенты в химии, чтобы химические уравнения были записаны верно.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Пример разбора простых реакций
Главное правило, которым следует руководствоваться при составлении химических уравнений – принцип сохранения энергии вещества, то есть, сколько есть атомов каждого химического элемента в левой части уравнения, столько должно быть и в правой части того же уравнения.
Для примера возьмем химическую реакцию взаимодействия кальция (Ca) с кислородом (O2). Но для начала объясним, почему вообще кислород (как и некоторые другие химических элементы) в химических уравнениях записывается с индексом «2». Дело в том, что одна молекула кислорода имеет 2 атома, поэтому его записывают как O2. В свою очередь, к примеру, одна молекула воды, состоящая из кислорода и водорода, имеет всем известную формулу H2O. Это означает, что каждая молекула воды состоит из двух атомов водорода и одного атома кислорода. Заметьте, что по своему усмотрению индексы в химических уравнениях и формулах менять нельзя, так как они изначально должны быть написаны правильно.
Теперь вернемся к нашему простому примеру реакции взаимодействия кальция и кислорода. Ее можно записать следующим образом:
О чем говорит эта запись? О том, что в результате химической реакции взаимодействия кальция с кислородом образуется оксид кальция, который записан формулой CaO. Но также обратите внимание, что в правой части оксид кальция мы записали с коэффициентом 2 – 2CaO. Это значит, что каждый из двух атомов кислорода сцепился со своим атомом кальция, но тогда происходит несоответствие – в правой стороне у нас два атома кальция, в то время как в левой только лишь один. А значит, чтобы запись была правильной в левой части мы должны перед кальцием поставить коэффициент 2:
Теперь мы можем проверить наше уравнение – с левой стороны у нас два атома кальция и с правой тоже два, а значит между обеими частями можно вполне справедливо поставить знак равенства:
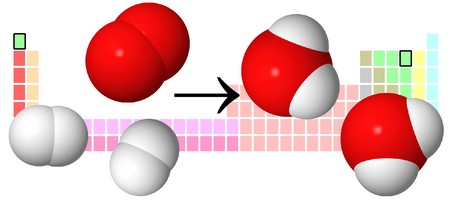
Разберем еще один простой пример, из взаимодействия кислорода и водорода как мы знаем, рождается одно из самых ценным и необычных веществ во Вселенной (и это без преувеличения) – вода, основа жизни на нашей планете. Образование воды можно записать следующим уравнением:
Но где же здесь закралась ошибка? Давайте разберем: в левой части у нас два атома кислорода, а в правой только один. Значит перед формулой воды необходимо поставить коэффициент 2:
Умножение 2 молекул воды на 2 атома водорода даст нам 4 атома водорода с правой стороны, но ведь с левой стороны атомов водорода лишь два! Значить перед водородом в уравнении мы также должны поставить коэффициент 2 и теперь получим правильное химическое уравнение, где вместо стрелочки → можно уже смело поставить знак равенства.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Пример разбора сложной реакции
Теперь давайте разберем то, как проставлять коэффициенты в более сложных химических уравнениях:
Перед вами запись так званой реакции нейтрализации – взаимодействие кислоты и основания, в результате которого образуются соли и вода.
Что же мы имеем тут: с левой стороны у нас один атом натрия (Na), а с правой индекс говорит, что атомов натрия уже стало два. Значит логично, что химическую формулу основания гидроксида натрия NaOH надо умножить на 2. Или другими словами поставить перед ней коэффициент 2:
Количество серы в серной кислоте (H2SO4) и соли сульфате натрия (Na2SO4) у нас одинаковое, тут все хорошо, а вот с количеством кислорода и водорода опять несоответствие, с левой стороны кислорода 6, а с правой 5. Водорода с правой стороны 4, а с левой только 2, непорядок. Чтобы правильно записать это химическое уравнение надо сравнять количество кислорода и водорода в левой и правой части уравнения, к счастью тут сделать это просто, надо перед H2O поставить коэффициент 2.
Таким образом, количество всех химических элементов в правой и левой части уравнения у нас сравнялись, а значит, мы неспроста поставили знак равенства.
Для закрепления материала разберем еще один пример сложного уравнения.
Это уравнение отображает химическую реакцию гидроксида бария (Ba(OH)2) с азотной кислотой (HNO3) в результате которой образуется нитрат бария (Ba(NO3)2) и вода.
Пример этот нам интересен тем, что тут используются скобки. Они означают, что если множитель стоит за скобками, то каждый элемент умножается на него. Начнем же разбирать это уравнение, первое, что бросается в глаза, несоответствие азота N, слева он один, а вот справа, если принимать во внимание скобки, его уже два. Получим следующее:
Теперь у нас слева стало 4 атома водорода, а справа только 2. Значит, перед формулой воды также ставим коэффициент 2.
Теперь все элементы уравнены, и мы справедливо поставили знак равенства.
Видео:ВАЛЕНТНОСТЬ 8 КЛАСС ХИМИЯ // Урок Химии 8 класс: Валентность Химических ЭлементовСкачать

Видео
И чтобы окончательно закрепить материал, рекомендуем посмотреть это образовательное видео.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Как определить индекс в химических уравнениях
Ключевые слова конспекта: химическая формула, индекс, коэффициент, качественный и количественный состав, формульная единица.
Химическая формула — это условная запись состава вещества посредством химических знаков и индексов.

Если требуется обозначить не одну, а несколько молекул (или отдельных атомов), то перед химической формулой (или знаком) ставят соответствующую цифру, которую называют коэффициентом. Например, три молекулы воды обозначаются 3Н2О, пять атомов железа — 5Fe. Индекс 1 в химических формулах и коэффициент 1 перед химическими символами и формулами не пишут.
Представленные на рисунке формулы читаются так: три-купрум-хлор-два, пять-алюминий-два-о-три, три-феррум-хлор-три .
Запись 5Н2О (пять-аш-два-о) следует понимать так: пять молекул воды образованы десятью атомами водорода и пятью атомами кислорода.
| ЗАДАНИЕ. Обозначить, используя символы химических элементов а) три молекулы азота б) семь молекул сульфида железа в) четыре атома серы г) два атома кальция д) семь молекул воды е) четыре молекулы кислорода ж) две молекулы сернистой кислотыОТВЕТ: а) три молекулы азота — 3N2 б) семь молекул сульфида железа — 7FeS в) четыре атома серы — S4 г) два атома кальция — Ca2 д) семь молекул воды — 7H2O е) четыре молекулы кислорода — 4O2 ж) две молекулы сернистой кислоты — 2H2SO3Объяснение: коэффициенты показывают количество молекул, индексы — количество атомов. Формулы молекул простых веществ нужно запомнить. Одноатомные молекулы образуют инертные газы гелий He, неон Ne, аргон Ar и другие. Из двухатомных молекул состоят водород H2, кислород O2, азот N2, галогены F2, Cl2, Br2, I2. Три атома — в молекулах озона O3, четыре — в молекулах белого фосфора P4. |
По химической формуле мы можем дать веществу название, определить его качественный и количественный состав, а также подсчитать его относительную молекулярную массу.Химическая формула показывает, из атомов каких элементов состоит вещество (то есть качественный состав вещества); и каково соотношение атомов этих элементов (то есть количественный состав вещества).
Формульная единица
Химические формулы веществ, имеющих немолекулярное строение, например FeS, не описывают состав молекулы; а только показывают соотношение элементов, образующих данное вещество.
Так, кристаллическая решётка поваренной соли — хлорида натрия состоит не из молекул, а из ионов. На каждый положительно заряженный ион натрия в ней приходится один отрицательно заряженный ион хлора. Получается, что отношение индексов в записи NaCl совпадает с отношением; в котором химические элементы соединяются между собой, образуя вещество. По отношению к веществам, имеющим немолекулярное строение, такую запись правильнее называть не формула, а формульная единица.
В таком случае величина Мr должна называться не относительной молекулярной массой, а относительной формульной массой. Тем не менее по традиции выражение «относительная молекулярная масса» используют и по отношению к веществам немолекулярного строения.
Конспект урока «Химическая формула. Индекс и коэффициент. Формульная единица«.
💡 Видео
ИНДЕКСЫ ЗА 5 МИНУТ. Как записать молекулярное уравнение? Химия 8 класс.Скачать

ВАЛЕНТНОСТЬ. Графические формулы веществ | Химия | TutorOnlineСкачать

8 класс. Химия. Как расставить коэффициенты в уравнении?Скачать

Валентность. Учимся определять валентность элементов по формуламСкачать

Химия Как расставлять индексы в соединениях / химических формулах / веществахСкачать

Индексы в соединениях откуда берутся?Скачать

Химические элементы | Индексы и коэффициентыСкачать

Индексы и коэффициенты в химических формулахСкачать

Коэффициенты и индексы, как понять?Скачать

Химические уравнения 8 класс - как расставить коэффициенты ?Скачать

Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать

Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать