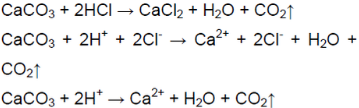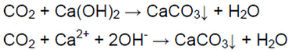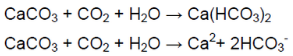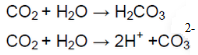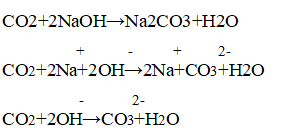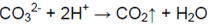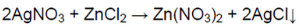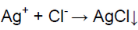- Ваш ответ
- решение вопроса
- Похожие вопросы
- Практическая работа №9. Решение экспериментальных задач.
- Вопросы к параграфу 36 — ГДЗ по Химии 9 класс Учебник Рудзитис, Фельдман
- § 36. Практическая работа №6.
- Получение оксида углерода (IV). Распознавание карбонатов
- 1. Получение оксида углерода(IV) и изучение его свойств. 1) Поместите в пробирку несколько кусочков мела или мрамора и прилейте немного разбавленной соляной кислоты. Пробирку быстро закройте пробкой с газоотводной трубкой. Конец трубки поместите в другую пробирку, в которой находится 2—3 мл известковой воды. Несколько минут пропускайте выделяющийся газ через известковую воду. Что происходит, если на мел (мрамор) действуют соляной кислотой? Почему при пропускании образующегося газа через раствор известковой воды сначала происходит помутнение, а затем взвесь растворяется? 2) Конец газоотводной трубки выньте из раствора и сполосните в дистиллированной воде. Поместите трубку в пробирку с 2—3 мл дистиллированной воды и пропустите через нес выделяющийся газ. Через несколько минут выньте трубку из раствора и добавьте к нему несколько капель синего лакмуса. Что наблюдаете? 3) В пробирку налейте 2—3 мл разбавленного раствора гидроксида натрия, добавьте к нему несколько капель фенолфталеина и затем через раствор пропустите выделяющийся газ. Что наблюдаете? Напишите уравнения всех проведённых реакций в молекулярном, ионном и сокращённом ионном виде.
- 2. Распознавание карбонатов. В трех пробирках даны кристаллические вещества: сульфат натрия, хлорид цинка, карбонат калия. Определите, какое вещество находится в каждой пробирке. Сделайте вывод, что является качественной реакцией на карбонат-ионы. Напишите соответствующее уравнение реакции.
- 📽️ Видео
Видео:Zn + 2HCl → ZnCl2 + H2 | Реакция цинка и соляной кислотыСкачать

Ваш ответ
Видео:получение хлорида цинка /Скачать

решение вопроса
Видео:Опыты по химии. Растворение цинка в кислотах и щелочахСкачать

Похожие вопросы
- Все категории
- экономические 43,299
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,247
- разное 16,834
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Видео:Лабораторная работа №5. КомплексообразованиеСкачать

Практическая работа №9. Решение экспериментальных задач.
Налейте в пробирку 1-2 мл концентрированного раствора серной кислоты и опустите в неё гранулу цинка. Составьте уравнение реакции в молекулярном и ионном видах, покажите переход электронов. Что в этой реакции является окислителем?
В шести пробирках находятся растворы хлорида магния. В каждую из пробирок последовательно прилейте следующие растворы: а) гидроксид натрия; б) сульфат калия; в) карбонат натрия; г) нитрат цинка; д) фосфат калия; е) сульфид натрия.
Составьте уравнения реакций, протекающих до конца, в молекулярном и ионном видах.
Даны растворы: а) карбоната калия и соляной кислоты; б) сульфида натрия и серной кислоты; в) хлорида цинка и азотной кислоты; г) сульфита натрия и серной кислоты; д) сульфата меди (II) и азотной кислоты.
Слейте попарно эти растворы, немного нагрейте и осторожно определите по запаху, в каких случаях реакции протекают до конца и почему. Составьте уравнения со ответствующих реакций в молекулярном и ионном видах.
Осуществите реакции, схемы которых:
а) Ba 2+ + CO3 2- ⟶ BaCO3↓;
б) 2H + + CO3 2- ⟶ CO2↑ + H2O;
в) H + + OH — ⟶ H2O;
г) Fe 0 ⟶ Fe 2+ ;
д) CuO ⟶ Cu 2+ ;
е) Pb 2+ + S 2- ⟶ PbS↓.
Проделайте реакции между следующими веществами:
а) сероводородной и хлорной водой;
б) раствором иодида калия и хлорной водой;
в) соляной кислотой и алюминием;
г) концентрированной серной кислотой и медью (при нагревании).
Составьте уравнения реакций, покажите переход электронов. Что является окислителем и что – восстановителем?
Пользуясь растворами и веществами, находящимися на столе, получите:
а) гидроксид железа (III);
б) сульфид меди (II);
в) оксид серы (IV);
г) карбонат магния;
д) свинец.
Составьте молекулярные и ионные уравнения соответствующих реакций.
| Zn + H2SO4 ⟶ ZnSO4 + H2↑ Zn + 2H + + SO4 2- ⟶ Zn 2+ + SO4 2- + H2↑ Zn + 2H + ⟶ Zn 2+ + H2↑ | ||
| 2H + + 2ē ⟶ H2 0 | 1 | окислитель (восстановление) |
| Zn 0 — 2ē ⟶ Zn +2 | 1 | восстановитель (окисление) |
MgCl2 + 2NaOH ⟶ 2NaCl + Mg(OH)2↓
Mg 2+ + 2Cl — + 2Na + + 2OH — ⟶ 2Na + + 2Cl — + Mg(OH)2↓
Mg 2+ + 2OH — ⟶ Mg(OH)2↓
MgCl2 + K2SO4 ⇸ реакция не идет, т. к. не образуется осадок или газ.
MgCl2 + Zn(NO3)2 ⇸ реакция не идет, т. к. не образуется осадок или газ.
MgCl2 + Na2S ⟶ 2NaCl + MgS↓
Mg 2+ + 2Cl — + 2Na + + S 2- ⟶ 2Na + + 2Cl — + MgS↓
Mg 2+ + S 2- ⟶ MgS↓
K2CO3 + 2HCl ⟶ 2KCl + H2O + CO2↑
2K + + CO3 2- + 2H + + 2Cl — ⟶ 2K + + 2Cl — + H2O + CO2↑
2H + + CO3 2- ⟶ H2O + CO2↑
Реакция идет до конца, т. к. выделяется газ, не имеющий запаха.
Na2S + H2SO4 ⟶ Na2SO4 + H2S↑
2Na + + S 2- + 2H + + SO4 2- ⟶ 2Na + + SO4 2- + H2S↑
2H + + S 2- ⟶ H2S↑
Реакция идет до конца, т. к. выделяется газ, имеющий запах тухлых яиц.
ZnCl2 + HNO3 ⇸ реакция не идет, т. к. не образуется осадок или газ.
CuSO4 + 2HNO3 ⇸ реакция не идет, т. к. не образуется осадок или газ.
| а) H2S + Cl2 ⟶ S + 2HCl | ||
| Cl2 0 + 2ē ⟶ 2Cl — | 1 | окислитель (восстановление) |
| S -2 — 2ē ⟶ S 0 | 1 | восстановитель (окисление) |
| 2KI + Cl2 ⟶ 2KCl + I2 | ||
| Cl2 0 + 2ē ⟶ 2Cl — | 1 | окислитель (восстановление) |
| 2I — — 2ē ⟶ I2 0 | 1 | восстановитель (окисление) |
| 2Al + 6HCl ⟶ 2AlCl3 + 3H2↑ | ||
| 2H + + 2ē ⟶ H2 0 | 3 | окислитель (восстановление) |
| Al 0 — 3ē ⟶ Al +3 | 2 | восстановитель (окисление) |
| Cu + 2H2SO4(конц.) ⟶ CuSO4 + SO2↑ + 2H2O | ||
| S +6 + 2ē ⟶ S +4 | 1 | окислитель (восстановление) |
| Cu 0 — 2ē ⟶ Cu +2 | 1 | восстановитель (окисление) |
а) FeCl3 + 3NaOH ⟶ 3NaCl + Fe(OH)3↓
Fe 3+ + 3Cl — + 3Na + + 3OH — ⟶ 3Na + + 3Cl — + Fe(OH)3↓
Fe 3+ + 3OH — ⟶ Fe(OH)3↓
б) CuSO4 + Na2S ⟶ Na2SO4 + CuS↓
Cu 2+ + SO4 2- + 2Na + + S 2- ⟶ 2Na + + SO4 2- + CuS↓
Cu 2+ + S 2- ⟶ CuS↓
д) Zn + Pb(NO3)2 ⟶ Zn(NO3)2 + Pb↓
Zn 0 + Pb 2+ + 2NO3 — ⟶ Zn 2+ + 2NO3 — + Pb↓
Zn 0 + Pb 2+ ⟶ Zn 2+ + Pb↓
Видео:Кадмий - Cd. Реакция Хлорида Кадмия и Цинка. Реакция Zn и CdCl2.Скачать

Вопросы к параграфу 36 — ГДЗ по Химии 9 класс Учебник Рудзитис, Фельдман
Авторы: Рудзитис Г.Е., Фельдман Ф.Г.
Видео:Гидролиз солей. 9 класс.Скачать

§ 36. Практическая работа №6.
Получение оксида углерода (IV). Распознавание карбонатов
1. Получение оксида углерода(IV) и изучение его свойств. 1) Поместите в пробирку несколько кусочков мела или мрамора и прилейте немного разбавленной соляной кислоты. Пробирку быстро закройте пробкой с газоотводной трубкой. Конец трубки поместите в другую пробирку, в которой находится 2—3 мл известковой воды. Несколько минут пропускайте выделяющийся газ через известковую воду. Что происходит, если на мел (мрамор) действуют соляной кислотой? Почему при пропускании образующегося газа через раствор известковой воды сначала происходит помутнение, а затем взвесь растворяется? 2) Конец газоотводной трубки выньте из раствора и сполосните в дистиллированной воде. Поместите трубку в пробирку с 2—3 мл дистиллированной воды и пропустите через нес выделяющийся газ. Через несколько минут выньте трубку из раствора и добавьте к нему несколько капель синего лакмуса. Что наблюдаете? 3) В пробирку налейте 2—3 мл разбавленного раствора гидроксида натрия, добавьте к нему несколько капель фенолфталеина и затем через раствор пропустите выделяющийся газ. Что наблюдаете? Напишите уравнения всех проведённых реакций в молекулярном, ионном и сокращённом ионном виде.
Поместили в пробирку несколько кусочков мела и прилили немного разбавленной соляной кислоты. Пробирку быстро закрыли пробкой с газоотводной трубкой. Конец трубки поместили в другую пробирку, в которой находится 2—3 мл известковой воды.
В результате реакции соляной кислоты с мелом выделяется углекислый газ:
Когда пропускали газ через известковую воду, она сначала мутнеет — выпадает осадок — карбонат кальция:
В ситуации избытка газа взвесь растворяется (карбонат превращается в гидрокарбонат, растворимый в воде):
Углекислый газ можно получить путём воздействия сильной кислоты на карбонат. Для его распознавания применяется известковая вода (при недостатке карбоната она мутнеет, при его избытке осадок растворяется).
Конец газоотводной трубки вынули из раствора и сполоснули в дистиллированной воде. Поместили трубку в пробирку с 2—3 мл дистиллированной воды и пропустили через нес выделяющийся газ. Через несколько минут вынули трубку из раствора и добавили к нему несколько капель синего лакмуса.
Раствор лакмуса окрасился в красный цвет, что говорит об образовании кислотной среды, которую обеспечивает угольная кислота:
Угольная кислота образуется при растворении углекислого газа в воде. Угольная кислота диссоциирует на ионы водорода, окрашивающие лакмус в красный цвет.
В пробирку налили 2—3 мл разбавленного раствора гидроксида натрия, добавили к нему несколько капель фенолфталеина и затем через раствор пропустили выделяющийся газ.
Раствор фенолфталеина, который окрасился в малиновый цвет при взаимодействии с гидроксидом натрия, поменял цвет на бледно розовый (образовалась соль, состоящая из катионов сильной щелочи и анионов слабой кислоты).
Углекислый газ реагирует с щелочами, образуя соль, которая при гидролизе образует слабощелочную среду.
2. Распознавание карбонатов. В трех пробирках даны кристаллические вещества: сульфат натрия, хлорид цинка, карбонат калия. Определите, какое вещество находится в каждой пробирке. Сделайте вывод, что является качественной реакцией на карбонат-ионы. Напишите соответствующее уравнение реакции.
К трём растворам добавили соляную кислоту
В двух пробирках реакция не идёт
С соляной кислотой не взаимодействуют сульфат натрия и хлорид цинка, в этих пробирках находятся эти вещества.
Выделяется газ без цвета и запаха
В пробирке карбонат калия:
Качественная реакция на карбонат-ионы — взаимодействие с сильной кислотой с выделением газа без цвета и запаха.
Добавили к раствору нитрат серебра (I)
В одной пробирке выпадает осадок белого цвета.
В пробирке находится хлорид цинка.
Белый осадок означает, что соль
является хлоридом (ионы Ag
связываются с ионами Сl).
В пробирке, в которой не произошло изменений, находится сульфат натрия.
📽️ Видео
Получение осадка гидроксида цинка и растворение его в избытке щёлочиСкачать

Опыты по химии. Амфотерность гидроксида цинкаСкачать

Через раствор, содержащий 0,2 mol хлорида цинка и 0,15 mol хлорида меди (II), пропустили 0,3 FСкачать

гидроксид цинкаСкачать

ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

7 ПРОСТЫХ ХИМИЧЕСКИХ ОПЫТОВ!Скачать

Распознавание растворов хлорида натрия, карбоната натрия и сульфата натрияСкачать

Теперь скуплю всю стружку! Это ЗОЛОТО, а не мусор!Скачать

9 класс.ОГЭ.Задание 24.Хлорид меди (ll).Скачать

Взаимодействие цинка с серной кислотойСкачать

Опыты по химии. Взаимодействие муравьиной кислоты с цинкомСкачать

ЦИНК КАК ОПРЕДЕЛИТЬ? ДВА СПОСОБА!Скачать

Гидролиз солей. Классификация солей. Решение примеров.Скачать

Реакция оксида цинка с соляной кислотой. Химический опытСкачать