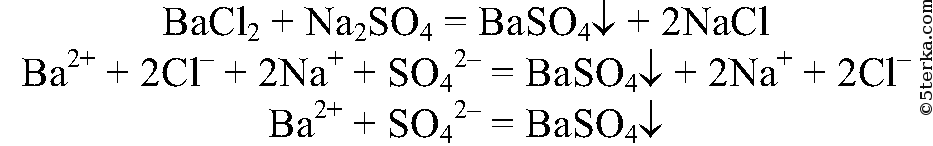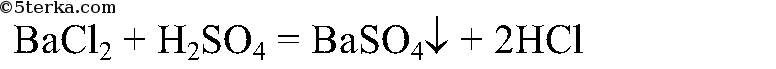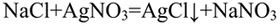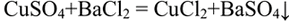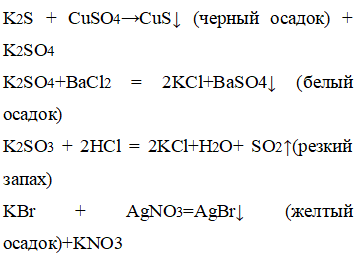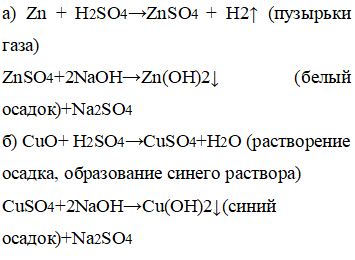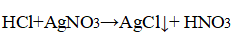Задание. Распознайте сульфат натрия с помощью качественной реакции.
Соблюдайте правила техники безопасности при работе с кислотами!
Оборудование. Штатив с пробирками.
Вещества. 5% -е растворы сульфата, хлорида и нитрата натрия, 10% -е растворы хлорида бария, серной, соляной и азотной кислот, порошок медного купороса, вода (в стакане).
1. В три пробирки налейте по 1 мл растворов сульфата натрия, хлорида натрия и нитрата натрия. В каждую из этих пробирок добавьте немного хлорида бария. Что вы наблюдаете?
Составьте полные и сокращенные ионные уравнения наблюдаемых реакций.
2. Докажите, что выданные вам голубые кристаллы содержат сульфат меди (II). Составьте уравнения реакций.
3. Налейте в три пробирки серную, азотную и соляную кислоты, добавьте в них раствор хлорида бария. Что вы наблюдаете? Напишите уравнения реакций.
Сделайте общий вывод, с помощью какого реактива можно распознать сульфат-ионы.
Наблюдается появление белого осадка в пробирке с сульфатом натрия. В других пробирках видимых изменений не наблюдается.
В пробирке с серной кислотой выпадет белый осадок. В других пробирках ничего не происходит.
Вывод: сульфат-ионы распознаются с помощью растворимых солей бария.
задача №5
к главе «Лабораторные работы и опыты».
- Please wait.
- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- Вопросы к параграфу 22 — ГДЗ по Химии 9 класс Учебник Рудзитис, Фельдман
- § 22. Практическая работа №4
- Решение экспериментальных задач по теме “Кислород и сера”
- 1. Даны пробирки с растворами: а) сульфата натрия; б) хлорида натрия; в) серной кислоты. Опытным путём определите, в какой пробирке находится каждое из указанных веществ.
- 2. Дан раствор сульфата меди (II). Получите из него раствор хлорида меди(II).
- 3. Даны четыре пронумерованные пробирки, в которых находятся следующие соли калия: сульфид, сульфат, сульфит, бромид. Определите при помощи характерных реакций каждое из данных веществ.
- 4. Проделайте опыты но осуществлению следующих превращений:
- а) цинк→сульфат цинка→гидроксид цинка
- б) оксид меди(II)→сульфат меди(II)→гидроксид меди(II)
- 5. Даны вещества: серная кислота, цинк, растворы нитрата стронция, хлорида натрия, хлорида кальция, хлорида меди(II). Проверьте опытным путём, с какими веществами реагирует серная кислота. Почему? Какие реакции относятся к окислительно-восстановительным? Ответ мотивируйте.
- 6. Проделайте реакции, подтверждающие качественный состав серной и соляной кислот.
- Сульфат натрия: способы получения и химические свойства
- Способ получения
- Качественная реакция
- Химические свойства
- 🎥 Видео
Видео:Запись уравнения диссоциации на примере сульфата натрия (компьютерная графика)Скачать

Please wait.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

We are checking your browser. gomolog.ru
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 705eeda5599b0111 • Your IP : 87.119.247.227 • Performance & security by Cloudflare
Видео:Электролиз. Часть 4. Расплав сульфата натрияСкачать

Вопросы к параграфу 22 — ГДЗ по Химии 9 класс Учебник Рудзитис, Фельдман
Авторы: Рудзитис Г.Е., Фельдман Ф.Г.
Видео:КАК ОПРЕДЕЛИТЬ ВЕЩЕСТВО В ПРОБИРКЕ? | КАЧЕСТВЕННЫЕ РЕАКЦИИ | Видеоурок по химии №6Скачать

§ 22. Практическая работа №4
Решение экспериментальных задач по теме “Кислород и сера”
1. Даны пробирки с растворами: а) сульфата натрия; б) хлорида натрия; в) серной кислоты. Опытным путём определите, в какой пробирке находится каждое из указанных веществ.
Поместили лакмус и нитрат серебра в три пробирки с растворами
В пробирке, где находилась серная кислота, лакмус окрасился в красный цвет. в пробирке. где находился хлорид натрия, после добавления нитрата серебра выпал белый осадок.
Серная кислота при взаимодействии с лакмусом окрашивает его в красный цвет (кислота закисляет среду, остальные две соли образованы сильными основаниями и сильными кислотами→не гидролизируются и дают нейтральную среду→лакмус не меняет цвет.)
Качественная реакция на хлориды — выпадение белого осадка хлорида серебра:
В пробирке. где лакмус не поменял цвет. находится сульфат натрия.
2. Дан раствор сульфата меди (II). Получите из него раствор хлорида меди(II).
Поместили к раствору сульфата меди раствор хлорида бария.
Сульфат бария выпадает в осадок.
Качественной реакцией а сульфаты является выпадение осадка сульфата бария. Одновременно таким способом можно получить и хлорид меди:
3. Даны четыре пронумерованные пробирки, в которых находятся следующие соли калия: сульфид, сульфат, сульфит, бромид. Определите при помощи характерных реакций каждое из данных веществ.
Добавили к сульфиду калия сульфат меди, к сульфату калия добавили хлорид бария, к сульфиту калия – соляную кислоту, к бромату калия – нитрат серебра.
В пробирке с сульфидом калия выпал черный осадок, с сульфатом калия – белый осадок, с бромидом калия – желтый осадок, с сульфитом калия – появился резкий запах.
С помощью качественных реакции можно определить каждый представленный анион:
4. Проделайте опыты но осуществлению следующих превращений:
а) цинк→сульфат цинка→гидроксид цинка
б) оксид меди(II)→сульфат меди(II)→гидроксид меди(II)
а) К цинку добавили серную кислоту, а далее гидроксид натрия.
б) К оксиду меди добавили серную кислоту, а далее гидроксид натрия.
а) Вследствие добавления кислоты образовались пузырьки газа, вследствие добавления щелочи образовался белый осадок.
б) Вследствие добавления кислоты образовался синий раствор, вследствие добавления щелочи образовался синий осадок.
5. Даны вещества: серная кислота, цинк, растворы нитрата стронция, хлорида натрия, хлорида кальция, хлорида меди(II). Проверьте опытным путём, с какими веществами реагирует серная кислота. Почему? Какие реакции относятся к окислительно-восстановительным? Ответ мотивируйте.
Добавили к цинку, нитрату стронция, хлориду натрия, хлориду кальция и хлориду меди серную кислоту.
При взаимодействии серной кислоты с цинком образовались пузырьки газа (окислитель-восстановительная реакция — цинк и водород изменяют свои степени окисления), с нитратом стронция — выпал белый осадок, с хлоридами натрия и меди — реакции нет.
Реакция с серной кислотой идёт с металлами, стоящими в электрохимическом ряду до водорода, с солями, если в результате реакции выпадает осадок и вытесняет летучие кислоты из солей.
6. Проделайте реакции, подтверждающие качественный состав серной и соляной кислот.
Добавили к соляной и серной кислоте лакмус; поместили к соляной кислоте нитрат серебра, к серной кислоте добавили хлорид бария.
Лакмус окрасился в красный цвет; после добавления реагентов выпали белые осадки. Тот факт, что лакмус окрасился в красный, говорит о том, что в составе веществ присутствует H+.
Появление осадка хлорида серебра говорит о наличии в составе соляной кислоты хлорид-аниона:
Появление осадка сульфата бария говорит о наличии в составе серной кислоты сульфат-аниона:
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Сульфат натрия: способы получения и химические свойства
Сульфат натрия — соль щелочного металла натрия и серной кислоты. Белый. Плавится и кипит без разложения. Хорошо растворяется в воде (гидролиз не идет).
Относительная молекулярная масса Mr = 142,04; относительная плотность для тв. и ж. состояния d = 2,66; tпл = 884º C; tкип = 1430º C.
Видео:ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Способ получения
1. В результате взаимодействия разбавленной серной кислоты и гидроксида натрия образуется сульфат натрия и вода:
2. При температуре 450–800º C гидросульфат натрия реагирует с хлоридом натрия. В результате реакции образуется сульфат натрия и хлороводородная кислота:
NaHSO4 + NaCl = Na2SO4 + HCl
3. В состоянии кипения в результате реакции между твердым хлоридом натрия и концентрированной серной кислотой происходит образование сульфата натрия и газа хлороводорода:
4. Твердый сульфид натрия и кислород взаимодействуют при температуре выше 400º C с образованием сульфата натрия:
5. При взаимодействии концентрированного раствора пероксида водорода и сульфида натрия образуется сульфат натрия и вода:
Видео:ХИМИЯ С НУЛЯ — Как решать задачи по Химии на Массовую ДолюСкачать

Качественная реакция
Качественная реакция на сульфат натрия — взаимодействие его с хлоридом бария, в результате реакции происходит образование белого осадка , который не растворим в азотной кислоте:
1. При взаимодействии с хлоридом бария , сульфат натрия образует сульфат бария и хлорид натрия:
Видео:Распознавание растворов хлорида бария, сульфата натрия и серной кислотыСкачать

Химические свойства
1. Сульфат натрия может реагировать с простыми веществами :
1.1. Сульфат натрия реагирует со фтором при температуре 100–150º C. При этом образуются фторид натрия, сульфурилфторид и кислород:
1.2. С водородом сульфат натрия реагирует при температуре 550–600º C, в присутствии катализатора Fe2O3 с образованием сульфида натрия и воды:
2. Сульфат натрия вступает в реакцию со многими сложными веществами :
2.1. Сульфат натрия реагирует с гидроксидом бария с образованием гидроксида натрия и сульфата бария:
2.2. При взаимодействии с концентрированной серной кислотой твердый сульфат натрия образует гидросульфат натрия:
2.3. Сульфат натрия реагирует с оксидом серы (VI) . Взаимодействие сульфата натрия с оксидом серы (VI) приводит к образованию пиросульфата натрия:
2.4. Сульфат натрия взаимодействует с хлоридом бария . При этом образуются хлорид натрия и сульфат бария:
🎥 Видео
Определение массовых долей элементов в соединениях. 8 класс.Скачать

8 класс. Массовая доля растворенного вещества. Решение задач.Скачать

9 класс. ОГЭ. Задание 23-24. ХЛОРИД БАРИЯ. часть 1.Скачать

Решение цепочек превращений по химииСкачать

Как ЛЕГКО понять Химию с нуля — Массовая доля вещества // ХимияСкачать

9 класс. ОГЭ. Химия. Часть 2 (задания 20, 21, 22, 23, 24),Скачать

Практическая часть ОГЭ 2020. Выполняем задания 23 и 24Скачать

хлорид бария + сульфат натрияСкачать

Сульфат натрияСкачать

Тесты по химии. Определение веществ в пробирках. В7 РТ 16-17 этап 1Скачать