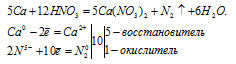Оксид железа (II, III)
Оксид железа (II, III) (железная окалина, магнетит) – это твердое, нерастворимое в воде вещество черного цвета.
Фото с сайта wikipedia.ru
Способы получения
Оксид железа (II, III) можно получить различными методами :
1. Горение железа на воздухе:
2. Частичное восстановление оксида железа (III) водородом или угарным газом :
3. При высокой температуре раскаленное железо реагирует с водой, образуя двойной оксид железа (II, III):
Химические свойства
Свойства оксида железа (II, III) определяются свойствами двух оксидов, из которых он состоит: основного оксида железа (II) и амфотерного оксида железа (III).
1. При взаимодействии оксида железа (II, III) с кислотными оксидами и кислотами образуются соли железа (II) и железа (III).
Например , оксид железа (II, III) взаимодействует с соляной кислотой. При это образуются две соли – хлорид железа (II) и хлорид железа (III):
Еще пример : оксид железа (II, III) взаимодействует с разбавленной серной кислотой.
2. Оксид железа (II, III) взаимодействует с сильными кислотами-окислителями (серной-концентрированной и азотной).
Например , железная окалина окисляется концентрированной азотной кислотой:
Разбавленной азотной кислотой окалина окисляется при нагревании:
Также оксид железа (II, III) окисляется концентрированной серной кислотой:
Также окалина окисляется кислородом воздуха :
3. Оксид железа (II, III) не взаимодействует с водой.
4. Оксид железа (II, III) окисляется сильными окислителями до соединений железа (VI), как и прочие оксиды железа (см. выше).
5. Железная окалина проявляет окислительные свойства .
Например , оксид железа (II, III) реагирует с угарным газом при нагревании. При этом возможно восстановление как до чистого железа, так и до оксида железа (II):
Также железная окалина восстанавливается водородом:
Оксид железа (II, III) реагирует с более активными металлами .
Например , с алюминием (алюмотермия):
Оксид железа (II, III) реагирует также с некоторыми другими сильными восстановителями (йодидами и сульфидами).
Например , с йодоводородом:
Видео:Железная окалина: двойной оксид, разбивающий все надежды на сотку? | Химия ЕГЭ 2022 | УмскулСкачать

Окислительно-восстановительные свойства металлов. Ряд напряжения металлов
Вопрос 1.
Уравнение реакции образования железной окалины имеет вид:
Fe3O4 — представляет собой смесь двух оксидов FeO и Fe2O3. Поэтому уравнение реакции (І) можно условно представить в виде двух уравнений и для каждого составить уравнение электронного баланса.
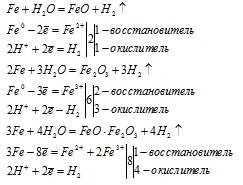
Таким образом, в реакции образования железной окалины три атома железа отдают не 6 и не 9, а 8 электронов.
Вопрос 2.
Вопрос 3.
Вопрос 4.
Щелочные и щелочноземельные металлы очень активны и реагируют практически со всем, с чем соприкасаются. Например, на воздухе эти металлы легко окисляются и, при этом разрушаются. Их хранят под слоем керосина, к которому они инертны, этим они сберегаются от ненужных взаимодействий. Литий — самый легкий из металлов. Он легче керосина и в отличие от других металлов всплывает в нем, поэтому его хранят в вазелине.
Вопрос 5.
Вопрос 6.
По правилу, которое гласит, что металлы, стоящие в ряду напряжения левее водорода, вытесняют его из растворов кислот, водород при реакции свинца с раствором серной кислоты должен получиться. Но данное правило соблюдается, если в реакции металла с кислотой образуется растворимая соль, а так как PbSO4 — нерастворимая соль то правило не соблюдается, и водород нельзя получить при взаимодействии свинца с раствором серной кислоты.
Вопрос 7. 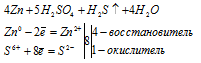
В данной реакции цинк проявляет восстановительные свойства, а сера – окислительные.
Видео:Железная окалина 👹 #химия #егэ2023 #соткаСкачать

Что такое железная окалина
Смесь оксидов железа, образовывающаяся при взаимодействии кислорода с раскалённым металлом, имеет обобщённое название — железная окалина. Она состоит из Fe3O4, FeO и Fe2O3 (магнетита, вьюстита и гематита соответственно) и представлена двумя легкоотделяемыми друг от друга слоями. При их суммарной толщине до 40 нм окалина невидима невооружённому взгляду, свыше 40 и до 500 нм — выдаёт себя цветами побежалости (радужным отливом). Постоянный же окрас появляется, если слой железной окалины на металле превышает 500 нм.
Видео:9 класс. Железо. Химические свойства. Ч1Скачать
Состав
Наружный слой оксида железа — гематит. Он обладает большой твёрдостью (1030 ед. по шкале Виккерса), абразивностью и очень плохо растворяется в кислотах. Под ним в условиях частичной нехватки кислорода формируется более мягкий и почти нерастворимый в кислотах магнетит. Ближе всего к металлу находится рыхлый и мягкий вьюстит, который легко поддается устранению механическим путём или кислотным травлением.
Толщина каждого из трёх слоёв зависит от температуры обработки стали. Так, при превышении порога в 570 °C образуется чётко выраженная трёхслойная структура окалины. Дальнейшее повышение температуры ведёт к увеличению толщины вьюстита. Если же сталь обрабатывается при температурах ниже 570 °C, то в составе окалины преобладают магнетит и гематит.
По цвету железной окалины можно определить температуру обработки стали. Так, при температуре в 700–750 °C в составе окалины больше гематита, из-за чего она приобретает рыжевато-красный оттенок. Образовавшийся при высокотемпературном (900–1000 °C) прокате слой оксидов из-за более высокого процента вьюстита становится чёрным.
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Особенности
Твёрдость окалины сочетается с её хрупкостью, из-за чего вкрапления оксида внутри структуры металла резко понижают его эксплуатационные характеристики. По этой же причине железная окалина не может быть использована в качестве защитного покрытия, хоть она и не взаимодействует с кислородом. Более того, в месте скола оксидов наблюдается усиленное окисление стали, что происходит из-за разности потенциалов окалины и стали. По этой причине её удаляют с готового проката.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Удаление окалины
Слой оксидов железа с прокатной стали удаляют со стальной заготовки несколькими способами.
- механическая;
- химическая;
- электрохимическая.
Возможно также сочетание вариантов.
Механическое воздействие на прокат сводится к пропуску проволоки или листа с окалиной через ряд роликов. При этом достигается частое изгибание заготовки, под воздействием которого железная окалина рассыпается на отдельные чешуйки и осыпается с металла. Для финишной очистки могут быть использованы абразивы, наждачные ленты, щётки из проволоки.
Достоинством этой технологии является сравнительная дешевизна и экологичность. Но поскольку отказ от смазки при такой обработке нецелесообразен, это приводит к замасливанию железной окалины, что затрудняет дальнейшую её переработку.
Химический и электрохимический способы очистки стали называют травлением. Для этих целей используются серная и соляная кислоты, реже — фосфорная, азотная, плавиковая или их смесь. Главными недостатками такого способа является одноразовое использование травильных растворов (не восстанавливаются) и низкий спрос на побочный продукт преобразования окалины — железный купорос. По этой причине травление применяется довольно редко, и ему обычно предшествует механическая очистка проката от окалины.
Видео:Задание 30 ОВР Железная окалина и азотная кислотаСкачать

Применение окалины
Опытными кузнецами давно было примечено повышение сопротивляемости металла коррозии при формировании на нём тонкого слоя окалины. Сейчас же воронение оружейной стали используется лишь в качестве декоративной отделки. Её цвет зависит от способа обработки (кислота, щёлочь, температура) и толщины оксидной плёнки, составляющей от 1 до 10 мкм.
Прокатная окалина, удельный вес которой достигает 3% от общего веса готовых изделий, является ценным сырьём для металлургического производства за счёт высокого содержания (до 75%) в ней железа. Основное направление её переработки — очистка от примесей и восстановление, после которого она превращается в низкоуглеродистую сталь.
Некоторые составы окалины успешно применяются в качестве красящих пигментов и активно используются в строительстве. Также из окалины производится железный порошок, применяемый в металлургии, при изготовлении самонагревающихся смесей и даже в пищевой промышленности.
Химический состав этого отхода металлургической промышленности стандартизирован. Её стоимость может колебаться в зависимости от преобладания определённых видов окислов и количества примесей. Усреднённая цена на начало 2019 года составляла 50 американских долларов за тонну железной окалины.
ОКА́ЛИНА, -ы, ж. Продукт окисления, образующийся на поверхности раскаленного металла при взаимодействии с воздухом. Горновщицы по очереди выхватывали щипцами из горнов заклепки, ударом по чугунному бруску сбивали с них окалину и шлак. Кочетов, Журбины.
Источник (печатная версия): Словарь русского языка: В 4-х т. / РАН, Ин-т лингвистич. исследований; Под ред. А. П. Евгеньевой. — 4-е изд., стер. — М.: Рус. яз.; Полиграфресурсы, 1999; (электронная версия): Фундаментальная электронная библиотека
- Окалина — это смесь оксидов, образующихся прямым действием кислорода при накаливании на воздухе металлов. Обычно термин применяется к оксидам не всех металлов, а только железа и меди.
Железная окалина представляет собой смесь оксидов Fe3O4, FeO и Fe2O3, и состоит из двух слоев, легко отделяемых друг от друга. Внутренний слой пористый, черно-серого цвета, наружный плотный и с красноватым оттенком, оба слоя хрупки и обладают ферромагнитными свойствами. Состав железной окалины непостоянен и зависит от условий получения: при продолжительном накаливании на воздухе она постепенно переходит в Fe2O3, а последняя в белокалильном жару теряет часть кислорода, переходя в FeO. Обычно железная окалина состоит из 64—73 % FeO и 36—27 % Fe2O3, наружный слой содержит больше Fe2O3 — от 32 до 37 %, а самый внешний слой даже до 53 %. На поверхности легированных сталей образуются сложные оксиды (NiO·Fe2O3, FeO·Cr2О3 и др.). При толщине до 40 нм слой окалины прозрачный, при толщине от 40 до 500 нм — окрашен в тот или иной цвет побежалости, при толщине свыше 500 нм окалина имеет постоянную окраску, зависящую от химического состава.
Медная окалина, представляющая собой хрупкую, черно-серого цвета массу, состоит из оксидов меди Cu2O (около 75 %) CuO (около 25 %). Так же как у железной окалины, состав её непостоянен и может колебаться в зависимости от температуры и избытка кислорода при получении. Во внутренних слоях преобладает Cu2O, в наружных — CuO. При красном калении и при достаточном количестве кислорода Cu2O окисляется до CuO, поэтому в этих условиях медная окалина будет состоять главным образом из CuO, а при температурах выше 1100 °С, вследствие разложения CuO на Cu2O и кислород, в медной окалине будет преобладать Cu2O.
ОКА’ЛИНА, ы, мн. нет, ж. (хим., тех.). Окисел, образующийся на поверхности раскаленного металла при ковке или прокатке. Железная о. Очистить железо от окалины.
Источник: «Толковый словарь русского языка» под редакцией Д. Н. Ушакова (1935-1940); (электронная версия): Фундаментальная электронная библиотека
Окалина – это продукт высокотемпературного окисления металла или газовой коррозии. На готовом стальном полуфабрикате обычно имеется окалина толщиной менее 20 мкм (чаще 7-15 мкм).
Различают первичную окалину, образующуюся при нагреве под деформацию, и вторичную окалину, появляющуюся в процессе деформации и последующего охлаждения. При прокатке окалина удаляется на окалиноломателях и гидросбивом.
Окалинообразование наиболее интенсивно развивается при температурax выше 900-1000 C, при прокатке оно приводит к потерям металла до 3-4 %.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Железная окалина формула
Наружный слой окалины обычно FeO (гематит), внутренний слой, прилегающий к металлу, – Fe2O3 (вюстит).
Рис. Железная окалина
На поверхности легированных сталей образуются сложные оксиды (NiO * Fe2O3, FeO * Cr2О3 и др.).
📹 Видео
Железная окалина в ЕГЭ и ОГЭ #химия #егэ #огэСкачать

Соединения железаСкачать

Галилео. Металлургия (часть 1)Скачать

Железо - Самый Полезный МЕТАЛЛ НА ЗЕМЛЕ!Скачать

ХИМИЯ С НУЛЯ — Как решать задачи по Химии на Массовую ДолюСкачать

Взаимодействие алюминия с оксидом железа (III)Скачать

ОКАЛИНА 😃Скачать

8 класс. Вычисления по химическим уравнениям. Часть 2.Скачать

Железо | ХимияСкачать

Габриелян О. С. 8 класс §32 "Реакции замещения".Скачать

ЖЕЛЕЗО и его соединения для ЕГЭ ПОЛНОСТЬЮ | Самые завальные реакции | ЕГЭ по химии 2023Скачать

Лекция железо для дистанционного урока 9 кл, 11 клСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать