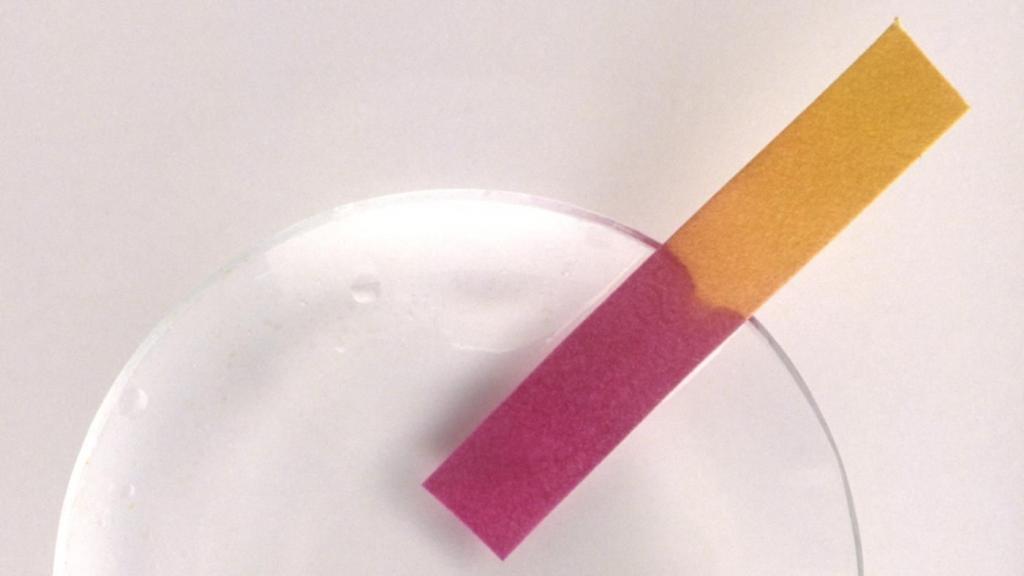Истинная, эмпирическая, или брутто-формула: C12H7NO3
Химический состав Лакмуса
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| C | Углерод | 12,011 | 12 | 67,6% |
| H | Водород | 1,008 | 7 | 3,3% |
| N | Азот | 14,007 | 1 | 6,6% |
| O | Кислород | 15,999 | 3 | 22,5% |
Молекулярная масса: 213,192
Лакмус (от нидерл. lekken жидкий, текучий и нидерл. moes — смесь, паста, каша) — красящее вещество природного происхождения, один из первых и наиболее широко известных кислотно-основных индикаторов. Наименование стандартного химического препарата «лакмусовая бумага» стало нарицательным в русском языке, как в химии для всех типов индикаторных бумаг, так и в повседневной жизни при описании знаковых явлений и событий.
В чистом виде представляет собой тёмный порошок со слабым запахом аммиака. Хорошо растворяется в чистой воде, образуя растворы фиолетового цвета. В кислых средах (pH менее 4,5) лакмус приобретает красную окраску, в щелочных (pH более 8,3) — синюю. У лакмуса, по сравнению с остальными индикаторами, сравнительно небольшая погрешность в определении среды вещества.
Фактически природный лакмус представляет собой сложную смесь 10—15 различных субстанций. Основными компонентами лакмуса считаются:
- азолитмин (англ. Azolitmin, сост. C9H10NO5) — может быть выделен из лакмуса экстракцией и использоваться как самостоятельный кислотно-щелочной индикатор;
- эритролитмин (англ. Erythrolitmin или Orcein Erythrolein, сост. C13H22O6);
Также экстракционным разделением из лакмуса могут быть выделены:
- спанолитмин (англ. Spaniolitmin);
- лейкоорцеин (англ. Leucoorcein);
- лейказолитмин (англ. Leucazolitmin).
Применяется как индикатор для определения реакции среды. На практике используется несколько препаративных форм лакмуса: водный раствор лакмуса, полоски и клочки ленты фильтровальной бумаги, пропитанные лакмусом — т. н. лакмусовая бумага, «лакмусовое молоко» (нем. Lackmusmilch).
Добывается из растительного сырья, в частности из некоторых лишайников: Roccella tinctoria (о-ва Кабо-Верде, Канарские о-ва, Мадейра, Азорские о-ва, западное побережье Южной Америки), Roccella fuciformis (Ангола и Мадагаскар), Roccella pygmaea (Алжир), Roccella phycopsis, Lecanora tartarea (Норвегия, Швеция), Variolaria dealbata (Пиренеи и Аверн), Ochrolechia parella (северо-запад Атлантического побережья Европы), Parmotrema tinctorum (Канарские острова), из различных видов рода Parmelia, Dendrographa leucophoea (США, Калифорния). Основными производителями лакмуса являются Мозамбик (из Roccella montagnei) и США (из Dendrographa leucophoea).
В течение длительного времени производство лакмуса было монополизировано и подробности методов его выделения были неизвестны. Изначально для получения лакмуса применялся следующий способ:
- растительное сырьё измельчают до порошкообразного состояния;
- порошок до 3-х недель вымачивают в содово-аммиачном растворе (сода или поташ + NH4OH) при постоянном перемешивании. Вместо раствора аммиака обычно использовалась моча (как источник ионов (CO3) 2- и NH4) + );
- после того, как в результате вымачивания (экстрагирования) и ферментации цвет смеси меняется с красного на голубой, осадок отделяют;
- после отделения осадка полученный голубой экстракт высушивается и размалывается. В результате образуется порошок смеси лакмусового и орцеинового пигментов;
- после спиртовой экстракции порошка карминово-красный раствор красящих веществ удаляется и остается тёмно-синий лакмус;
- прессовка осадка с гипсом или мелом позволяет получить легко крошащиеся блоки готового сухого лакмуса.
Современный способ получения орцеинового пигмента и лакмуса, запатентованный двумя английскими химиками (G. Gordon и Cuthbert Gordon) в 1758 году, заключался в следующем:
- растительное сырьё измельчают до порошкообразного состояния;
- порошок смешивают с водным раствором-суспензией извести-поташа и карбоната аммония и оставляют для ферментации на воздухе;
- примерно через 3 недели ферментации цвет смеси изменяется с фиолетового или коричневого на насыщенный синий;
- смесь разделяется на сите, выделенный раствор содержит до 90 % орцеина и до 8 % веществ лакмуса в пересчете на сухой остаток.
- далее раствор может использоваться для прессовки блоков из мела или гипса, либо выпариваться для последующей спиртовой экстракции орцеина.
Впервые лакмус был применён в качестве химического реагента и индикатора других веществ около 1300 г. испанским врачом и алхимиком Арнальдусом де Виланова (исп. Arnaldus de Villanova). С XVI-ого века, когда информация о способе получения лакмуса распространилась, голубой лакмус из лишайников Leuconora tartarea и Rocella tinctoria в промышленных количествах начал производиться в Голландии на экспорт под названиями «Bergmoos» и «Klippmoos». В 1704 году этот индикатор получил своё нынешнее название — лакмус. Название Lakmoes, ставшее прародителем современного названия препарата (англ. Litmus, нем. Lackmus, рус. Лакмус), было образовано от индогерманских корней «leg» (капать) и «mus» (каша) и отражало способ получения лакмуса — экстракцию по каплям из измельчённых в кашу лишайников. В 1640 году ботаники описали красящее вещество, которое они получали из душистого растения с тёмно-лиловыми цветками — гелиотропа. Химики вскоре стали использовать этот краситель в качестве индикатора (в растворах кислот он становился красным, а в щелочах синим). Изначально лакмус использовали в основном для исследования минеральных вод, но с 1670-х годов им в полной мере заинтересовались химики. Французский химик Пьер Поме писал: «Как только вношу незначительно малое количество кислоты, он становится красным, поэтому если кто хочет узнать, содержится ли в чём-нибудь кислота, его можно использовать». В связи с тем, что во Франции в широкое употребление у химиков сначала вошёл лакмус, выделенный из гелиотропа, во французском языке прижилось иное название лакмуса: tournesol, что означает «поворачивающийся за солнцем», а на греческом то же самое означает слово «гелиотроп». Позднее весь лакмус стали получать более дешёвым способом — из некоторых видов лишайников.
Для того, чтобы запомнить цвет лакмуса в различных средах, существует стихотворение:
Индикатор лакмус — красный
Кислоту укажет ясно.
Индикатор лакмус — синий,
Щёлочь здесь — не будь разиней,
Когда ж нейтральная среда,
Он фиолетовый всегда.
Существует словосочетание-мнемоника для запоминания индикаторных свойств лакмуса: «лак краски́с» (слышится как «лак раски́с»). Данное словосочетание означает, что «ЛАКмус КРАСный в КИСлоте».
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Cреда водных растворов веществ. Индикаторы
Материалы портала onx.distant.ru
Определение характера среды водных растворов веществ. Индикаторы.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Среда водных растворов
Вода и водные растворы окружают нас повсюду. В воде и в водных растворах присутствуют ионы Н + и ОН — . Избыток или недостаток этих ионов определяет среду раствора.
В нейтральном растворе количество ионов водорода Н + равно количеству гидроксид-ионов ОН – .
[ Н + ] = [ ОН – ]
Если количество ионов водорода Н + больше количества гидроксид-ионов ОН – , то среда раствора кислая:
[ Н + ] > [ ОН – ]
Если количество ионов водорода Н + меньше количества гидроксид-ионов ОН – , то среда раствора щелочная:
[ Н + ] ОН – ]
Для характеристики кислотности среды используют водородный показатель рН. Он определяется, как отрицательный десятичный логарифм концентрации ионов водорода. В нейтральной среде рН равен 7, в кислой — меньше 7, в щелочной — больше 7.
| Кислая среда | Нейтральная среда | Щелочная среда |
| [Н + ] > [ОН – ] | [Н + ] = [ОН – ] | [Н + ] – ] |
| pH | pH = 7 | pH > 7 |
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Индикаторы
Для определения среды раствора используют специальные вещества, которые изменяют цвет в зависимости от среды раствора: индикаторы. В зависимости от среды эти вещества могут переходить в разные формы с различной окраской.
Чаще всего используют следующие индикаторы: лакмус, метилоранж, фенолфталеин.
Окраска индикаторов в различных средах:
| Индикатор/среда | Кислая | Нейтральная | Щелочная |
| Лакмус | Красный | Фиолетовый | Синий |
| Метилоранж | Красный | Оранжевый | Желтый |
| Фенолфталеин | Бесцветный | Бесцветный | Малиновый |
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Растворы кислот и оснований
Характер среды определяется процессами, которые происходят с веществами в растворе. Кислот, основания и соли в воде диссоциируют на ионы. Кислоты диссоциируют на катионы водорода H + и анионы кислотных остатков:
HA = H + + A –
При этом в растворе возникает избыток катионов водорода Н + , поэтому среда водных растворов кислот — кислая (что вполне логично).
Сильные кислоты диссоциируют в разбавленных растворах практически полностью, поэтому среда разбавленных растворов сильных кислот, как правило, сильно кислотная. Некоторые кислоты (слабые) диссоциируют частично, поэтому среда водных растворов слабых кислот — слабо кислая.
Основания диссоциируют на катионы металлов и гидроксид-анионы ОН – :
МеОH = Ме + + ОН –
При этом в растворе возникает избыток катионов гидроксид-анионов ОН – , поэтому среда водных растворов оснований — щелочная. Сильные основания (щелочи) хорошо растворимы в воде, поэтому среда их водных растворов — сильно щелочная. Нерастворимые основания в воде практически не растворяются, поэтому в водном растворе оказывается лишь небольшое количество ионов ОН – . Среда водного раствора аммиака слабо щелочная.
Видео:Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать

Растворы солей
Среда водных растворов солей определяется не только диссоциацией, но и особенностями взаимодействия катионов металлов и анионов кислотных остатков с водой — гидролизом солей .
Попадая в воду, соли диссоциируют на катионы металлов (или ион аммония NH4 + ) и анионы кислотных остатков.
Катионы металлов, которым соответствуют слабые основания, притягивают из воды ионы ОН – , при этом в воде образуются избыточные катионы водорода Н + . Протекает гидролиз по катиону. Катионы металлов, которым соответствуют сильные основания, с водой таким образом не взаимодействуют.
Например , катионы Fe 3+ подвергаются гидролизу:
Fe 3+ + HOH ↔ FeOH 2+ + H +
Анионы кислотных остатков, которым соответствуют слабые кислоты, притягивают из воды катионы Н + , при этом в воде остаются гидроксид-анионы ОН – . Протекает гидролиз по аниону. Анионы кислотных остатков сильных кислот таким образом с водой не взаимодействуют.
Например , ацетат-ионы (остаток уксусной кислоты CH3COOH) подвергаются гидролизу:
CH3COO — + HOH ↔ CH3COOH + OH —
В зависимости от состава соли водные растворы солей могут иметь кислую, нейтральную или щелочную среду.
Типы гидролиза солей в водных растворах:
| Катио н/анион | Катион сильного основания | Катион слабого основания |
| Анион сильной кислоты | Гидролиз не идет | Гидролиз по катиону |
| Анион слабой кислоты | Гидролиз по аниону | Гидролиз по катиону и аниону |
Среда водных растворов солей:
| Катио н/анион | Катион сильного основания | Катион слабого основания |
| Анион сильной кислоты | Нейтральная | Кислая |
| Анион слабой кислоты | Щелочна я | Нейтральная* |
* на практике среда водных растворов солей, образованных слабым основанием и слабой кислотой, определяется силой кислоты и основания
Тип гидролиза и среда водных растворов некоторых солей:
| Катио н/анион | Na + | NH4 + |
| Cl – | NаCl, гидролиз не идет, среда нейтральная | (NH4)2CO3 гидролиз по катиону, среда щелочная |
| CO3 2 – | Na2CO3, гидролиз по аниону, среда щелочна я | Na2CO3, гидролиз по катиону и аниону, среда определяется силой кислоты и основания |
Индикаторы будут по-разному окрашиваться в водных растворах таких солей, в зависимости от среды. Таким образом, с помощью индикаторов можно различить водные растворы некоторых солей.
Окраска лакмуса в водных растворах солей, в зависимости от строения соли:
| Катио н/анион | Катион сильного основания | Катион слабого основания |
| Анион сильной кислоты | Лакмус фиолетовый | Лакмус красный |
| Анион слабой кислоты | Лакмус синий | Окраска лакмуса зависит от силы кислоты и основания |
Окраска лакмуса в водных растворах некоторых солей:
| Катио н/анион | Na + | NH4 + |
| Cl – | NаCl, лакмус фиолетовый | (NH4)2CO3 лакмус красный |
| CO3 2 – | Na2CO3, лакмус синий | Na2CO3, окраска лакмуса зависит от силы кислоты и основания |
Добавить комментарий
Этот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев.
Видео:Как УРАВНИВАТЬ химические уравнения | Расстановка коэффициентов в химических реакцияхСкачать

Что такое лакмус и чем он полезен
Легко объяснить, что такое лакмус — это химическое вещество природного происхождения, с помощью которого определяют кислотно-щелочной уровень воды или раствора. Попадая в кислотную среду, лакмус краснеет, в щелочную — приобретает синий оттенок, в нейтральную — фиолетовый. Это наиболее распространенный индикатор, который применяется в промышленности и может быть полезен в домашних условиях.
Видео:ХИМИЧЕСКИЕ УРАВНЕНИЯ | Как составлять уравнения реакций | Химия 8 классСкачать

Происхождение и получение лакмуса

Вещество добывают промышленным способом из нескольких видов лишайников, произрастающих в Швеции, Норвегии, США, Южной Америке, Анголе, Мадагаскаре, на Канарских и Азорских островах и некоторых других местах. Лакмус и его свойства были открыты примерно в 1300 году. Долгое время добыча материала была монополизирована, способ получения тщательно скрывался. Сначала его добывали следующим методом:
- сырье измельчали;
- вымачивали в содово-аммиачном растворе до 21 суток, постоянно перемешивая массу, в некоторых случаях вместо химических препаратов использовали мочу;
- когда масса из красной превращалась в голубую, осадок фильтровали;
- голубое вещество тщательно просушивали и размалывали в порошок;
- затем препарат подвергали спиртовой экстракции;
- соединяли с гипсом или мелом, прессовали и в результате получали готовые блоки лакмуса, которые легко крошились для дальнейшего использования.
В XVIII веке химики начали применять водный раствор извести и карбоната аммония вместо содово-аммиачного.
Видео:Что такое ИНДИКАТОРЫ и как их ЗАПОМНИТЬ?Скачать

Лакмусовая бумага
Индикаторная лакмусовая бумага представляет собой отрезки, пропитанные химическим веществом. Выпускается в виде отдельных полосок или в рулонах. Такой формат является наиболее распространенным.
Использовать лакмусовую бумагу очень легко. Достаточно оторвать одну полоску и погрузить в жидкость, которую необходимо исследовать. Почти сразу же бумага приобретет тот оттенок цвета, который соответствует кислотно-щелочному уровню исследуемого вещества. Вот что такое лакмус в действии.
Видео:Химия 11 класс. Индикаторы. Фенолфталеин, метилоранж, лакмусСкачать

Сфера применения
Применяется обычно для определения уровня PH в промышленности и в быту. Он используется:
- в химической промышленности для идентификации среды во время проведения исследований;
- в пищевой промышленности для распознавания уровня кислотности напитков и воды для питья;
- в косметологии при изготовлении кремов, тоников и прочих средств по уходу за кожей;
- в сельском хозяйстве для определения состава почвы;
- в медицине для проведения анализов мочи, слюны, прочих жидкостей и выделений;
- для определения кислотно-щелочного уровня воды в бассейнах, котлах отопления.
В повседневной жизни также будет нелишним знать, что такое лакмус и как его использовать. Любители растений, цветоводы и садоводы при помощи лакмусовой бумажки смогут определить уровень pH почвы и самодельных удобрений. Оптимальный кислотно-щелочной уровень почвы составляет 6-6,5 единиц для большинства растений. Если показатели отклоняются от нормы, растения замедляют рост, сбрасывают листву или прекращают цветение без видимых причин.
Аквариумные рыбки также чувствительны к уровню pH воды в аквариуме. Оптимальный баланс, который подходит для большинства разновидностей рыб и растений, составляет 6,3-7 единиц. Если показатели превышают отметку 7, растения могут погибнуть, а если опускаются ниже 6, рыбки могут не выжить.
Как магазинные, так и самодельные косметические средства должны иметь нейтральный уровень pH — примерно 5,5. Чтобы убедиться в этом, достаточно погрузить лакмусовую бумажку в жидкость или суспензию.
При некоторых заболеваниях важно контролировать кислотно-щелочной баланс крови или мочи. Для этого следует регулярно проводить тесты с лакмусовой бумагой в домашних условиях. В этом случае лечащий врач объяснит, что такое лакмус и как часто его следует применять.
Видео:Химические уравнения 8 класс - как расставить коэффициенты ?Скачать

Переносное значение слова «лакмус»
Этот химический термин нередко употребляется в переносном смысле. Вот что значит «лакмус»: нечто, что позволяет выяснить состояние какого-либо объекта, явления, события, системы. Например: «лакмусом наших отношений стал его подарок на 8 Марта».
🌟 Видео
ИндикаторыСкачать

Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

Закон сохранения массы. Расстановка коэффициентов. Урок 14. Химия 7 класс.Скачать

Химические уравнения. Как составлять химические уравнения.Скачать

Гидролиз солей. Теория для задания 23 ЕГЭ по химии.Скачать

Индикаторы: ФенолфталеинСкачать

Действие кислот на индикаторыСкачать

Индикаторы. Лакмус, метилоранж, фенолфталеин.Скачать

Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

Решение задач на термохимические уравнения. 8 класс.Скачать