Химическими реакциями называют явления, при которых одни вещества превращаются в другие.
Химическим уравнением называют условную запись химической реакции с помощью формул веществ и коэффициентов.
Признаками химических реакций являются:
- выделение газа
- выпадение или исчезновение осадка
- изменение цвета
- изменение запаха
- выделение тепла и света
- Давайте порассуждаем вместе
- Как расставлять коэффициенты в химических уравнениях
- Пример разбора простых реакций
- Пример разбора сложной реакции
- Видео
- Коэффициенты в химических уравнениях — как правильно расставлять и уравнивать
- Краткое описание
- Правильная запись реакций
- Ключевые нюансы
- Понятие ОВР в химии
- Определение коэффициентов
- Решение классической задачи
- Дополнительная информация
- Видео
Давайте порассуждаем вместе
1. Сумма коэффициентов в уравнении реакции между оксидом магния и оксидом азота (V) равна
Ответ: Составим уравнение реакции MgO + N2O5 = Mg(NO3)2 Сумма коэффициентов в уравнении равна 1 + 1 + 1 = 3
2. Сумма коэффициентов в уравнении реакции между оксидом фосфора (V) и оксидом натрия
Ответ: 3Na2O + P2O5 = 2Na3PO4 сумма коэффициентов равна 3+1+2 = 6
3. Сумма коэффициентов в уравнении реакции между магнием и оксидом углерода (IV)
Ответ: 2Mg + CO2 = 2MgO + C сумма коэффициентов равна 2 + 1 + 2 + 1 = 6
4. Сумма коэффициентов в левой части уравнения реакции между оксидом железа (II) и алюминием
Ответ: 3FeO + 2Al = Al2O3 + 3Fe сумма коэффициентов в левой части равна 3 + 2 = 5
5. Сумма коэффициентов в правой части уравнения реакции термического разложения перманганата калия
Ответ: 2KMnO4 = K2MnO4 + MnO2 + O2 сумма коэффициентов в правой части равна 1+ 1 + 1 = 3
6. Сумма коэффициентов в правой части уравнения реакции между оксидом железа (III) и водородом
Ответ: Fe2O3 + 3H2 = 2Fe + 3H2O сумма коэффициентов в правой части равна 2 + 3 = 5
7. К физическим явлениям относится процесс
2) плавление свинца
3) скисание молока
4) разложение малахита
Ответ: к физическим явлениям относится процесс плавления свинца, т.к. при физических явлениях изменяется агрегатное состояние, а само вещество не меняется.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Как расставлять коэффициенты в химических уравнениях
Содержание:
Все химические реакции, проходящие в окружающем мире можно описать при помощи специальных уравнений, представляющих собой химические формулы и математические знаки с коэффициентами. И от правильно расставленных коэффициентов в химических уравнениях порой зависит не много не мало, а то какой собственно и будет химическая реакция и будет ли она вообще. В нашей статье мы расскажем о том, как правильно расставлять коэффициенты в химии, чтобы химические уравнения были записаны верно.
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Пример разбора простых реакций
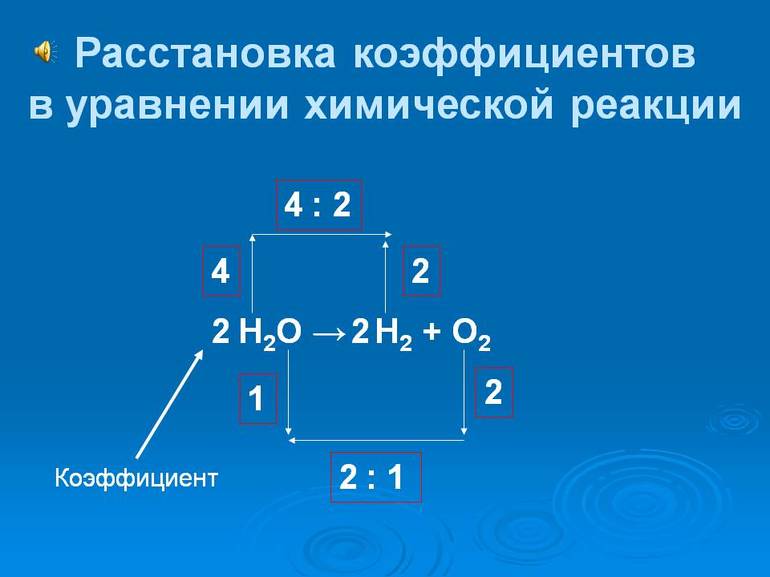
Главное правило, которым следует руководствоваться при составлении химических уравнений – принцип сохранения энергии вещества, то есть, сколько есть атомов каждого химического элемента в левой части уравнения, столько должно быть и в правой части того же уравнения.
Для примера возьмем химическую реакцию взаимодействия кальция (Ca) с кислородом (O2). Но для начала объясним, почему вообще кислород (как и некоторые другие химических элементы) в химических уравнениях записывается с индексом «2». Дело в том, что одна молекула кислорода имеет 2 атома, поэтому его записывают как O2. В свою очередь, к примеру, одна молекула воды, состоящая из кислорода и водорода, имеет всем известную формулу H2O. Это означает, что каждая молекула воды состоит из двух атомов водорода и одного атома кислорода. Заметьте, что по своему усмотрению индексы в химических уравнениях и формулах менять нельзя, так как они изначально должны быть написаны правильно.
Теперь вернемся к нашему простому примеру реакции взаимодействия кальция и кислорода. Ее можно записать следующим образом:
О чем говорит эта запись? О том, что в результате химической реакции взаимодействия кальция с кислородом образуется оксид кальция, который записан формулой CaO. Но также обратите внимание, что в правой части оксид кальция мы записали с коэффициентом 2 – 2CaO. Это значит, что каждый из двух атомов кислорода сцепился со своим атомом кальция, но тогда происходит несоответствие – в правой стороне у нас два атома кальция, в то время как в левой только лишь один. А значит, чтобы запись была правильной в левой части мы должны перед кальцием поставить коэффициент 2:
Теперь мы можем проверить наше уравнение – с левой стороны у нас два атома кальция и с правой тоже два, а значит между обеими частями можно вполне справедливо поставить знак равенства:
Разберем еще один простой пример, из взаимодействия кислорода и водорода как мы знаем, рождается одно из самых ценным и необычных веществ во Вселенной (и это без преувеличения) – вода, основа жизни на нашей планете. Образование воды можно записать следующим уравнением:
Но где же здесь закралась ошибка? Давайте разберем: в левой части у нас два атома кислорода, а в правой только один. Значит перед формулой воды необходимо поставить коэффициент 2:
Умножение 2 молекул воды на 2 атома водорода даст нам 4 атома водорода с правой стороны, но ведь с левой стороны атомов водорода лишь два! Значить перед водородом в уравнении мы также должны поставить коэффициент 2 и теперь получим правильное химическое уравнение, где вместо стрелочки → можно уже смело поставить знак равенства.
Видео:Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать

Пример разбора сложной реакции
Теперь давайте разберем то, как проставлять коэффициенты в более сложных химических уравнениях:
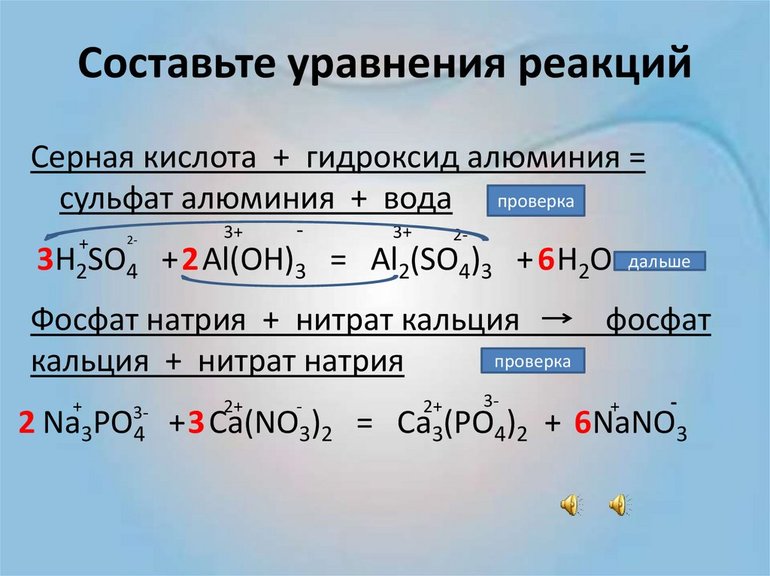
Перед вами запись так званой реакции нейтрализации – взаимодействие кислоты и основания, в результате которого образуются соли и вода.
Что же мы имеем тут: с левой стороны у нас один атом натрия (Na), а с правой индекс говорит, что атомов натрия уже стало два. Значит логично, что химическую формулу основания гидроксида натрия NaOH надо умножить на 2. Или другими словами поставить перед ней коэффициент 2:
Количество серы в серной кислоте (H2SO4) и соли сульфате натрия (Na2SO4) у нас одинаковое, тут все хорошо, а вот с количеством кислорода и водорода опять несоответствие, с левой стороны кислорода 6, а с правой 5. Водорода с правой стороны 4, а с левой только 2, непорядок. Чтобы правильно записать это химическое уравнение надо сравнять количество кислорода и водорода в левой и правой части уравнения, к счастью тут сделать это просто, надо перед H2O поставить коэффициент 2.
Таким образом, количество всех химических элементов в правой и левой части уравнения у нас сравнялись, а значит, мы неспроста поставили знак равенства.
Для закрепления материала разберем еще один пример сложного уравнения.
Это уравнение отображает химическую реакцию гидроксида бария (Ba(OH)2) с азотной кислотой (HNO3) в результате которой образуется нитрат бария (Ba(NO3)2) и вода.
Пример этот нам интересен тем, что тут используются скобки. Они означают, что если множитель стоит за скобками, то каждый элемент умножается на него. Начнем же разбирать это уравнение, первое, что бросается в глаза, несоответствие азота N, слева он один, а вот справа, если принимать во внимание скобки, его уже два. Получим следующее:
Теперь у нас слева стало 4 атома водорода, а справа только 2. Значит, перед формулой воды также ставим коэффициент 2.
Теперь все элементы уравнены, и мы справедливо поставили знак равенства.
Видео:СУММА КОЭФФИЦИЕНТОВ: Как решать Квадратные Уравнения по МАТЕМАТИКЕ 8 классСкачать

Видео
И чтобы окончательно закрепить материал, рекомендуем посмотреть это образовательное видео.
Видео:Как расставлять коэффициенты в уравнениях реакций? #shorts #youtubeshortsСкачать

Коэффициенты в химических уравнениях — как правильно расставлять и уравнивать
Видео:Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать

Краткое описание
Всем достоверно известно, что диоксид углерода (СО2) и вода (Н2О) образуются в результате горения метана (СН4) в кислороде (О2). Это химическое явление элементарное и вполне логическое. Саму реакцию можно обозначить следующим уравнением: СН4+О2→СО2+Н2О. Если ученик решил более углублённо заняться изучением этой удивительной науки, то наверняка ему будет интересно постараться извлечь из этого примера химического уравнения гораздо больше ценной информации, нежели просто просмотреть запись всех реагентов, а также продуктов реакции.
Уравнение относится к категории неполных, из-за чего неподготовленный ученик не может быстро посчитать, сколько именно молекул О2 уходит на одну молекулу метана, а также какое количество молекул диоксид углерода и воды можно получить в сумме. В такой ситуации может помочь дополнительная запись данных перед соответствующими молекулярными формулами (численные стехиометрические коэффициенты).
Указанные цифры будут обозначать, сколько именно молекул каждого вида будет принимать активное участие в химической реакции. В химии часто используется стехиометрия (направление науки, которое занимается изучением количественного соотношения между веществами, вступившими в реакцию и сформированными во время этого процесса продуктами) для переноса зарядов.
Чтобы ученик мог логическим образом закончить составление уравнения, необходимо усвоить одно, но очень важное правило: в обеих частях примера должно присутствовать равное число атомов каждой разновидности. Во время химических реакций не образуются новые атомы, а также не происходит ликвидация имеющихся молекул. Именно это правило базируется на законе сохранения массы, что тоже нужно запомнить.
Востребованные сегодня онлайн-калькуляторы позволяют найти ответы на самые сложные задания, а также выстроить поэтапно алгоритм решения более сложных упражнений.
Видео:8 класс. Химия. Как расставить коэффициенты в уравнении?Скачать

Правильная запись реакций
Различные примеры того, как можно уравнивать химические реакции позволяют ученикам лучше усвоить то, каким именно образом принято расставлять коэффициенты в уравнениях. Для избежания грубых ошибок нужно подробно разобраться во всех нюансах. Если ученику необходимо записать правильное уравнение, которое сможет подтвердить базовые характеристики метана, тогда ему следует выбрать один из следующих вариантов:
- Элементарное горение в воздухе кислорода.
- Специфическое галогенирование (специфическое взаимодействие с элементом типа VIIA).
Стоит отметить, что для первого варианта в левой части пишут первоначальное вещество, а вот в правой подробно описаны полученные во время реакции продукты. После тщательной проверки количества атомов можно сформировать оптимальную финальную запись происходящего процесса. Во время произведённых экспериментов специалистами было доказано, что в результате горения метана в кислороде неизбежно происходит своеобразный экзотермический процесс. В итоге возникает углекислый газ и водяной пар.
Чтобы уметь правильно расставлять коэффициенты в химических уравнениях, необходимо прибегнуть к действующему закону сохранения массы веществ.
Лучше всего начинать процесс уравнения с определения точного количества атомов углерода. На финальном этапе остаётся только выполнить все необходимые расчёты для водорода, чтобы после этого иметь возможность проверить количество кислорода. Базовые значения задействованных элементов можно узнать из специальной таблицы.
Видео:Расстановка коэффициентов в окислительно-восстановительных реакцияхСкачать

Ключевые нюансы
Для правильного решения поставленных задач ученики обязательно должны знать, что собой представляет балансировка химических уравнений. Элементарное уравнение необходимо для того, чтобы из самого обычного примера получить максимально развёрнутый результат.
Проще всего начинать изучение этой темы с углерода. В левой части присутствует всего один атом С, который является неотъемлемым компонентом состава молекулы СН4. А вот с правой стороны содержится одна молекула С, которая дополняет состав СО2. Это значит, что в двух присутствующих частях итоговое количество атомов углерода максимально совпадает, из-за чего нет необходимости выполнять какие-либо действия. Просто для лучшего понимания всех нюансов можно поставить единицу в качестве коэффициента перед молекулами с углеродом. Итоговая формула примет следующий вид: 1СН4+О2→1СО2+Н2О.
После всех проделанных манипуляций можно подсчитать количество атомов водорода. С левой стороны присутствует четыре атома H в составе СН4, а вот с правой — только два атома, которые входят в состав Н2О. После этого остаётся только всё уровнять. Для этих целей достаточно записать коэффициент 2 перед молекулой Н2О. В итоге не только в реагентах, но и в полученных продуктах будет по четыре молекулы водорода. Формула будет выглядеть так: 1СН4+О2→1СО2+2Н2О.
Во время расстановки коэффициентов методом электронного баланса очень важно не только разбираться в химии, но и владеть элементарными математическими навыками. Если изучить этот пример — 1СН4+2О2→1СО2+2Н2О, то можно понять, как выглядит полноценное уравнение исследуемой химической реакции. В этом случае полностью соблюдается закон о сохранении имеющейся массы.
Число атомов, которые вступают в сложную реакцию, максимально совпадает с итоговым количеством веществ определённого сорта по окончании реакции. Но ученику нужно хорошо понимать тот факт, что возникающая реакция представляет собой весьма специфическую последовательность отдельных промежуточных стадий. Но даже успешное уравнение не может раскрыть всю информацию об изучаемом молекулярном механизме.
Видео:Метод неопределенных коэффициентов. 10 класс.Скачать

Понятие ОВР в химии
В учебной литературе подробно описано то, что даже самые сложные уравнения можно уровнять. Но для этих целей понадобятся знания в сфере того, как управлять методом электронного баланса либо полуреакций. Существует определённая последовательность всех манипуляций, которая была разработана специалистами для поэтапной расстановки всех коэффициентов в реакциях двух категорий:
- Элементарное разложение.
- Специальное замещение.
Для избежания грубых ошибок на первом этапе правильно расставляют степени окисления возле каждого задействованного элемента. В этом случае нужно учитывать ряд рекомендаций:
- Показатель окисления всегда равен нулю у простых компонентов.
- Если в состав соединения входит три и более элемента, тогда у первого вещества проявляется положительная характеристика, а вот у крайнего только отрицательное. Необходимый центральный элемент высчитывают исключительно при помощи математических знаний, но в итоге должен получиться ноль.
- В соединении бинарного типа степень окисления соответствует нулю.
После проделанных манипуляций учащемуся нужно выбрать те ионы либо атомы, показатель степени окисления которых можно преобразовать. Количеством электронов можно показывать при помощи знаков + и -. А также нельзя забывать о необходимости определить наименьшее кратное. Во время деления НОК можно находить максимально достоверный результат.
Видео:Найдите сумму коэффициентов ➜ (3+x-3x²)²⁹(2-6x+5x²)³⁸ ➜ ДВИ ВМК МГУСкачать

Определение коэффициентов
Лучше всего разобраться во всех нюансах на конкретном примере. Специалисты рекомендуют рассмотреть тринитротолуол (ТНТ) С7Н5 N 3О6. Этот элемент отлично соединяется с кислородом, благодаря чему образуется Н2О, СО2, а также N2. Чтобы не запутаться, данные могут записаться в виде обычного уравнения реакций, с которым нужно будет активно работать: C7H5N3O6+O2→CO2+H2O+N2.
Гораздо проще самостоятельно составлять максимально развёрнутую химическую задачу, базируясь во время этого на двух молекулах тринитротолуола, так как с левой стороны содержится нечётное количество атомов азота и водорода, а с правой записывают чётное число молекул. Если изучить приведённый пример, то становится понятно, что атомы углерода, водорода и азота содержатся в соотношении 14:10:6. Но после нехитрых действий они подвергнутся изменениям. В итоге можно будет получить молекулы воды, диоксид углерода и азота (соотношение 5:14:3).
Полное химическое уравнение примет следующий вид — 4C7H5N3O6 + 21O2 → 28CO2 + 10H2O + 6N2. Пример несёт в себе много полезной информации, которая первым делом указывает на исходные вещества — конкретные реагенты, а также другие химические продукты. Во время реакции индивидуально сохраняются абсолютно все атомы каждого сорта.
Если попробовать умножить обе части уравнения на число Авогадро (NA=6,022·10 23 ), то в итоге можно будет смело утверждать, что 4 моля ТНТ реагируют на 21 моль О2. После такого «контакта» могут сформироваться 28 молей СО2, 10 молей Н2О, а также 6 молей N2.
Видео:89. Как расставить коэффициенты реакции методом электронного баланса (закрепление)Скачать

Решение классической задачи
Если учащемуся необходимо определить точный объём раствора хлороводорода 10%, стандартная плотность которого находится в пределах 1,05 г/мл, тогда нужно знать, что эта жидкость идеально подходит для полной ликвидации гидроксида кальция, неизбежно формирующегося в процессе гидролиза его карбида. Из химии всем хорошо известно, что во время этой процедуры в воздух выделяется специфический газ, объём которого составляет 8,96 л. Чтобы решить поставленную задачу без единой ошибки, нужно первым делом постараться составить уравнение для гидролиза карбида кальция.
Эта задача не является сложной, но только в том случае, если ученик хорошо усвоит все основные правила. Гидроксид кальция вступает во взаимодействие с хлороводородом, из-за чего происходит полноценная нейтрализация. На финальном этапе формула примет такой вид: Са (ОН)2+2HCI = CaCl2+2H2O. Обязательно нужно записать точную массу кислоты, так как она неизбежно понадобится для дальнейших действий. Остаётся установить объём задействованного раствора хлороводорода.
Абсолютно все расчёты по этой задаче должны выполняться в соответствии с коэффициентами стереохимического типа, что лишний раз подтверждает их актуальность.
Видео:В окислительно-восстановительной реакции найдите сумму коэффициентов в правой части уравнения.Скачать

Дополнительная информация
Если учитывать то, что в большинстве случаев расстановка коэффициентов вызывает определённые затруднения, тогда нужно отработать схему действий на конкретных примерах. Для лучшего понимания всех нюансов следует рассмотреть уравнение, которое связано с расстановкой важных данных в классической реакции окислительно-восстановительного типа. Нужно разобраться со следующей формулой: Н2S+HMnO4=S+MnO2…
Ключевая особенность этой задачи в том, что ученику нужно максимально дополнить утерянный продукт реакции, чтобы в итоге иметь возможность перейти к указанию всех необходимых коэффициентов. После правильной расстановки на положенные места базовых степеней окисления у каждого вещества в соединениях можно выполнить логический вывод, что первоначальные свойства проявляет только марганец, который понижает валентность. Восстановительную способность в этой реакции лучшим образом демонстрирует сера, которая восстанавливается до простого вещества.
После окончательного составления электронного баланса остаётся правильно расставить коэффициенты в предполагаемую схему химического процесса. На этом задачу можно считать выполненной.
Необходимо дополнительно поработать над нахождением наименьшего общего кратного, чтобы правильно делить, а также умножать числа. Расстановке коэффициентов в уравнениях обязательно нужно уделять должное внимание, так как это одна из основных тем в многогранной и интересной химии.
🎥 Видео
Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Как УРАВНИВАТЬ химические уравнения | Расстановка коэффициентов в химических реакцияхСкачать

Реакция на результаты ЕГЭ 2022 по русскому языкуСкачать

Уравнивание реакций горения углеводородовСкачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Химические уравнения 8 класс - как расставить коэффициенты ?Скачать

Как расставить коэффициенты? Как превратить схему химической реакции в уравнение химической реакции.Скачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать