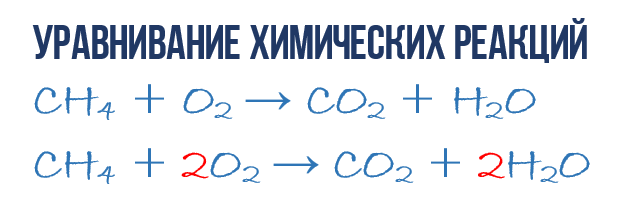В уроке 13 «Составление химических уравнений» из курса «Химия для чайников» рассмотрим для чего нужны химические уравнения; научимся уравнивать химические реакции, путем правильной расстановки коэффициентов. Данный урок потребует от вас знания химических основ из прошлых уроков. Обязательно прочитайте об элементном анализе, где подробно рассмотрены эмпирические формулы и анализ химических веществ.
- Химическое уравнение
- Уравнивание химических реакций
- Коэффициенты в уравнениях химических реакций
- Как решать задачи по химии. Расчет по уравнениям химических реакций.
- Алгоритм решения задач по химии
- Расчет по уравнениям химических реакций с использованием понятия количества вещества
- Решение задач по химии через пропорцию
- Как расставлять коэффициенты в химических уравнениях
- Пример разбора простых реакций
- Пример разбора сложной реакции
- Видео
- Видео
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Химическое уравнение
В результате реакции горения метана CH4 в кислороде O2 образуются диоксид углерода CO2 и вода H2O. Эта реакция может быть описана химическим уравнением:
Попробуем извлечь из химического уравнения больше сведений, чем просто указание продуктов и реагентов реакции. Химичекое уравнение (1) является НЕполным и потому не дает никаких сведений о том, сколько молекул O2 расходуется в расчете на 1 молекулу CH4 и сколько молекул CO2 и H 2 O получается в результате. Но если записать перед соответствующими молекулярными формулами численные коэффициенты, которые укажут сколько молекул каждого сорта принимает участие в реакции, то мы получим полное химическое уравнение реакции.
Для того, чтобы завершить составление химического уравнения (1), нужно помнить одно простое правило: в левой и правой частях уравнения должно присутствовать одинаковое число атомов каждого сорта, поскольку в ходе химической реакции не возникает новых атомов и не происходит уничтожение имевшихся. Данное правило основывается на законе сохранения массы, который мы рассмотрели в начале главы.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Уравнивание химических реакций
Уравнивание химических реакций нужно для того, чтобы из простого химического уравнения получить полное. Итак, перейдем к непосредственному уравниванию реакции (1): еще раз взгляните на химическое уравнение, в точности на атомы и молекулы в правой и левой части. Нетрудно заметить, что в реакции участвуют атомы трех сортов: углерод C, водород H и кислород O. Давайте подсчитаем и сравним количество атомов каждого сорта в правой и левой части химического уравнения.
Начнем с углерода. В левой части один атом С входит в состав молекулы CH4, а в правой части один атом С входит в состав CO2. Таким образом в левой и в правой части количество атомов углерода совпадает, поэтому его мы оставляем в покое. Но для наглядности поставим коэффициент 1 перед молекулами с углеродом, хоть это и не обязательно:
Затем переходим к подсчету атомов водорода H. В левой части присутствуют 4 атома H (в количественном смысле H4 = 4H) в составе молекулы CH4, а в правой – всего 2 атома H в составе молекулы H2O, что в два раза меньше чем в левой части химического уравнения (2). Будем уравнивать! Для этого поставим коэффициент 2 перед молекулой H2O. Вот теперь у нас и в реагентах и в продуктах будет по 4 молекулы водорода H:
Обратите свое внимание, что коэффициент 2, который мы записали перед молекулой воды H2O для уравнивания водорода H, увеличивает в 2 раза все атомы, входящие в ее состав, т.е 2H2O означает 4H и 2O. Ладно, с этим вроде бы разобрались, осталось подсчитать и сравнить количество атомов кислорода O в химическом уравнении (3). Сразу бросается в глаза, что в левой части атомов O ровно в 2 раза меньше чем в правой. Теперь-то вы уже и сами умеете уравнивать химические уравнения, поэтому сразу запишу финальный результат:
Как видите, уравнивание химических реакций не такая уж и мудреная штука, и важна здесь не химия, а математика. Уравнение (4) называется полным уравнением химической реакции, потому что в нем соблюдается закон сохранения массы, т.е. число атомов каждого сорта, вступающих в реакцию, точно совпадает с числом атомов данного сорта по завершении реакции. В каждой части этого полного химического уравнения содержится по 1 атому углерода, по 4 атома водорода и по 4 атома кислорода. Однако стоит понимать пару важных моментов: химическая реакция — это сложная последовательность отдельных промежуточных стадий, и потому нельзя к примеру истолковывать уравнение (4) в том смысле, что 1 молекула метана должна одновременно столкнуться с 2 молекулами кислорода. Процессы происходящие при образовании продуктов реакции гораздо сложнее. Второй момент: полное уравнение реакции ничего не говорит нам о ее молекулярном механизме, т.е о последовательности событий, которые происходят на молекулярном уровне при ее протекании.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Коэффициенты в уравнениях химических реакций
Еще один наглядный пример того, как правильно расставить коэффициенты в уравнениях химических реакций: Тринитротолуол (ТНТ) C7H5N3O6 энергично соединяется с кислородом, образуя H2O, CO2 и N2. Запишем уравнение реакции, которое будем уравнивать:
Проще составлять полное уравнение, исходя из двух молекул ТНТ, так как в левой части содержится нечетное число атомов водорода и азота, а в правой — четное:
- 2C7H5N3O6 + O2 → CO2 + H2O + N2 (6)
Тогда ясно, что 14 атомов углерода, 10 атомов водорода и 6 атомов азота должны превратиться в 14 молекул диоксида углерода, 5 молекул воды и 3 молекулы азота:
Теперь в обеих частях содержится одинаковое число всех атомов, кроме кислорода. Из 33 атомов кислорода, имеющихся в правой части уравнения, 12 поставляются двумя исходными молекулами ТНТ, а остальные 21 должны быть поставлены 10,5 молекулами O2. Таким образом полное химическое уравнение будет иметь вид:
Можно умножить обе части на 2 и избавиться от нецелочисленного коэффициента 10,5:
Но этого можно и не делать, поскольку все коэффициенты уравнения не обязательно должны быть целочисленными. Правильнее даже составить уравнение, исходя из одной молекулы ТНТ:
Полное химическое уравнение (9) несет в себе много информации. Прежде всего оно указывает исходные вещества — реагенты, а также продукты реакции. Кроме того, оно показывает, что в ходе реакции индивидуально сохраняются все атомы каждого сорта. Если умножить обе части уравнения (9) на число Авогадро NA=6,022·10 23 , мы сможем утверждать, что 4 моля ТНТ реагируют с 21 молями O2 с образованием 28 молей CO2, 10 молей H2O и 6 молей N2.
Есть еще одна фишка. При помощи таблицы Менделеева определяем молекулярные массы всех этих веществ:
- C 7 H 5 N 3 O 6 = 227,13 г/моль
- O 2 = 31,999 г/моль
- CO 2 = 44,010 г/моль
- H 2 O = 18,015 г/моль
- N 2 = 28,013 г/моль
Теперь уравнение 9 укажет еще, что 4·227,13 г = 908,52 г ТНТ требуют для осуществления полной реакции 21·31,999 г = 671,98 г кислорода и в результате образуется 28·44,010 г = 1232,3 г CO2, 10·18,015 г = 180,15 г H2O и 6·28,013 г = 168,08 г N2. Проверим, выполняется ли в этой реакции закон сохранения массы:
| Реагенты | Продукты | |
| 908,52 г ТНТ | 1232,3 г CO 2 | |
| 671,98 г CO 2 | 180,15 г H 2 O | |
| 168,08 г N 2 | ||
| Итого | 1580,5 г | 1580,5 г |
Но необязательно в химической реакции должны участвовать индивидуальные молекулы. Например, реакция известняка CaCO 3 и соляной кислоты HCl, с образованием водного раствора хлорида кальция CaCl 2 и диоксида углерода CO 2 :
Химическое уравнение (11) описывает реакцию карбоната кальция CaCO3 (известняка) и хлористоводородной кислоты HCl с образованием водного раствора хлорида кальция CaCl2 и диоксида углерода CO2. Это уравнение полное, так как число атомов каждого сорта в его левой и правой частях одинаково.
Смысл этого уравнения на макроскопическом (молярном) уровне таков: 1 моль или 100,09 г CaCO3 требует для осуществления полной реакции 2 моля или 72,92 г HCl, в результате чего получается по 1 молю CaCl2 (110,99 г/моль), CO2 (44,01 г/моль) и H2O (18,02 г/моль). По этим численным данным нетрудно убедиться, что в данной реакции выполняется закон сохранения массы.
Интерпретация уравнения (11) на микроскопическом (молекулярном) уровне не столь очевидна, поскольку карбонат кальция представляет собой соль, а не молекулярное соединение, а потому нельзя понимать химическое уравнение (11) в том смысле, что 1 молекула карбоната кальция CaCO3 реагирует с 2 молекулами HCl. Тем более молекула HCl в растворе вообще диссоциирует (распадается) на ионы H + и Cl — . Таким образом более правильным описанием того, что происходит в этой реакции на молекулярном уровне, дает уравнение:
Здесь в скобках сокращенно указано физическое состояние каждого сорта частиц (тв. — твердое, водн. — гидратированный ион в водном растворе, г. — газ, ж. — жидкость).
Уравнение (12) показывает, что твердый CaCO3 реагирует с двумя гидратированными ионами H + , образуя при этом положительный ион Ca 2+ , CO2 и H2O. Уравнение (12) как и другие полные химические уравнения не дает представления о молекулярном механизме реакции и менее удобно для подсчета количества веществ, однако, оно дает лучшее описание происходящего на микроскопическом уровне.
Закрепите полученные знания о составлении химических уравнений, самостоятельно разобрав пример с решением:
Надеюсь из урока 13 «Составление химических уравнений» вы узнали для себя что-то новое. Если у вас возникли вопросы, пишите их в комментарии.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Как решать задачи по химии. Расчет по уравнениям химических реакций.
Как решать задачи по химии? Как проводить простейшие расчеты по уравнениям химических реакций? Сколько выделяется газа, образуется воды, выпадает осадка или сколько получается конечного продукта реакций? Сейчас мы постараемся разобрать все нюансы и ответить на эти вопросы, которые очень часто возникают при изучении химии.
Решение задач в химии является неотъемлемой частью в изучении этой сложной, но очень интересной науки.
Видео:8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Алгоритм решения задач по химии
- Прочитать условия задачи (если они есть). Да, об этом все знают — как же решить задачу без условий — но все же, для полноты инструкции, мы не могли не указать этот пункт.
- Записать данные задачи. На этом пункте мы не будем заострять внимание, так как требования различных учебных заведений, учителей и преподавателей могут значительно отличаться.
- Записать уравнение реакции. Теперь начинается самое интересное! Здесь нужно быть внимательным! Обязательно необходимо верно расставить коэффициенты перед формулами веществ. Если вы забудете это сделать, то все наши усилия буду напрасны.
- Провести соответствующие расчеты по химическому уравнению. Далее рассмотрим, как же сделать эти самые расчеты.
Для этого у нас есть два пути, как решить задачу по химии. Условно, назовем их правильным (используя понятия количества вещества) и неправильным (используя пропорции). Конечно же, мы бы рекомендовали решать задачи правильным путем. Так как у неправильного пути имеется очень много противников. Как правило, учителя считают, что ученики, решающие задачи через пропорции, не понимают самой сути протекания процессов химических реакций и решают задачи просто математически.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Расчет по уравнениям химических реакций с использованием понятия количества вещества
Суть данного метода, состоит в том, что вещества реагируют друг с другом в строгом соотношении. И уравнение реакции, которое мы записали ранее, дает нам это соотношение. Коэффициенты перед формулами веществ дают нам нужные данные для расчетов.
Для примера, запишем простую реакцию нейтрализации серной кислоты и гидроксида натрия.
H_SO_ + NaOH → Na_SO_ + H_O
H_SO_ + 2NaOH → Na_SO_ + 2H_O
Исходя из этого уравнения, мы видим, что одна молекула серной кислоты взаимодействует с двумя молекулами гидроксида натрия. И в результате этой реакции получается одна молекула сульфата натрия и две молекулы воды.
Сейчас мы немного отступим от разбора задач, чтобы познакомиться с основными понятиями, которые пригодятся нам в решении задач по химии.
Рассчитывать количество молекул, например в 98 граммах серной кислоты — это не самое удобное занятие. Числа будут получаться огромными ( ≈ 6,022140857⋅10 23 молекул в 98 граммах серной кислоты) . Для этого в химии ввели понятие количества вещества (моль) и молярная масса.
1 Моль (единица измерения количества вещества) — это такое количество атомов, молекул или каких либо еще структурных единиц, которое содержится в 12 граммах изотопа углерода-12. Позднее выяснилось, что в 12 граммах вещества углерод-12 содержится 6,022140857⋅10 23 атомов. Соответственно, можно сказать, что 1 моль, это такая масса вещества, в которой содержится 6,022140857⋅10 23 атомов (или молекул) этого вещества.
Но ведь молекулы и атомы имеют различный состав и различное строение. Разные атомы содержат разное количество протонов и нейтронов. Соответственно 1 моль для разных веществ будет иметь разную массу, имея при это одинаковое количество молекул ( атомов). Эта масса называется молярной.
Молярная масса — это масса 1 моля вещества.
Используя данные понятия, можно сказать, что 1 моль серной кислоты реагирует с 2 молями гидроксида натрия, и в результате получается 1 моль сульфата натрия и 2 моль воды. Давайте запишем эти данные под уравнением реакции для наглядности.
beginH_SO_ & + & 2NaOH & → & Na_SO_ & + & 2H_O \ 1 : моль & & 2 : моль & & 1 : моль & & 2 : моль end
Следом запишем молярные массы для этих веществ
begin H_SO_ & + & 2NaOH & → & Na_SO_ & + & 2H_O \ 1 : моль & & 2 : моль & & 1 : моль & & 2 : моль \ 98 : г& & 40 : г & & 142 : г & & 18 : г end
Теперь, зная массу одного из веществ, мы можем рассчитать, сколько нам необходимо второго вещества для полного протекания реакции, и сколько образуется конечных продуктов.
Для примера, решим по этому же уравнению несколько задач.
Задача. Сколько грамм гидроксида натрия (NaOH) необходимо для того, чтобы 49 грамм серной кислоты (H2SO4) прореагировало полностью?
Итак, наши действия: записываем уравнение химической реакции, расставляем коэффициенты. Для наглядности, запишем данные задачи над уравнением реакции. Неизвестную величину примем за Х. Под уравнением записываем молярные массы, и количество молей веществ, согласно уравнению реакции:
begin49 : г & & X : г & & & & \ H_SO_ & + & 2NaOH & → & Na_SO_ & + & 2H_O \ 1 : моль & & 2 : моль & & 1 : моль & & 2 : моль \ 98 : г& & 40 : г & & 142 : г & & 18 : г end
Записывать данные под каждым веществом — не обязательно. Достаточно это будет сделать для интересующих нас веществ, из условия задачи. Запись выше дана для примера.
Примерно так должны выглядеть данные, записанные по условиям задачи. Не претендуем на единственно правильное оформление, требования у всех разные. Но так, как нам кажется, смотрится все довольно наглядно и информативно.
Первое наше действие — пересчитываем массу известного вещества в моли. Для этого разделим известную массу вещества (49 грамм) на молярную массу:
4998=0,5 моль серной кислоты
Как уже упоминалось ранее, по уравнению реакции 1 моль серной кислоты реагирует с 2 моль гидроксида натрия. Соответственно с 0,5 моль серной кислоты прореагирует 1 моль гидроксида натрия.
n(NaOH)=0.5*2=1 моль гидроксида натрия
Найдем массу гидроксида натрия, умножив количество вещества на молярную массу:
1 моль * 40 г/моль = 40 грамм гидроксида натрия.
Ответ: 40 грамм NaOH
Как видите, в решении задачи по уравнению реакции нет ничего сложного. Задача решается в 2-3 действия, с которыми справятся ученики начальных классов. Вам необходимо всего лишь запомнить несколько понятий.
Видео:Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Решение задач по химии через пропорцию
Ну и расскажем про второй способ вычислений по уравнениям химических реакций — вычисления через пропорцию. Этот способ может показаться немного легче, так как в некоторых случаях можно пропустить стадию перевода массы вещества в его количество. Чтобы было более понятно, объясню на том же примере.
Так же, как и в прошлом примере, запишем уравнение реакции, расставим коэффициенты и запишем над уравнением и под уравнением известные данные.
Для этого способа, нам так же понадобится записать под уравнением реакции, следом за молярной массой, массу вещества, соответствующую его количеству по уравнению. Если проще, то просто перемножить две строки под уравнением реакции, количество моль и молярную массу. Должно получиться так:
begin49 : г & & X : г & & & & \ H_SO_ & + & 2NaOH & → & Na_SO_ & + & 2H_O \ 1 : моль & & 2 : моль & & 1 : моль & & 2 : моль \ 98 : г& & 40 : г & & 142 : г & & 18 : г \ 98 : г & & 80 : г & & 142 : г & & 36 : г end
А теперь внимание, начинается магия! Нас интересует строка данных над уравнением, и самая нижняя строка под уравнением. Составим из этих данных пропорцию.
Далее находим неизвестное значение Х из пропорции и радуемся полученному значению:
Х=49*80/98=40 грамм
Как видим, получается тот же результат. Прежде всего, при решении задач в химии, главное все же — понимание химических процессов. Тогда решение задачи не станет для вас проблемой!
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Как расставлять коэффициенты в химических уравнениях
Содержание:
Все химические реакции, проходящие в окружающем мире можно описать при помощи специальных уравнений, представляющих собой химические формулы и математические знаки с коэффициентами. И от правильно расставленных коэффициентов в химических уравнениях порой зависит не много не мало, а то какой собственно и будет химическая реакция и будет ли она вообще. В нашей статье мы расскажем о том, как правильно расставлять коэффициенты в химии, чтобы химические уравнения были записаны верно.
Видео:Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Пример разбора простых реакций
Главное правило, которым следует руководствоваться при составлении химических уравнений – принцип сохранения энергии вещества, то есть, сколько есть атомов каждого химического элемента в левой части уравнения, столько должно быть и в правой части того же уравнения.
Для примера возьмем химическую реакцию взаимодействия кальция (Ca) с кислородом (O2). Но для начала объясним, почему вообще кислород (как и некоторые другие химических элементы) в химических уравнениях записывается с индексом «2». Дело в том, что одна молекула кислорода имеет 2 атома, поэтому его записывают как O2. В свою очередь, к примеру, одна молекула воды, состоящая из кислорода и водорода, имеет всем известную формулу H2O. Это означает, что каждая молекула воды состоит из двух атомов водорода и одного атома кислорода. Заметьте, что по своему усмотрению индексы в химических уравнениях и формулах менять нельзя, так как они изначально должны быть написаны правильно.
Теперь вернемся к нашему простому примеру реакции взаимодействия кальция и кислорода. Ее можно записать следующим образом:
О чем говорит эта запись? О том, что в результате химической реакции взаимодействия кальция с кислородом образуется оксид кальция, который записан формулой CaO. Но также обратите внимание, что в правой части оксид кальция мы записали с коэффициентом 2 – 2CaO. Это значит, что каждый из двух атомов кислорода сцепился со своим атомом кальция, но тогда происходит несоответствие – в правой стороне у нас два атома кальция, в то время как в левой только лишь один. А значит, чтобы запись была правильной в левой части мы должны перед кальцием поставить коэффициент 2:
Теперь мы можем проверить наше уравнение – с левой стороны у нас два атома кальция и с правой тоже два, а значит между обеими частями можно вполне справедливо поставить знак равенства:
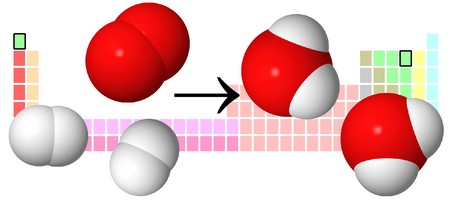
Разберем еще один простой пример, из взаимодействия кислорода и водорода как мы знаем, рождается одно из самых ценным и необычных веществ во Вселенной (и это без преувеличения) – вода, основа жизни на нашей планете. Образование воды можно записать следующим уравнением:
Но где же здесь закралась ошибка? Давайте разберем: в левой части у нас два атома кислорода, а в правой только один. Значит перед формулой воды необходимо поставить коэффициент 2:
Умножение 2 молекул воды на 2 атома водорода даст нам 4 атома водорода с правой стороны, но ведь с левой стороны атомов водорода лишь два! Значить перед водородом в уравнении мы также должны поставить коэффициент 2 и теперь получим правильное химическое уравнение, где вместо стрелочки → можно уже смело поставить знак равенства.
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Пример разбора сложной реакции
Теперь давайте разберем то, как проставлять коэффициенты в более сложных химических уравнениях:
Перед вами запись так званой реакции нейтрализации – взаимодействие кислоты и основания, в результате которого образуются соли и вода.
Что же мы имеем тут: с левой стороны у нас один атом натрия (Na), а с правой индекс говорит, что атомов натрия уже стало два. Значит логично, что химическую формулу основания гидроксида натрия NaOH надо умножить на 2. Или другими словами поставить перед ней коэффициент 2:
Количество серы в серной кислоте (H2SO4) и соли сульфате натрия (Na2SO4) у нас одинаковое, тут все хорошо, а вот с количеством кислорода и водорода опять несоответствие, с левой стороны кислорода 6, а с правой 5. Водорода с правой стороны 4, а с левой только 2, непорядок. Чтобы правильно записать это химическое уравнение надо сравнять количество кислорода и водорода в левой и правой части уравнения, к счастью тут сделать это просто, надо перед H2O поставить коэффициент 2.
Таким образом, количество всех химических элементов в правой и левой части уравнения у нас сравнялись, а значит, мы неспроста поставили знак равенства.
Для закрепления материала разберем еще один пример сложного уравнения.
Это уравнение отображает химическую реакцию гидроксида бария (Ba(OH)2) с азотной кислотой (HNO3) в результате которой образуется нитрат бария (Ba(NO3)2) и вода.
Пример этот нам интересен тем, что тут используются скобки. Они означают, что если множитель стоит за скобками, то каждый элемент умножается на него. Начнем же разбирать это уравнение, первое, что бросается в глаза, несоответствие азота N, слева он один, а вот справа, если принимать во внимание скобки, его уже два. Получим следующее:
Теперь у нас слева стало 4 атома водорода, а справа только 2. Значит, перед формулой воды также ставим коэффициент 2.
Теперь все элементы уравнены, и мы справедливо поставили знак равенства.
Видео:Расчет выхода продукта от теоретически возможного. 10 класс.Скачать

Видео
И чтобы окончательно закрепить материал, рекомендуем посмотреть это образовательное видео.
🎥 Видео
Продукты окислительно-восстановительных реакций. 1 часть. 11 класс.Скачать

Как определить продукты в окислительно-восстановительных реакциях. Ч.1. Введение.Скачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

8 класс. Составление уравнений химических реакций.Скачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Определение продуктов реакции в ОВР (прогнозирование продуктов)Скачать

Окислительно-восстановительные реакции с нуля!| Екатерина Строганова | 100балльный репетиторСкачать

ХИМИЧЕСКИЕ УРАВНЕНИЯ - Топ 5 Ошибок в уравнениях химических реакций // Подготовка к ЕГЭ по ХимииСкачать