Нитрат кальция Ca(NO3)2 — соль щелочного металла кальция и азотной кислоты. Белый, при нагревании разлагается. Хорошо растворяется в воде (гидролиза нет).
Относительная молекулярная масса Mr = 164,09; относительная плотность для тв. и ж. состояния d = 2,36; tпл = 561º C (разлагается).
Видео:Реакция азотной кислоты и карбоната кальция, получение нитрата кальция/Obtaining calcium nitrateСкачать

Нитрат кальция ГОСТ 4142-77
(безводная) 164,088 г/моль;(тетрагидрат) 236,15 г/моль(безводная) 2,504 г/см³;(тетрагидрат) 1,896 г/см³(безводная) 561 °C;(тетрагидрат) 42,7 °C(тетрагидрат) 132 °Cмоноклинная (тетрагидрат)
| Нитрат кальция | |
|---|---|
 | |
 | |
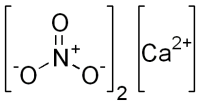 | |
| Традиционные названия | кальциевая селитра, норвежская селитра, азотнокислый кальций |
| Хим. формула | Ca(NO3)2 |
| Состояние | гранулы сферической формы белого, светло-серого, светло-бежевого цвета |
| Молярная масса | |
| Т. всп. | негорючая °C |
| Мол. теплоёмк. | 149,33 Дж/(моль·К) |
| Энтальпия образования | -937,2 кДж/моль |
| Растворимость в воде | Безводной: 121,2 г/100 мл (20 °C); 271,0 г/100 мл (40 °C); 359 г/100 мл (51,6 °C). Тетрагидрата: 102 г/100 мл (0 °C); 129 г/100 мл (20 °C); (100 °C) 363 г/100 мл |
| Растворимость в | спирте и ацетоне |
| Кристаллическая структура | |
| Рег. номер CAS | |
| PubChem | 24963 |
| Рег. номер EINECS | 233-332-1 |
| SMILES | |
| RTECS | EW2985000 |
| ChEBI | 64205 |
| Номер ООН | 1454 |
| ChemSpider | 23336 и 21500286 |
| ГОСТ | ГОСТ 4142-77 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Кальция нитрат (кальциевая селитра, азотнокислый кальций) — неорганическая соль азотной кислоты. Соединение сильно гигроскопично, поэтому его хранят без доступа влаги. Химическая формула Ca(NO3)2.
Видео:Кальциевая селитра: когда и для каких культур?Скачать

Содержание
- 1 Свойства
- 2 Получение
- 2.1 Реакции с получением нитрата кальция
- 3 Применение
- 3.1 В сельском хозяйстве
- 3.2 В пиротехнике
Видео:Получение нитрата кальция _ чрезвычайно гигроскопичное вещество!Скачать

Свойства
При 500 °C начинает разлагаться с выделением O2 и образованием сначала Ca(NO2)2, а затем CaO и NO2. Кальциевая селитра при нормальных условиях негорючая, пожаро- и взрывобезопасная, устойчивая в интервале температур от −60 °C до +155 °C.
Видео:Реакция при смешивании нитрата кальция и сульфата магнияСкачать

Получение
Получают кальция нитрат действием HNO3 на известняк или поглощением нитрозных газов (в основном NO2) известковым молоком. Применяют кальция нитрат как азотное удобрение и для получения особо чистого CaO.
Для получения гранулированной кальциевой селитры используется способ низкотемпературной нейтрализации азотной кислоты природным известняком или продуктами переработки известняка.
Реакции с получением нитрата кальция
Нитрат кальция производится путём обработки известняка с азотной кислотой, после нейтрализации аммиака.
Он также является побочным продуктом процесса Оддо при добыче фосфата кальция.
Так же как нитраты других щелочноземельных металлов и LiNO3, кальциевая селитра при нагревании разлагается на выпуске диоксида азота.
Видео:Получение Оксида Кальция - CaO. Разложение Нитрата Кальция - Ca(NO3)2Скачать

Применение
Гранулированный, безводный нитрат кальция, применяется как добавка в бетон, в качестве удобрения, для приготовления рассола в холодильной технике, в производстве реактивов, стеклопластиков, а также как один из компонентов для производства взрывчатки.
В сельском хозяйстве
Нитрат кальция является физиологическим щелочным удобрением, пригодным для всех почв и прежде всего для закисленных почв. В сельском хозяйстве применяют как азотное удобрение. Выпускают в гранулированном виде; товарный продукт должен содержать не менее 15,5 % азота, кроме того, к нему добавляют в процессе производства 4—7 % нитрата аммония для уменьшения гигроскопичности удобрения; содержание влаги не должно превышать 15 %. Нитрат кальция вносят под все культуры. Наиболее эффективен на кислых почвах, особенно для весенней подкормки озимых.
В пиротехнике
Несмотря на то, что нитрат кальция в смеси с горючими веществами способен давать недорогой источник кирпично-красного пламени, применение его в этом качестве крайне ограничено из-за сильной гигроскопичности.
Видео:ВЫБИРАЕМ НИТРАТ КАЛЬЦИЯ! #агробизнес #удобрения #агроном #нитраткальция #кальций #нитрат #теплицаСкачать

Производство нитрата кальция из известняка и азотной кислоты
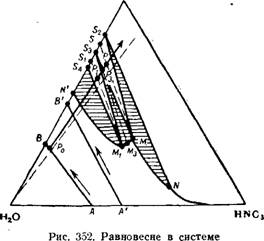
На диаграмме рис. 352 изображено равновесие в системе Ca(N03)2—HN03—Н20 при 25°. Точки S2, S2 и S4 соответствуют Ди-, три — и тетрагидрату Ca(N03)2- Области существования Этих кристаллогидратов находятся в пределах заштрихованных криволинейных треугольников: в треугольнике SkMiN’ — тетрагид — рат, в треугольнике S3MMi—-тригидрат, в треугольнике S2MN — Дигидрат. Эти области ограничены кривой N’M^MN растворимости кристаллогидратов в кислых растворах и линиями перехода кристаллогидратов. Ниже и левее линии растворимости находится область ненасыщенных кислых растворов.
Для получения иитрата кильция применяется обычно слабая азотная кислота. При нейтрализации известняком 30%-ной (Л) или
18%-ной (А’) азотиой кислоты изменение состава раствора по мере нейтрализации изображается прямыми АВ и А’В’. Эти прямые не пересекают кривой насыщения N‘MiMN. Следовательно, твердую соль можно получить лишь после выпаривания нейтрализованного раствора.
Допустим, что в результате нейтрализации 30%-иой кислоты известняком получеи слабокислый раствор, состав которого изображается точкой Р0. При выпаривании этого раствора фигуративная точка системы, из которой удаляется вода, будет передвигаться вдоль прямого луча PqP. На этом луче интервал PtP соответствует содержанию в системе приблизительно 75—78% Ca(N03)2. Если состав раствора после выпаривания изображается точкой Р, то при его охлаждении до 25° выкристаллизуется смесь ди — и тригидрата. Состав этой смеси изображается точкой 5, а состав маточного раствора — точкой М.
Если же выпаривание произведено до точки Р, то после охлаждения до 25° будет получена смесь кристаллов три — и тетра — гидрата состава Si; состав маточного раствора в этом случае изобразится точкой Mi. При выпаривании до точки Р3 после охлаждения будут получены кристаллы тригидрата Ca(N03)2 • ЗН20.
Нейтрализацию кускового известняка или мела осуществляют обычно в башнях циркулирующей 40—48%-иой азотной кислотой. Кислый раствор кальциевой селитры, вытекающий из башни, проходит отстойники для отделения от частиц песка и других нерастворимых примесей и снова подается иа орошение башни.
Когда остаточная кислотность раствора понизится до 1,5—1,9% HN03, его отводят иа донейтрализацию аммиаком или известью — пушонкой. При применении аммиака в кальциевой селитре образуется некоторое количество нитрата аммония, в присутствии которого облегчается процесс кристализации Ca(N03)2 из плава.
Башни, донейтрализатор, отстойники и насосы изготовляются из нержавеющей стали марки 1Х18Н9Т. Для фильтрования образующихся вязких растворов Ca(N03)2 обычно применяют фильтр — прессы. Отфильтрованный раствор, содержащий
49% Ca(N03)2 и 3% NH4N03, выпаривают под вакуумом до 75—82% Ca(N03)2. Получаемый плав кальциевой селитры кристаллизуют иа охлаждающих вальцах или в грануляционной башне.
В СССР кальциевую селитру производят ие из азотной кислоты, а из отбросных нитрозных газов, что дает более дешевый продукт.
Производство нитрата кальция из нитрозных
R а 3 Q в 210, 211, 214, 215
При промывке нитрозных газов известковым молоком образуется щелок, содержащий нитрит кальция с примесью некоторого количества нитрата кальция:
Са(ОН)2 + NO + NOj = Ca(N02)2 + Н20 2Са(ОН)2 + 4N02 = Ca(N03)2 + Ca(N02)2 + 2Н20
Абсорбцию нитрозных газов известковым молоком осуществляют в башиях циркулирующим раствором, в котором поддерживают избыточную щелочность до 30 г/л добавкой к иему известкового молока, содержащего 100—130 г/л СаО или сухой извести, что позволяет получать более концентрированный щелок. Температура щелока, поступающего на орошение, 30—35°. Из хвостовых газов улавливается ие менее 92% окислов азота.
Вытекающий из абсорбционных башен щелок подвергается’ инверсии азотной кислотой с целью перевода нитрита в нитрат: 3Ca(N02)2 + 4HN03 = 3Ca(N03)2 + 2Н20 + 4NO
Выделяющиеся при инверсии окислы азота возвращают в абсорбционную систему производства слабой азотной кислоты. Инверсию проводят при обогреве острым паром и при интенсивном перемешивании раствора сжатым воздухом (рис. 353).
В инвертированном растворе Ca(N03)2 остается избыток азотной кислоты, которую нейтрализуют аммиаком. При этом образуется некоторое количество аммиачной селитры, что в данном случае является полезным (стр. 1215). Далее раствор фильтруют, подогревают до 60—70° и направляют на выпаривание в одно — и. многокорпусные выпарные установки. Обычно применяют выпарные аппараты вертикального типа с внутренней или выносной греющей камерой.
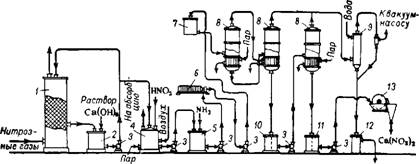
Рис. 353. Схема производства кальциевой селитры методом щелочного поглощения нитрозных газов:
/ — поглотительная башня; 2 — сборник нитрит-нитратного раствора; 3 — центробежный насос; 4 — инвертор; 5 — донейтрализатор; 6 — фильтрпресс; 7 —напорный бачок для отфильтрованного раствора; 8 —выпарной аппарат; 9 — барометрический конденсатор; 10 — сборник выпаренного раствора кальциевой селитры; 11 — сборник плава кальциевой селитры; 12 — барометрический ящнк; 13 — охлаждающие вальцы.
При одноступенчатой схеме выпарки (однокорпусная установка) выпаривание проводится при следующих условиях:
TOC o «1-3» h z Давление греющего пара, ат. •. 5
Разрежение в аппарате, мм рт. ст. 500
Температура плава на выходе из аппарата, °С. . 120
Температура сокового пара, °С. 105
Состав раствора, поступающего на выпарку. Г. 25% Ca(N03)2
Состав плава на выходе из аппарата . 77—82% Ca(N03)2
В случае применения трехступенчатой выпарки первый и второй выпарные аппараты работают непрерывно, третий — периодически. Режим работы трехкорпусной установки характеризуется следующими показателями:
Концентрация раствора, % коРпус корпус к°р»ус
На входе в аппарат. 25 36′ 60
На выходе из аппарата. 36 60 83
Давление греющего пара, ат. 6 1,5 6
Давление сокового пара, ат. 1,5 0,2 0,2
Температура кипения раствора, °С. 118—120 78 — 80 110—11
Кристаллизация является наиболее сложным процессом в производстве кальциевой селитры 214—2i7_ Механизм образования кристаллов кальциевой селитры до настоящего времени недостаточно выяснен. Структура образующихся кристаллов соли очень различна: иногда при кристаллизации получаются твердые, легко отделяющиеся от охлаждающей поверхности агрегаты кристаллов, в других случаях образуется вязкий сиропообразный плав, не застывающий в твердую корочку. Даже при сильном переохлаждении плава кальциевой селитры, в некоторых случаях кристаллизация может еще не наступить. Чтобы вызвать кристаллизацию, в плав вносят затравку — кристаллы кальциевой селитры, однако кристаллизация при этом не всегда проходит одинаково. Большое влияние на процесс кристаллизации кальциевой селитры оказывает аммиачная селитра, в присутствии которой скорость кристаллизации Ca(N03)2 увеличивается в 1,5—2 раза с одновременным повышением температуры кристаллизации на 50°. Чем больше содержится аммиачной селитры в растворе, тем лучше идет кристаллизация. Обычно добавка NH4NO3 составляет 5—6% от веса кальциевой селитры.
Установлено 208, что при содержании 5% аммиачной селитры 72%-ный плав кальциевой селитры (плотность 1,72 г/см3) на охлаждающих вальцах совсем не кристаллизуется; плав, содержащий 73—82% Ca(N03)2 + NH4NO3 (плотность 1,76— 1,88 г/см3), кристаллизуется хорошо, 83%-ный плав (плотность свыше 1,88 г/См3) Кристаллизуется плохо. Примеси нитратов железа и алюминия почти не оказывают влияния на скорость кристаллизации, в присутствии же силикатов и нитрата натрия кристаллизация затрудняется — получаются липкие и плохо затвердевающие кристаллы соли.
Кристаллизацию кальциевой селитры с добавкой аммиачной селитры на охлаждающих вальцах проводят при 90°; при этом большая часть соли кристаллизуется в виде двухводного гидрата. Температуру плава в корыте вальцов поддерживают около 110°. Перед загрузкой в тару кальциевую селитру следует охладить по крайней мере до 30°, так как горячая соль склонна к слипанию, что ухудшает ее рассеваемость. Охлаждение кальциевой селитры производят в барабане, через который продувают охлажденный воздух. Схема охлаждения воздуха такая же, как и при «холодной» сушке аммиачной селитры (стр. 1196).
Для производства 1 т кальциевой селитры [82% Са(Н03)г] расходуется 3,3 т 25%-ного раствора Ca(N03)2, 2 т пара (6 ат), 75 м3 воды, 23,5 кет • ч электроэнергии.
Разработан способ гранулирования кальциевой селитры (а также карбамида и других плавов), рекомендуемый вместо охлаждения ее на поверхности барабана или разбрызгивания в башне b потоке воздуха. Этот способ заключается в кристаллизации
капель раствора Ca(N03)2, разбрызгиваемых в минеральном масле, содержащем зародыши кристаллов, с последующим отделением гранул от масла центрифугированием 218. —
Рис. 354. Политерма растворимости в системе NaN03—NaN02—Н20.
Предложено также упарку растворов, грануляцию и охлаждение нитрата кальция производить в одном аппарате с кипящим слоем 21Э.
🔥 Видео
Получение и химические свойства ОКСИДОВ 8 класс | ПРИНЦИП составления реакций с участием оксидовСкачать

ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Получение Нитрат калия. KNO3. Калиевая силитра. Удобрение.Скачать

Новое производство нитрата кальцияСкачать

Решаем два варианта Добротина за 2 часаСкачать

ОГЭ 22е задание Нитрат кальцияСкачать

ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Экзотермическая реакция при растворении концентрированного нитрата кальцияСкачать

Нитрат кальция четырёхводный. Кристаллизация.Скачать

Чего не хватает томатам? КАЛИЯ или КАЛЬЦИЯ? Разбираемся в хитростях подкормок. Кальций для растений.Скачать

Карбонаты и гидрокарбонаты. Способы получения и химические свойства | ХимияСкачать

Нитрат кальцияСкачать

Нитрит Калия- пищевая добавка, яд, антидот.Скачать

Реакция НИТРАТА КАЛЬЦИЯ и СУЛЬФИТА НАТРИЯ. Получение СУЛЬФИТА КАЛЬЦИЯ. Опыты по химии.Скачать