Гидроксид натрия (едкий натр) NaOH — белый, гигроскопичный, плавится и кипит без разложения. Хорошо растворяется в воде.
Относительная молекулярная масса Mr = 40; относительная плотность для тв. и ж. состояния d = 2,130; tпл = 321º C; tкип = 1390º C;
- Способы получения
- Качественная реакция
- Химические свойства
- Гидроксид натрия
- Содержание
- Физические свойства
- Химические свойства
- Качественное определение ионов натрия
- Методы получения
- Химические методы получения гидроксида натрия
- Пиролитический метод
- Известковый метод
- Ферритный метод
- Электрохимические методы получения гидроксида натрия
- Диафрагменный метод
- Мембранный метод
- Ртутный метод с жидким катодом
- Лабораторные методы получения
- Рынок каустической соды
- Применение
- Меры предосторожности при обращении с гидроксидом натрия
- 🌟 Видео
Видео:ГИДРОКСИД НАТРИЯ | NaOH | Химические свойства ГИДРОКСИДА НАТРИЯ | Качественные реакции | ХимияСкачать

Способы получения
1. Гидроксид натрия получают электролизом раствора хлорида натрия :
2NaCl + 2H2O → 2NaOH + H2 + Cl2
2. При взаимодействии натрия, оксида натрия, гидрида натрия и пероксида натрия с водой также образуется гидроксид натрия:
2Na + 2H2O → 2NaOH + H2
Na2O + H2O → 2NaOH
2NaH + 2H2O → 2NaOH + H2
3. Карбонат натрия при взаимодействии с гидроксидом кальция образует гидроксид натрия.
Видео:Как получить гидроксид натрия в домашних условиях ?Скачать

Качественная реакция
Качественная реакция на гидроксид натрия — окрашивание фенолфталеина в малиновый цвет.
Видео:Гидроксид натрия.Цветные реакции с едким натром.Получение щелочи и опыты.Сульфид,сульфит из натрия!Скачать

Химические свойства
1. Гидроксид натрия реагируют со всеми кислотами (и сильными, и слабыми, и растворимыми, и нерастворимыми). При этом образуются средние или кислые соли, в зависимости от соотношения реагентов.
2. Гидроксид натрия реагирует с кислотными оксидами . При этом образуются средние или кислые соли, в зависимости от соотношения реагентов.
3. Гидроксид натрия реагирует с амфотерными оксидами и гидроксидами . При этом в расплаве образуются средние соли, а в растворе комплексные соли.
в растворе образуется комплексная соль — тетрагидроксоалюминат.
4. С кислыми солями гидроксид натрия также может взаимодействовать. При этом образуются средние соли, или менее кислые соли.
5. Гидроксид натрия взаимодействует с простыми веществами-неметаллами (кроме инертных газов, азота, кислорода, водорода и углерода).
При этом кремний окисляется до силиката и водорода
Фтор окисляет щелочь. При этом выделяется молекулярный кислород.
Другие галогены, сера и фосфор — диспропорционируют в растворе гидроксида натрия.
Сера взаимодействует с гидроксидом натрия только при нагревании
6. Гидроксид натрия взаимодействует с амфотерными металлами , кроме железа и хрома. При этом в расплаве образуются соль и водород.
В растворе образуются комплексная соль и водород:
2NaOH + 2Al + 6Н2О = 2Na[Al(OH)4] + 3Н2
7. Гидроксид натрия вступает в обменные реакции с растворимыми солями .
Хлорид меди (II) реагирует с гидроксидом натрия с образованием хлорида натрия и осадка гидроксида меди (II):
2NaOH + CuCl2 = Cu(OH)2↓+ 2NaCl
Также с гидроксидом натрия взаимодействуют соли аммония.
Например , при взаимодействии хлорида аммония и гидроксида натрия образуются хлорид натрия, аммиак и вода:
NH4Cl + NaOH = NH3 + H2O + NaCl
8. Гидроксид натрия разлагается при нагревании до температуры 600°С:
2NaOH → Na2O + H2O
9. Гидроксид натрия проявляет свойства сильного основания. В воде практически полностью диссоциирует , образуя щелочную среду и меняя окраску индикаторов.
NaOH ↔ Na + + OH —
10. Гидроксид натрия в расплаве подвергается электролизу . При этом на катоде восстанавливается натрий, а на аноде выделяется молекулярный кислород:
4NaOH → 4Na + O2 + 2H2O
Видео:Опыты по химии. Получение и исследование амфотерных свойств гидроксида алюминияСкачать

Гидроксид натрия
| Гидроксид натрия | |
|---|---|
 | |
 | |
| Традиционные названия | едкий натр, каустик, каустическая сода, едкая щёлочь |
| Хим. формула | NaOH |
| Рац. формула | NaOH |
| Молярная масса | 39,997 г/моль |
| Плотность | 2,13 г/см³ |
| Т. плав. | 323 °C |
| Т. кип. | 1403 °C |
| Давление пара | 0 ± 1 мм рт.ст. |
| Растворимость в воде | 108,7 г/100 мл |
| ГОСТ | ГОСТ 4328-77 ГОСТ Р 55064-12 ГОСТ 2263-79 |
| Рег. номер CAS | 1310-73-2 |
| PubChem | 14798 |
| Рег. номер EINECS | 215-185-5 |
| SMILES | |
| Кодекс Алиментариус | E524 |
| RTECS | WB4900000 |
| ChEBI | 32145 |
| Номер ООН | 1823 |
| ChemSpider | 14114 |
| Пиктограммы СГС | 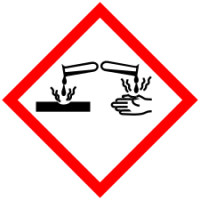 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Гидроксид натрия (лат. Nátrii hydroxídum ; другие названия — каустическая сода, едкий натр) — самая распространённая щёлочь, химическая формула NaOH. В год в мире производится и потребляется около 57 миллионов тонн едкого натра.
Интересна история тривиальных названий как гидроксида натрия, так и других щелочей. Название «едкая щёлочь» обусловлено свойством разъедать кожу (вызывая сильные ожоги), бумагу и другие органические вещества. До XVII века щёлочью (фр. alkali ) называли также карбонаты натрия и калия. В 1736 году французский учёный Анри Дюамель дю Монсо впервые различил эти вещества: гидроксид натрия стали называть каустической содой, карбонат натрия — кальцинированной содой, а карбонат калия — поташом. В настоящее время содой принято называть натриевые соли угольной кислоты. В английском и французском языках слово sodium означает натрий, potassium — калий.
Видео:ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать

Содержание
- 1 Физические свойства
- 2 Химические свойства
- 3 Качественное определение ионов натрия
- 4 Методы получения
- 4.1 Химические методы получения гидроксида натрия
- 4.1.1 Пиролитический метод
- 4.1.2 Известковый метод
- 4.1.3 Ферритный метод
- 4.2 Электрохимические методы получения гидроксида натрия
- 4.2.1 Диафрагменный метод
- 4.2.2 Мембранный метод
- 4.2.3 Ртутный метод с жидким катодом
- 4.2.4 Лабораторные методы получения
- 4.1 Химические методы получения гидроксида натрия
- 5 Рынок каустической соды
- 6 Применение
- 7 Меры предосторожности при обращении с гидроксидом натрия
Видео:Реакция нейтрализации гидроксида натрия соляной (хлороводородной) кислотойСкачать

Физические свойства
Гидроксид натрия — белое твёрдое вещество. Сильно гигроскопичен, на воздухе «расплывается», активно поглощая пары воды из воздуха. Хорошо растворяется в воде, при этом выделяется большое количество теплоты. Раствор едкого натра мылок на ощупь.
ΔH 0 растворения для бесконечно разбавленного водного раствора −44,45 кДж/моль.
Из водных растворов при +12,3…+61,8 °C кристаллизуется моногидрат (сингония ромбическая), температура плавления +65,1 °C; плотность 1,829 г/см³; ΔH 0 обр −425,6 кДж/моль), в интервале от −28 до −24 °C — гептагидрат, от −24 до −17,7 °C — пентагидрат, от −17,7 до −5,4 °C — тетрагидрат (α-модификация). Растворимость в метаноле 23,6 г/л (t = +28 °C), в этаноле 14,7 г/л (t = +28 °C). NaOH·3,5H2O (температура плавления +15,5 °C).
Видео:Опыты по химии. Получение гидроксида железа (III) и изучение его свойствСкачать

Химические свойства
Гидроксид натрия (едкая щёлочь) — сильное химическое основание (к сильным основаниям относят гидроксиды, молекулы которых полностью диссоциируют в воде), к ним относят гидроксиды щелочных и щёлочноземельных металлов подгрупп Iа и IIа периодической системы Д. И. Менделеева, KOH (едкое кали), Ba(OH)2 (едкий барит), LiOH, RbOH, CsOH, а также гидроксид одновалентного таллия TlOH. Щёлочность (основность) определяется валентностью металла, радиусом внешней электронной оболочки и электрохимической активностью: чем больше радиус электронной оболочки (увеличивается с порядковым номером), тем легче металл отдаёт электроны, и тем выше его электрохимическая активность и тем левее располагается элемент в электрохимическом ряду активности металлов, в котором за ноль принята активность водорода.
Водные растворы NaOH имеют сильную щелочную реакцию (pH 1%-раствора = 13,4). Основными методами определения щелочей в растворах являются реакции на гидроксид-ион (OH − ), (c фенолфталеином — малиновое окрашивание и метиловым оранжевым (метилоранжем) — жёлтое окрашивание). Чем больше гидроксид-ионов находится в растворе, тем сильнее щёлочь и тем интенсивнее окраска индикатора.
Гидроксид натрия вступает в следующие реакции:
с кислотами, амфотерными оксидами и гидроксидами
- c кислотами — с образованием солей и воды:
NaOH + HCl → NaCl + H2O NaOH + H2S → NaHS + H2O (кислая соль, при отношении 1:1) 2NaOH + H2S → Na2S + 2H2O (в избытке NaOH)
Общая реакция в ионном виде:
OH − + H + → H2O
- с амфотерными оксидами которые обладают как основными, так и кислотными свойствами, и способностью реагировать с щелочами, как с твёрдыми при сплавлении:
2NaOH + ZnO → ot Na2ZnO2 + H2O — при сплавлении 2NaOH + ZnO + H2O → Na2[Zn(OH)4] — в растворе с амфотерными гидроксидами NaOH + Al(OH)3 → ot NaAlO2 + 2H2O — при сплавлении 3NaOH + Al(OH)3 → Na3[Al(OH)6] — в растворе с солями в растворе: 2NaOH + CuSO4 → Cu(OH)2↓ + Na2SO4
Гидроксид натрия используется для осаждения гидроксидов металлов. К примеру, так получают гелеобразный гидроксид алюминия, действуя гидроксидом натрия на сульфат алюминия в водном растворе, при этом избегая избытка щёлочи и растворения осадка. Его и используют, в частности, для очистки воды от мелких взвесей.
например, с фосфором — с образованием гипофосфита натрия:
3S + 6NaOH → 2Na2S + Na2SO3 + 3H2O с галогенами 2NaOH + Cl2 → NaClO + NaCl + H2O (дисмутация хлора при комнатной температуре) 6NaOH + 3Cl2 → NaClO3 + 5NaCl + 3H2O (дисмутация хлора при нагревании раствора) с металлами
Гидроксид натрия вступает в реакцию с алюминием, цинком, титаном. Он не реагирует с железом и медью (металлами, которые имеют низкий электрохимический потенциал). Алюминий легко растворяется в едкой щёлочи с образованием хорошо растворимого комплекса — тетрагидроксоалюмината натрия и водорода:
Эта реакция использовалась в первой половине XX века в воздухоплавании: для заполнения водородом аэростатов и дирижаблей в полевых (в том числе боевых) условиях, так как данная реакция не требует источников электроэнергии, а исходные реагенты для неё могут легко транспортироваться.
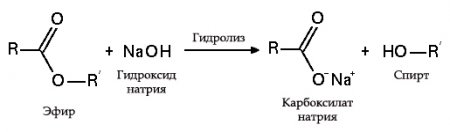
с эфирами, амидами и алкилгалогенидами (гидролиз):
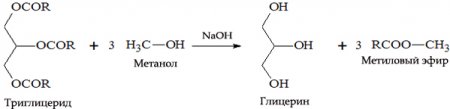
с жирами (омыление) такая реакция необратима, так как получающаяся кислота со щёлочью образует мыло и глицерин. Глицерин впоследствии извлекается из подмыльных щёлоков путём вакуум-выпарки и дополнительной дистилляционной очистки полученных продуктов. Этот способ получения мыла был известен на Ближнем Востоке с VII века.
В результате взаимодействия жиров с гидроксидом натрия получают твёрдые мыла (они используются для производства кускового мыла), а с гидроксидом калия либо твёрдые, либо жидкие мыла в зависимости от состава жира.
с многоатомными спиртами — с образованием алкоголятов: HOCH2CH2OH + 2NaOH → NaOCH2CH2ONa + 2H2O
Видео:Как сделать гидроксид натрияСкачать

Качественное определение ионов натрия
- По цвету пламени горелки — атомы натрия придают пламени жёлтую окраску
- С использованием специфических реакций на ионы натрия
| Реагент | Фторид аммония | Нитрит цезия-калия-висмута | Ацетат магния | Ацетат цинка | Пикро- | Ацетат уранила-цинка | ||
|---|---|---|---|---|---|---|---|---|
| Цвет осадка | белый | бледно-жёлтый | жёлто-зелёный | жёлто-зелёный | белый | белый | бледно-жёлтый | зеленовато-жёлтый |
Видео:Как получить Гидроксид Натрия??? NaOH 2 способа.Скачать

Методы получения
Гидроксид натрия может получаться в промышленности химическими и электрохимическими методами.
Химические методы получения гидроксида натрия
К химическим методам получения гидроксида натрия относятся пиролитический, известковый и ферритный.
Химические методы получения гидроксида натрия имеют существенные недостатки: расходуется большое количество энергоносителей, получаемый едкий натр сильно загрязнён примесями.
В настоящее время эти методы почти полностью вытеснены электрохимическими методами производства.
Пиролитический метод
Пиролитический метод получения гидроксида натрия является наиболее древним и начинается с получения оксида натрия Na2О путём прокаливания карбоната натрия при температуре 1000 °C (например, в муфельной печи):
В качестве сырья может быть использован и гидрокарбонат натрия, разлагающийся при 200 °C на карбонат натрия, углекислый газ и воду.
Полученный оксид натрия охлаждают и очень осторожно (реакция происходит с выделением большого количества тепла) добавляют в воду:
Известковый метод
Известковый метод получения гидроксида натрия заключается во взаимодействии раствора соды с гашеной известью при температуре около 80 °С. Этот процесс называется каустификацией и проходит по реакции:
В результате реакции получается раствор гидроксида натрия и осадок карбоната кальция. Карбонат кальция отделяется от раствора фильтрацией, затем раствор упаривается до получения расплавленного продукта, содержащего около 92 % масс. NaOH. Затем NaOH плавят и разливают в железные барабаны, где он кристаллизуется.
Ферритный метод
Ферритный метод получения гидроксида натрия состоит из двух этапов:
Реакция 1 представляет собой процесс спекания кальцинированной соды с окисью железа при температуре 1100—1200 °С. При этом образуется спек — феррит натрия и выделяется двуокись углерода. Далее спек обрабатывают (выщелачивают) водой по реакции 2; получается раствор гидроксида натрия и осадок Fe2O3*xH2O, который после отделения его от раствора возвращается в процесс. Получаемый раствор щёлочи содержит около 400 г/л NaOH. Его упаривают до получения продукта, содержащего около 92 % масс. NaOH, а затем получают твёрдый продукт в виде гранул или хлопьев.
Электрохимические методы получения гидроксида натрия
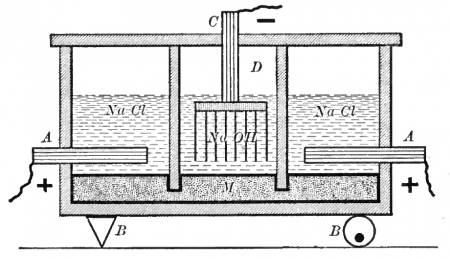
Электрохимически гидроксид натрия получают электролизом растворов галита (минерала, состоящего в основном из поваренной соли NaCl) с одновременным получением водорода и хлора. Этот процесс можно представить суммарной формулой:
Едкая щёлочь и хлор вырабатываются тремя электрохимическими методами. Два из них — электролиз с твёрдым катодом (диафрагменный и мембранный методы), третий — электролиз с жидким ртутным катодом (ртутный метод).
В мировой производственной практике используются все три метода получения хлора и каустика с явной тенденцией к увеличению доли мембранного электролиза.
| Показатель на 1 тонну NaOH | Ртутный метод | Диафрагменный метод | Мембранный метод |
|---|---|---|---|
| Выход хлора, % | 99 | 96 | 98,5 |
| Электроэнергия, кВт·ч | 3150 | 3260 | 2520 |
| Концентрация NaOH, % | 50 | 12 | 35 |
| Чистота хлора, % | 99,2 | 98 | 99,3 |
| Чистота водорода, % | 99,9 | 99,9 | 99,9 |
| Массовая доля O2 в хлоре, % | 0,1 | 1—2 | 0,3 |
| Массовая доля Cl − в NaOH, % | 0,003 | 1—1,2 | 0,005 |
В России приблизительно 35 % от всего выпускаемого каустика вырабатывается электролизом с ртутным катодом и 65 % — электролизом с твёрдым катодом.
Диафрагменный метод
Наиболее простым из электрохимических методов в плане организации процесса и конструкционных материалов для электролизера является диафрагменный метод получения гидроксида натрия.
Раствор соли в диафрагменном электролизере непрерывно подаётся в анодное пространство и протекает через, как правило, нанесённую на стальную катодную сетку асбестовую диафрагму, в которую иногда добавляют небольшое количество полимерных волокон.
Во многих конструкциях электролизеров катод полностью погружен под слой анолита (электролита из анодного пространства), а выделяющийся на катодной сетке водород отводится из под катода при помощи газоотводных труб, не проникая через диафрагму в анодное пространство благодаря противотоку.
Противоток — очень важная особенность устройства диафрагменного электролизера. Именно благодаря противоточному потоку, направленному из анодного пространства в катодное через пористую диафрагму, становится возможным раздельное получение щёлоков и хлора. Противоточный поток рассчитывается так, чтобы противодействовать диффузии и миграции OH — ионов в анодное пространство. Если величина противотока недостаточна, тогда в анодном пространстве в больших количествах начинает образовываться гипохлорит-ион (ClO — ), который затем может окисляться на аноде до хлорат-иона ClO3 — . Образование хлорат-иона серьёзно снижает выход по току хлора и является основным побочным процессом в этом методе получения гидроксида натрия. Также вредит и выделение кислорода, которое, к тому же, ведёт к разрушению анодов и, если они из углеродных материалов, попаданию в хлор примесей фосгена.
Анод: 2Cl − → Cl2 + 2e − — основной процесс 2H2O → O2 + 4H + + 4e − 6ClO3 − + 3H2O → 2ClO3 − + 4Cl − + 1,5O2↑ + 6H + + 6e − Катод: 2H2O + 2e − → H2↑ + 2OH − — основной процесс ClO − + H2O + 2e − → Cl − + 2OH − ClO3 − + 3H2O + 6e − → Cl − + 6OH −
В качестве анода в диафрагменных электролизерах может использоваться графитовый или угольный электроды. На сегодня их, в основном, заменили титановые аноды с окисно-рутениево-титановым покрытием (аноды ОРТА) или другие малорасходуемые.
На следующей стадии электролитический щёлок упаривают и доводят содержание в нём NaOH до товарной концентрации 42—50 % масс. в соответствии со стандартом.
Поваренная соль, сульфат натрия и другие примеси при повышении их концентрации в растворе выше их предела растворимости выпадают в осадок. Раствор едкой щёлочи декантируют от осадка и передают в качестве готового продукта на склад или продолжают стадию упаривания для получения твёрдого продукта, с последующим плавлением, чешуированием или грануляцией.
Обратную, то есть кристаллизовавшуюся в осадок, поваренную соль возвращают назад в процесс, приготавливая из неё так называемый обратный рассол. От неё, во избежание накапливания примесей в растворах, перед приготовлением обратного рассола отделяют примеси.
Убыль анолита восполняют добавкой свежего рассола, получаемого подземным выщелачиванием соляных пластов, минеральных рассолов типа бишофита, предварительно очищенного от примесей или растворением галита. Свежий рассол перед смешиванием его с обратным рассолом очищают от механических взвесей и значительной части ионов кальция и магния.
Полученный хлор отделяется от паров воды, компримируется и подаётся либо на производство хлорсодержащих продуктов, либо на сжижение.
Благодаря относительной простоте и дешевизне диафрагменный метод получения гидроксида натрия до сих пор широко используется в промышленности.
Мембранный метод
Мембранный метод производства гидроксида натрия наиболее энергоэффективен, однако сложен в организации и эксплуатации.
С точки зрения электрохимических процессов мембранный метод подобен диафрагменному, но анодное и катодное пространства полностью разделены непроницаемой для анионов катионообменной мембраной. Благодаря этому свойству становится возможным получение более чистых, чем в случае с диафрагменного метода, щелоков. Поэтому в мембранном электролизере, в отличие от диафрагменного, не один поток, а два.
В анодное пространство поступает, как и в диафрагменном методе, поток раствора соли. А в катодное — деионизированная вода. Из анодного пространства вытекает поток обеднённого анолита, содержащего также примеси гипохлорит- и хлорат-ионов и хлор, а из катодного — щёлока и водород, практически не содержащие примесей и близкие к товарной концентрации, что уменьшает затраты энергии на их упаривание и очистку.
Щёлочь, получаемая с помощью мембранного электролиза, практически не уступает по качеству получаемой при помощи метода с использованием ртутного катода и постепенно заменяет щёлочь, получаемую ртутным методом.
Однако, питающий раствор соли (как свежий, так и оборотный) и вода предварительно максимально очищается от любых примесей. Такая тщательная очистка объясняется высокой стоимостью полимерных катионообменных мембран и их уязвимостью к примесям в питающем растворе.
Кроме того, ограниченная геометрическая форма а также низкая механическая прочность и термическая стойкость ионообменных мембран во многом определяют сравнительно сложные конструкции установок мембранного электролиза. По той же причине мембранные установки требуют наиболее сложных систем автоматического контроля и управления.
Ртутный метод с жидким катодом
В ряду электрохимических методов получения щёлоков самым эффективным способом является электролиз с ртутным катодом. Щёлоки, полученные при электролизе с жидким ртутным катодом, значительно чище полученных диафрагменным способом (для некоторых производств это критично). Например, в производстве искусственных волокон можно применять только высокочистый каустик), а по сравнению с мембранным методом организация процесса при получении щёлочи ртутным методом гораздо проще.
Установка для ртутного электролиза состоит из электролизёра, разлагателя амальгамы и ртутного насоса, объединённых между собой ртутепроводящими коммуникациями.
Катодом электролизёра служит поток ртути, прокачиваемой насосом. Аноды — графитовые, угольные или малоизнашивающиеся (ОРТА, ТДМА или другие). Вместе с ртутью через электролизёр непрерывно течёт поток питающего поваренной соли.
На аноде происходит окисление ионов хлора из электролита, и выделяется хлор:
2Cl − → Cl2 + 2e − — основной процесс 2H2O → O2 + 4H + + 4e − 6ClO3 − + 3H2O → 2ClO3 − + 4Cl − + 1,5O2 + 6H + + 6e −
Хлор и анолит отводится из электролизёра. Анолит, выходящий из электролизёра, донасыщают свежим галитом, извлекают из него примеси, внесённые с ним, а также вымываемые из анодов и конструкционных материалов, и возвращают на электролиз. Перед донасыщением из анолита извлекают растворённый в нём хлор.
На катоде восстанавливаются ионы натрия, которые образуют слабый раствор натрия в ртути (амальгаму натрия):
Na + + e − → Hg NaHg
Амальгама непрерывно перетекает из электролизёра в разлагатель амальгамы. В разлагатель также непрерывно подаётся высоко очищенная вода. В нём амальгама натрия в результате самопроизвольного химического процесса почти полностью разлагается водой с образованием ртути, раствора каустика и водорода:
Полученный таким образом раствор каустика, являющийся товарным продуктом, практически не содержит примесей. Ртуть почти полностью освобождается от натрия и возвращается в электролизер. Водород отводится на очистку.
Растущие требования к экологической безопасности производств и дороговизна металлической ртути ведут к постепенному вытеснению ртутного метода методами получения щёлочи с твёрдым катодом, в особенности мембранным методом.
Лабораторные методы получения
В лаборатории гидроксид натрия иногда получают химическими способами, но чаще используется небольшой электролизёр диафрагменного или мембранного типа.
Видео:Задание №8 в ЕГЭ по химии | Саша Сильвер | ЕГЭ 2024 | SMITUPСкачать

Рынок каустической соды
В России, согласно ГОСТ 2263-79, производятся следующие марки натра едкого:
- ТР — твёрдый ртутный (чешуированный);
- ТД — твёрдый диафрагменный (плавленый);
- РР — раствор ртутный;
- РХ — раствор химический;
- РД — раствор диафрагменный.
| Наименование показателя | ТР ОКП 21 3211 0400 | ТД ОКП 21 3212 0200 | РР ОКП 21 3211 0100 | РХ 1 сорт ОКП 21 3221 0530 | РХ 2 сорт ОКП 21 3221 0540 | РД Высший сорт ОКП 21 3212 0320 | РД Первый сорт ОКП 21 3212 0330 |
|---|---|---|---|---|---|---|---|
| Внешний вид | Чешуированная масса белого цвета. Допускается слабая окраска | Плавленая масса белого цвета. Допускается слабая окраска | Бесцветная прозрачная жидкость | Бесцветная или окрашенная жидкость. Допускается выкристалл изованный осадок | Бесцветная или окрашенная жидкость. Допускается выкристалли зованный осадок | Бесцветная или окрашенная жидкость. Допускается выкристалли зованный осадок | Бесцветная или окрашенная жидкость. Допускается выкристалли зованный осадок |
| Массовая доля гидроксида натрия, %, не менее | 98,5 | 94,0 | 42,0 | 45,5 | 43,0 | 46,0 | 44,0 |
Видео:Самый *ПРОСТОЙ* способ ПОЛУЧИТЬ ГИДРОКСИД КАЛИЯСкачать

Применение
Едкий натр применяется во множестве отраслей промышленности и для бытовых нужд:
- Каустик применяется в целлюлозно-бумажной промышленности для делигнификации (сульфатный процесс) целлюлозы, в производстве бумаги, картона, искусственных волокон, древесно-волоконных плит.
- Для омыления жиров при производстве мыла, шампуня и других моющих средств. В древности во время стирки в воду добавляли золу, и, по-видимому, хозяйки обратили внимание, что если зола содержит жир, попавший в очаг во время приготовления пищи, то посуда хорошо моется. О профессии мыловара (сапонариуса) впервые упоминает примерно в 385 году нашей эры Теодор Присцианус. Арабы варили мыло из масел и соды с VII века, сегодня мыла производятся тем же способом, что и 10 веков назад. В настоящее время продукты на основе гидроксида натрия (с добавлением гидроксида калия), нагретые до +50…+60 °C, применяются в сфере промышленной мойки для очистки изделий из нержавеющей стали от жира и других масляных веществ, а также остатков механической обработки.
- В химических отраслях промышленности — для нейтрализации кислот и кислотных оксидов, как реагент или катализатор в химических реакциях, в химическом анализе для титрования, для травления алюминия и в производстве чистых металлов, в нефтепереработке — для производства масел.
- Для изготовления биодизельного топлива — получаемого из растительных масел и используемого для замены обычного дизельного топлива. Для получения биодизеля к девяти массовым единицам растительного масла добавляется одна массовая единица спирта (то есть соблюдается соотношение 9:1), а также щелочной катализатор (NaOH). Полученный эфир (главным образом линолевой кислоты) отличается хорошей воспламеняемостью, обеспечиваемой высоким цетановым числом. Цетановое число — условная количественная характеристика самовоспламеняемости дизельных топлив в цилиндре двигателя (аналог октанового числа для бензинов). Если для минерального дизтоплива характерен показатель в 50-52 %, то метиловый эфир уже изначально соответствует 56-58 % цетана. Сырьём для производства биодизеля могут быть различные растительные масла: рапсовое, соевое и другие, кроме тех, в составе которых высокое содержание пальмитиновой кислоты (пальмовое масло). При его производстве в процессе этерификации также образуется глицерин, который используется в пищевой, косметической и бумажной промышленности, либо перерабатывается в эпихлоргидрин по методу Solvay.
- В качестве агента для растворения засоров канализационных труб, в виде сухих гранул или в составе гелей (наряду с гидроксидом калия). Гидроксид натрия дезагрегирует засор и способствует лёгкому продвижению его далее по трубе.
- В гражданской обороне для дегазации и нейтрализации отравляющих веществ, в том числе зарина, в ребризерах (изолирующих дыхательных аппаратах (ИДА), для очистки выдыхаемого воздуха от углекислого газа.
- В текстильной промышленности — для мерсеризации хлопка и шерсти. При кратковременной обработке едким натром с последующей промывкой волокно приобретает прочность и шелковистый блеск.
- Гидроксид натрия также используется для мойки пресс-форм автопокрышек.
- В приготовлении пищи: для мытья и очистки фруктов и овощей от кожицы, в производстве шоколада и какао, напитков, мороженого, окрашивания карамели, для размягчения маслин и придания им чёрной окраски, при производстве хлебобулочных изделий. Зарегистрирован в качестве пищевой добавки E-524. Некоторые блюда готовятся с применением каустика:
- лютефиск — скандинавское блюдо из рыбы — сушёная треска вымачивается 5-6 дней в едкой щёлочи и приобретает мягкую, желеобразную консистенцию.
- брецель — немецкие крендели — перед выпечкой их обрабатывают в растворе едкой щёлочи, которая способствует образованию уникальной хрустящей корочки.
- В косметологии для удаления ороговевших участков кожи, бородавок, папиллом.
- В фотографии — как ускоряющее вещество в проявителях для высокоскоростной обработки фотографических материалов.
Видео:Взаимодействие уксусной кислоты с гидроксидом натрияСкачать

Меры предосторожности при обращении с гидроксидом натрия
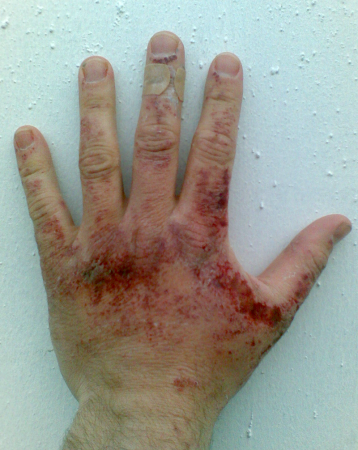
Гидроксид натрия — едкое, токсическое и коррозионно-активное вещество. Оно относится к веществам второго класса опасности. Поэтому при работе с ним требуется соблюдать осторожность. При попадании на кожу, слизистые оболочки и в глаза образуются серьёзные химические ожоги. Попадание в глаза вызывает необратимые изменения зрительного нерва (атрофию) и, как следствие, потерю зрения. При контакте слизистых поверхностей с едкой щёлочью необходимо промыть поражённый участок струёй воды, а при попадании на кожу — слабым раствором уксусной или борной кислоты. При попадании едкого натра в глаза следует немедленно промыть их сначала слабым раствором борной кислоты, а затем водой.
При работе с едким натром рекомендуется следующие защитные средства: химические брызгозащитные очки для защиты глаз, резиновые перчатки или перчатки с прорезиненной поверхностью для защиты рук, для защиты тела — химически стойкая одежда, пропитанная винилом или прорезиненные костюмы.
Предельно допустимая концентрация гидроксида натрия в воздухе 0,5 мг/м³.
🌟 Видео
Опыты по химии. Получение гидроксида меди (II) и изучение его свойствСкачать

Реакция СЕРЫ и ГИДРОКСИДА НАТРИЯ. S + NaOH. Получение СУЛЬФИДА НАТРИЯ. Опыты по химии. ЭкспериментыСкачать

Реакция сульфата меди II ( медный купорос) с гидроксидом натрия ( щелочами)Скачать

Получение сильной щёлочи. Едкий натрий для восстановления золота.Скачать

СОЛИ ХИМИЯ 8 КЛАСС: Химические Свойства Солей и Получение // Реакция Солей с Кислотами и МеталламиСкачать

Al(OH)3 + NaOH → Na[Al(OH)4] | Получение гидроксида алюминия и растворение его в избытке щёлочиСкачать
![Al(OH)3 + NaOH → Na[Al(OH)4] | Получение гидроксида алюминия и растворение его в избытке щёлочи](https://i.ytimg.com/vi/_u6eAdWg96A/0.jpg)
Опыты по химии. Амфотерность гидроксида цинкаСкачать

КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать