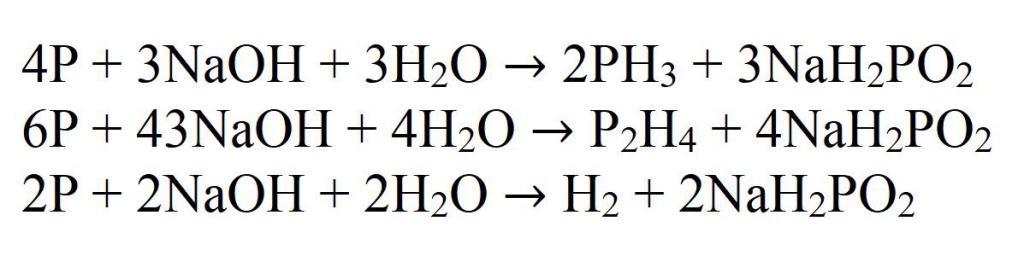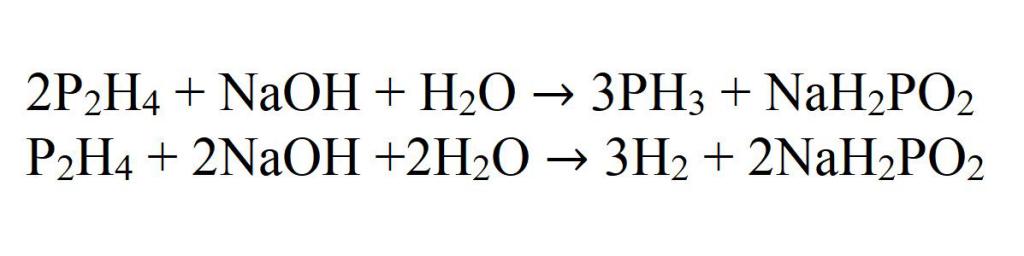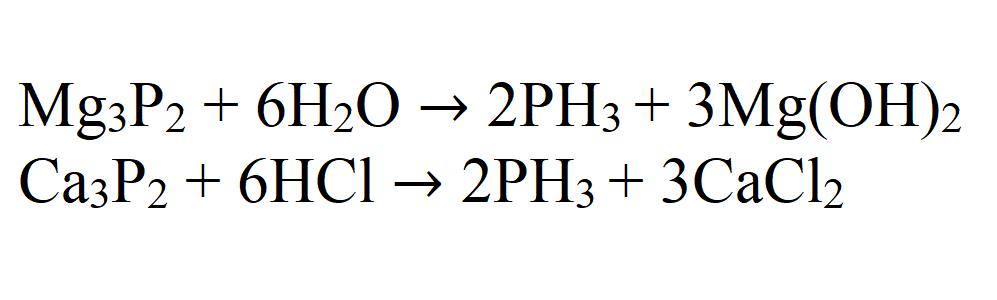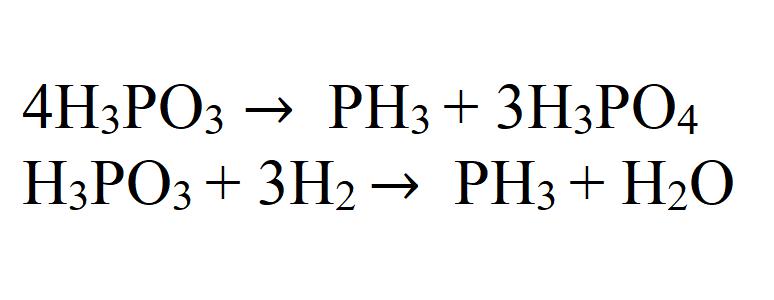- Фосфин
- Строение молекулы и физические свойства
- Способы получения фосфина
- Химические свойства фосфина
- Фосфин: формула, получение, физические и химические свойства
- Получение
- Физические свойства
- Химические свойства
- Применение
- Токсикология
- Соединения фосфора
- Фосфин (PH3)
- Фосфиды
- Оксид фосфора (III), триоксид фосфора (P2O3)
- Оксид фосфора (V), пентаоксид фосфора, фосфорный ангидрид (Р2О5)
- Фосфорные кислоты
- Фосфористая кислота ( H3PO3)
- Соли фосфористой кислоты (Фосфиты)
- Ортофосфорная кислота, фосфорная кислота (Н3РO4)
- Соли ортофосфорной кислоты (ортофосфаты, фосфаты)
- Фосфорные удобрения
- 🎬 Видео
Фосфин
Строение молекулы и физические свойства
Фосфин PH3 – это бинарное соединение водорода с фосфором, относится к летучим водородным соединениям. Следовательно, фосфин газ, с неприятным запахом, бесцветный, мало растворимый в воде, химически нестойкий и ядовитый. Водородные связи между молекулами фосфина не образуются. В твердом состоянии имеет молекулярную кристаллическую решетку.
Геометрическая форма молекулы фосфина похожа на структуру аммиака — правильная треугольная пирамида. Но валентный угол H-P-H меньше, чем угол H-N-H в аммиаке и составляет 93,5 о .
У атома фосфора в фосфине на внешнем энергетическом уровне остается неподеленная электронная пара. Эта электронная пара оказывает значительное влияние на свойства фосфина, а также на его структуру. Электронная структура фосфина — тетраэдр , с атомом фосфора в центре.
Способы получения фосфина
В лаборатории фосфин получают водным или кислотным гидролизом фосфидов – бинарных соединений фосфора и металлов.
Например , фосфин образуется при водном гидролизе фосфида кальция:
Или при кислотном гидролизе, например , фосфида магния в соляной кислоте:
Еще один лабораторный способ получения фосфина – диспропорционирование фосфора в щелочах.
Например , фосфор реагирует с гидроксидом калия с образованием гипофосфита калия и фосфина:
Химические свойства фосфина
1. В водном растворе фосфин проявляет очень слабые основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион фосфония. Основные свойства фосфина гораздо слабее основных свойств аммиака. Проявляются при взаимодействии с безводными кислотами .
Например , фосфин реагирует с йодоводородной кислотой:
Соли фосфония неустойчивые, легко гидролизуются.
2. Фосфин PH3 – сильный восстановитель за счет фосфора в степени окисления -3. На воздухе самопроизвольно самовоспламеняется:
3. Как сильный восстановитель, фосфин легко окисляется под действием окислителей.
Например , азотная кислота окисляет фосфин. При этом фосфор переходит в степень окисления +5 и образует фосфорную кислоту.
Серная кислота также окисляет фосфин:
С фосфином также реагируют другие соединения фосфора, с более высокими степенями окисления фосфора.
Например , хлорид фосфора (III) окисляет фосфин:
2PH3 + 2PCl3 → 4P + 6HCl
Видео:Фосфин - PH3. Реакция Фосфида Кальция И Соляной Кислоты. Получение Фосфида Кальция.Скачать

Фосфин: формула, получение, физические и химические свойства
Фосфин — это ядовитый газ, который в чистом виде не имеет цвета и запаха. С химической точки зрения, является летучим водородным соединениям фосфора. В химии формула фосфина имеет вид — PH3. По своим свойствам имеет некоторые схожести с аммиаком. Вещество очень опасно, так как имеет высокую токсичность и склонность к самовоспламенению.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Получение
Самый хорошо изученный способ получения фосфина — это реакция взаимодействия белого фосфора с раствором сильной щелочи при нагревании. В данном случае фосфор диспропорционирует на метафосфат и фосфин. Побочными продуктами этой реакции является дифосфин (P2H4) и водород, поэтому выход данной реакции небольшой и составляет не более 40 %.
Образующийся дифосфин в реакционной среде вступает во взаимодействие со щелочью, в результате чего образуется фосфин и водород.
А полученный в этих реакциях гипофосфит, при взаимодействии со щелочью, переходит в фосфат с выделением водорода.
После завершения всех реакций, в результате взаимодействия щелочи на фосфор образуется фосфин, водород и фосфат. Данный способ получения можно также провести со щелочными оксидами вместо щелочей. Этот опыт является очень красивым, так как образующийся дифосфин сразу же воспламеняется и сгорает в виде искр, образуя нечто похожее на фейерверк.
При воздействии воды или кислоты на фосфиды металлов также получается фосфин.
При термическом разложении фосфористой кислоты или ее восстановлении водородом в момент выделения также образуется фосфин.
Соли фосфония при разложении или в реакции с некоторыми веществами дают фосфин.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Физические свойства
Фосфин представляет собой бесцветный газ без запаха. Но технический фосфин (с некоторыми примесями) может иметь характерный неприятный запах, который описывают по-разному. Немного тяжелее воздуха, при температуре -87,42 °C сжижается, а при -133,8 °C становится твердым веществом. Такие низкие температуры кипения и плавления обусловлены довольно слабыми водородными связями. Вещество практически нерастворимо в воде, но при определенных условиях образует с водой неустойчивые гидраты. Хорошо растворим в этаноле и диэтиловом эфире. Плотность фосфина при нормальных условиях составляет 0,00153 г/см 3 .
Видео:Фосфин. Состав, строение, свойства, получениеСкачать

Химические свойства
Как уже было сказано, химическая формула фосфина — PH3. Хоть фосфин и похож на аммиак, он имеет ряд отличий во взаимодействиях с другими веществами. Эти особенности обусловлены тем, что химические связи в фосфине (по формуле это становится ясно) ковалентные слабополярные. Они менее полярные, чем в аммиаке, и поэтому более прочные.
При сильном нагревании (примерно 450 °C) без доступа кислорода фосфин разлагается на простые вещества.
При температуре свыше 100 °C PH3 самовоспламеняется, вступая в реакцию с кислородом воздуха. Температурный порог можно снизить ультрафиолетовым светом. По этой причине, выделяющийся на болотах фосфин, часто самовоспламеняется, вызывая появление так называемых «блуждающих огней».
Но может происходить и простое горение. Тогда образуется фосфорный ангидрид и вода.
Как и аммиак, фосфин может образовывать соли, взаимодействуя с галогеноводородами.
Исходя из формулы фосфина, можно сказать, что фосфор в нем имеет низшую степень окисления. По этой причине он является хорошим восстановителем.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Применение
Ввиду своей высокой токсичности, фосфин нашел применение в фумигации, т. е. уничтожении различного рода вредителей (насекомых, грызунов) при помощи газа. Для этих процедур существуют специальные устройства — машины-фумигаторы, с использованием которых распыляют газ в помещениях. Обычно фосфином или препаратами на его основе обрабатывают склады зерновых культур, готовых пищевых продуктов, мебели, а также библиотеки, заводские помещения, вагоны поездов и другой транспорт. Преимущество такой обработки в том, что фосфин даже в небольших концентрациях легко проникает в труднодоступные места и никак не взаимодействует с металлами, древесиной и тканью.
Помещение обрабатывают фосфином, в герметичном состоянии его держат в течение 5-7 суток. После этого не менее двух суток нужно осуществлять проветривание, иначе находится человеку в нем опасно. После этого фосфин не оставляет никаких следов даже на продуктах, зерне и других товарах.
Еще фосфин используется в синтезе некоторых веществ, особенно органических. Также из него может получаться химически чистый фосфор, с использованием фосфина производят легирование полупроводников.
Видео:Фосфин. Строение, получение, основные свойства | ХимияСкачать

Токсикология
Фосфин крайне токсичное соединение. Он быстро проходит через дыхательные пути и взаимодействует со слизистыми оболочками организма. Это может вызвать нарушения работы нервной системы, а также обмена веществ в целом. Признаками отравления могут служить головокружение, тошнота, рвота, головная боль, усталость, иногда даже конвульсии. В тяжелых случаях отправления человек может потерять сознание или произойти остановка дыхания и сердцебиения. Предельно допустимая концентрация фосфина в воздухе — 0.1 мг/м 3 . Концентрация 10 мг/м 3 сразу приводит к летальному исходу.
Первое, что необходимо сделать с пострадавшим от отравления фосфина, — вынести на свежий воздух и освободить от загрязненной одежды. Также рекомендуется окатить пострадавшего водой, чтобы быстрее убрать остатки токсичного газа. Стационарное лечение подразумевает использование кислородной маски, контроль сердечного ритма и состояния печени, лечение отека легких. За больным необходимо следить минимум 2-3 суток, даже если видимых признаков отравления уже нет. Некоторые симптомы могут проявляться лишь через несколько суток после контакта с фосфином.
Видео:Химия 9 класс : ФосфинСкачать

Соединения фосфора
Видео:Фосфор и его соединения: химические свойства #фосфор #химшкола #неметаллы #егэхимияСкачать

Фосфин (PH3)
Способы получения фосфина
Прямым синтезом PH3 получить нельзя.
- Фосфин получают путем водного или кислотного гидролиза фосфидов:
- Реакция диспропорционирования фосфора в щелочах:
- Разложение солей фосфония (Температура выше 80ºС):
Физические свойства фосфина
При нормальной температуре фосфин является бесцветным газом с резким чесночным запахом. В воде малорастворим, хорошо растворим в органических растворителях
Фосфин — Яд!
Химические свойства фосфина
- PH3не реагирует с водой, щелочами, аммиаком.
PH3 — Проявляет свойства сильного восстановителя.
- Вступает в реакции с кислотами – окислителями:
- С безводными кислотами образует соли:
- Окисляется кислородом. При Т
Практического значения фосфин не имеет.
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Фосфиды
Способы получения
Взаимодействие фосфора с металлами:
Физические свойства, строение фосфидов
Фосфиды – представляют собой продукты взаимодействия фосфора с металлами.
Фосфиды щелочных и щелочноземельных металлов имеют ионное строение.
Химические свойства фосфидов
Фосфиды крайне неустойчивы и легко подвергаются необратимому гидролизу с образованием РН3:
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Оксид фосфора (III), триоксид фосфора (P2O3)
Способы получения оксида фосфора (III)
- Р2О3 образуется при горении фосфора в недостатке кислорода или его медленном окислении:
Физические свойства оксида фосфора (III)
При комнатной температуре Р2О3 — белая воскообразная масса с неприятным запахом. Легко испаряется, его Тпл = 23,5°С
Пары существует в виде димеров Р4О6.
!Очень ядовит
Химические свойства оксида фосфора (III)
- Р2О3 как кислотный оксид при взаимодействии с водой образует фосфористую кислоту:
- Реакция диспропорционирования происходит очень бурно при растворении Р2О3в горячей воде:
- При взаимодействии Р2О3с щелочами образуются соли фосфористой кислоты:
- При взаимодействии с окислителями P2O3 проявляет восстановительные свойства:
Окисление кислородом воздуха:
Окисление галогенами:
Видео:Химия 9 класс (Урок№16 - Фосфор. Аллотропия фосфора. Свойства фосфора. Оксид фосфора(V).)Скачать

Оксид фосфора (V), пентаоксид фосфора, фосфорный ангидрид (Р2О5)
Способы получения фосфорного ангидрида
Сжигание фосфора в избытке воздуха:
Физические свойства фосфорного ангидрида
При комнатной температуре Р2О5 — белые стеклообразные хлопья без запаха. Существует в виде димеров Р4О10.
Очень гигроскопична, при соприкосновении с воздухом расплывается в сиропообразную жидкость (НРO3). Р2О5 — самое эффективное осушающее средство и водоотнимающий агент. Применяется для осушения нелетучих веществ и газов.
Химические свойства фосфорного ангидрида
Р2О5 проявляет кислотные свойства.
Как кислотный оксид Р2О5 взаимодействует:
- с водой, с образованием различных кислот:
- с основными оксидами, с образованием фосфатов
- с щелочами, с образованием средних и кислых солей
- Фосфорный ангидрид способен отнимать у других веществ не только гигроскопическую влагу, но и химически связанную воду. Например, он дегидратирует оксокислоты, что широко используется для получения ангидридов кислот:
Видео:ФосфинСкачать

Фосфорные кислоты
Фосфор образует только 2 устойчивых оксида, в которых он находится в степенях окисления +5 и +3. Однако существует большое число кислот, в которых фосфор имеет валентность равную V (пять ковалентных связей) и степени окисления +5, +4, +3, +1.
Строение наиболее известных кислот выражается следующими формулами:
Наибольшее практическое значение имеют ортофосфорная (фосфорная) и ортофосфористая (фосфористая) кислоты.
Видео:Получение и свойства фосфина / Obtaining and properties of phosphineСкачать

Фосфористая кислота ( H3PO3)
Способы получения фосфористой кислоты
- Гидролиз галогенидов фосфора (III):
- Окисление белого фосфора хлором:
Физические свойства, строение фосфористой кислоты
Для молекулы фосфористой кислоты H3PO3 известны 2 таутомерные формы. В одной из них 2 атома водорода молекулы связаны с кислородом, а один атом водорода связан непосредственно с атомом фосфора. Такой атом водорода не может быть замещен атомами металлов, поэтому кислота является двухосновной.
В другой таутомерной форме – все три атома водорода связаны с кислородом.
Формула фосфористой кислоты выглядит следующим образом: Н2[НРО3]
При комнатной температуре H3PO3 – кристаллическое вещество без цвета, хорошо растворимое в воде, Тпл = 74°С.
Валентность фосфора в фосфористой кислота равна V, а степень окисления +3.
Химические свойства фосфористой кислоты
Является слабой кислотой.
- Для нее характерны все свойства кислот — взаимодействие с металлами с выделением Н2; с оксидами металлов и с щелочами. При этом образуются одно — или двухзамещенные фосфиты:
- Кислота является и окислителем и восстановителем, при нагревании вступая в реакции диспропорционирования:
Кислота и ее соли являются сильными восстановителями:
- Реагируют с сильными окислителями:
- Реагируют с более слабыми окислителями:
- В реакции с сильными восстановителями, например, с щелочными и щелочно-земельными металлами, цинковой пылью, кислота восстанавливается до фосфина:
- При нагревании водного раствора Н3РO3окисляется до H3PO4 с выделением водорода:
Видео:Получение и свойства фосфина / Synthesis and properties of phosphineСкачать

Соли фосфористой кислоты (Фосфиты)
Способы получения фосфитов
- Взаимодействие фосфористой кислоты с щелочами:
- взаимодействие фосфористой кислоты с металлами с выделением Н2
- взаимодействие фосфористой кислоты с оксидами металлов
- диспропорционирование фосфора в горячем, концентрированном растворе щелочи:
- Взаимодействие трихлорида фосфора с разбавленным раствором щелочи:
Физические свойства фосфитов
Двухосновная фосфористая кислота образует два типа солей:
а) однозамещенные фосфиты (кислые соли), в молекулах которых атомы металлов связаны с анионами Н2РО3, например: NaH2PO3, Са(H2PO3)
б) двухзамещенные фосфиты (средние соли), в молекулах которых атомы металлов связаны с 2 или 1 анионом HPO3, например: Na2HPO3, СаHPO3.
Хорошо растворимы в воде только фосфиты щелочных металлов и кальция, остальные фосфиты плохо растворимы.
Химические свойства фосфитов
Имеют химические свойства, характерные для солей
Видео:Реакции металлов с кислородом и водой. 8 класс.Скачать

Ортофосфорная кислота, фосфорная кислота (Н3РO4)
Способы получения фосфорной кислоты
В промышленности Н3РO4 получают двумя способами:
- Разложением природного соединения – фосфата кальция Са3(РO4)2 серной кислотой:
- Доменный (термический) 3х-стадийный способ:
1 стадия — восстановление природных фосфоритов коксом
2 стадия – окисление получающихся паров свободного фосфора кислородом воздуха
3 стадия – орошение водой получающейся окиси фосфора:
Лабораторный способ
- Н3РO4 получают окислением фосфора азотной кислотой:
- Взаимодействием фосфорного ангидрида с водой:
Физические свойства, строение фосфорной кислоты
При обычной температуре безводная Н3РO4 – прозрачное, легкоплавкое (Тпл = 42°С) кристаллическое вещество. Н3РO4 -очень гигроскопичное вещество и смешивается с водой в любых соотношениях. Н3РO4 с небольшим количеством воды образует сиропообразную, вязкую жидкость.
Степень окисления фосфора в фосфорной кислоте равна +5, валентность равна V.
При нагревании орто-фосфорной кислоты выше +213 °C, она переходит в пирофосфорную H4P2O7.
При нагревании выше 700°С переходит в метафосфорную кислоту HPO3:
Качественные реакции для обнаружения фосфат-иона
Для обнаружения анионов фосфорной кислоты используют раствор AgNO3, при помощи которого также можно различить мета-, пиро- и ортофосфорные кислоты друг от друга.
При добавлении AgNO3 к кислотам образуются осадки различного цвета:
- метафосфат серебра AgPO3— белый
- пирофосфат серебра Ag4P2O7 – также белый, но он не свертывает яичного белка
- ортофосфат серебра Ag3PO4— желтый:
Химические свойства фосфорной кислоты
Фосфорная кислота H3PO4 – это электролит средней силы и представляет собой трехосновную кислоту.
Диссоциация протекает в основном по 1-й ступени:
По 2-й и 3-й ступеням диссоциация протекает в ничтожно малой степени:
- Н3РO4 проявляет все общие свойства кислот — взаимодействует с активными металлами:
- с основными оксидами:
- с основаниями образует три ряда солей – одно-, двух- и трехзамещенные (кислые и средние соли):
- с аммиаком образует соли аммония:
- Вытесняет более слабые кислоты из их солей (карбонатов, сульфидов и др.). Также вступает в обменные реакции с солями:
- При нагревании H3PO4 выше 200°С происходит отщепление молекулы воды с образованием пирофосфорной кислотыH2P2O7:
В отличие от аниона NO3 — в азотной кислоте, анион РO4 3- окисляющим действием не обладает.
Видео:Ответ подписчикам. Уравнения химических ркакцийСкачать

Соли ортофосфорной кислоты (ортофосфаты, фосфаты)
Способы получения фосфатов
Получают кислоты с металлами, оксидами металлов, гидроксидами (см. Химические свойства ортофосфорной кислоты)
Физические свойства фосфатов
Н3РO4 является 3х-основной кислотой, поэтому образует 3 типа солей:
| Анион соли | Название | Растворимость в воде | Примеры солей |
| PO4 3- | Фосфат (ортофосфат) | большинство нерастворимы (кроме фосфатов щелочных металлов и аммония) | Na3РO4; Са3(РO4)2 |
| HPO4 2- | Гидрофосфат | растворимы | Na2НРO4; СаНРО4 |
| Н2РO4 — | Дигидрофосфат | очень хорошо растворимы | NaH2PO4; Са(Н2РO4)2 |
Химические свойства фосфатов
- Имеют свойства, характерные для солей.
- Соли щелочных металлов подвержены гидролизу:
- Характерная особенность ортофосфатов – отношение к прокаливанию: однозамещенные соли переходят в метафосфаты, двухзамещенные – в пирофосфаты, из трехзамещенных изменяются только соли аммония:
Фосфорные удобрения
Фосфаты и гидрофосфаты кальция и аммония используются в качестве фосфорных удобрений.
При достаточном количестве фосфора растения быстро растут и хорошо плодоносят. Внесение фосфорных удобрений благоприятствует росту корневой системы растения и повышению урожайности. В связи с этим такие удобрения важны при выращивании овощных, зерновых и плодово-ягодных культур.
В таблице ниже приведены основные виды фосфорных удобрений.
Категории V группа (азот, фосфор), НЕОРГАНИЧЕСКАЯ ХИМИЯ
🎬 Видео
Получение и самовоспламенение фосфина. Химический опытСкачать

Фосфор. Химические свойстваСкачать

Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать

8 класс. Химия. Как расставить коэффициенты в уравнении?Скачать