материал для подготовки к егэ (гиа) по химии (11 класс) на тему
«Марганец и его соединения» одна из сложных тем для выпускников, вопросы по которой очень часто встречаются в ЕГЭ и на базовом, и на повышенном уровнях.
В матераиале дается краткое теоретическое введение, затем задания для самостоятельной работы, которые можно использовать и как проверочные вопросы при подготовке к итоговой аттестации.
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Скачать:
| Вложение | Размер |
|---|---|
| Задания для самостоятельной работы по теме «Марганец и его соединения» при подготовке к ЕГЭ | 22.16 КБ |
Видео:ВАЛЕНТНОСТЬ. Графические формулы веществ | Химия | TutorOnlineСкачать

Предварительный просмотр:
Марганец является элементом побочной подгруппы VII группы. Это
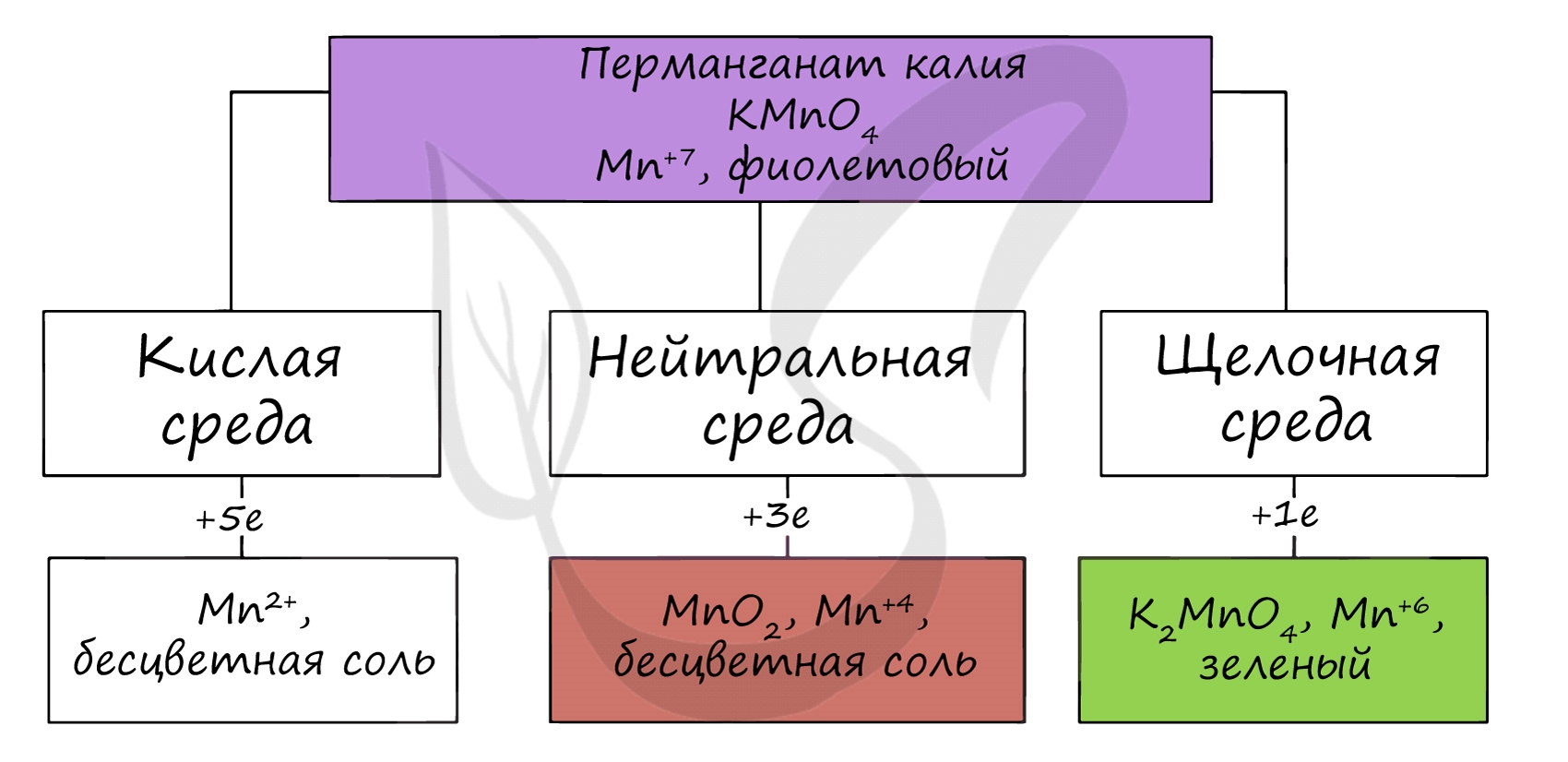
d — металл. Электронная структура внешнего энергетического уровня его атома выражается формулой 3d 5 4s 2 . Типичные степени окисления марганца + 2, +4, +7, менее свойственные +3, +6. Для химии марганца очень характерны окислительно-восстановительные реакции. При этом в кислой среде для марганца устойчива степень окисления + 2, в сильнощелочной +6, в нейтральной +4.
В соответствии с возможными степенями окисления марганец образует оксиды: Mn +2 O, Mn 2 +3 O 3 , Mn +4 O 2 , Mn +6 O 3 , Mn 2 +7 O 7
С повышением степени окисления марганца ослабевают основные и усиливаются кислотные свойства оксидов и гидроксидов. MnO и Mn 2 O 3 и соответствующие им гидроксиды Mn(OH) 2 и Mn(OH) 3 имеют основной характер. Нерастворимый в воде Mn(OH) 2 на воздухе вследствие окисления кислородом постепенно переходит в бурый Mn(OH) 3 :
4Mn(OH) 2 + O 2 + 2H 2 O = 4Mn(OH) 3
Окончательным продуктом окисления является коричневый оксид- гидроксид марганца:
4Mn(OH) 3 + O 2 + 2H 2 O = 4Mn(OH) 4 = 4MnO(OH) 2 + 4H 2 O
Соли марганца (II) и их концентрированные растворы обычно окрашены в светло-розовый цвет. Соединения марганца (II) – восстановители.
Оксид марганца (IV) MnO 2 – темно-бурое нерастворимое в воде вещество, наиболее устойчивое кислородное соединение марганца при обычных условиях. Обладает слабо выраженными амфотерными свойствами. С концентрированной H 2 SO 4 он дает крайне неустойчивую соль Mn(SO 4 ) 2 , а при сплавлении со щелочами образует манганиты:
MnO 2 + 2KOH = K 2 MnO 3 + H 2 O.
MnO 2 − сильный окислитель, при этом он восстанавливается до солей марганца (II): MnO 2 + 4HCl = MnCl 2 + Cl 2 + 2H 2 O.
Действием более сильных окислителей MnO 2 может быть окислен до соединений Mn (VI), Mn (VII):
2MnO 2 + 4KOH + O 2 = 2K 2 MnO 4 + 2H 2 O.
K 2 MnO 4 − манганат калия, соль не выделенной в свободном состоянии марганцовистой кислоты H 2 MnO 4 . Не получен и оксид Mn (VI) – MnO 3 . Растворы манганатов окрашены в темно-зеленый цвет, присущий ионам MnO 4 2− . Они устойчивы только в сильнощелочной среде, при разбавлении раствора водой манганаты диспропорционируют:
3K 2 MnO 4 + 2H 2 O = 2КMnO 4 + MnO 2 + 4KOH.
Все производные Mn (VI) являются окислителями, особенно в кислой среде. Однако при действии более сильных окислителей они превращаются в соединения марганца (VII): K 2 MnO4 + Сl 2 = 2КMnO 4 + 2KCl.
Оксид марганца (VII) Mn 2 O 7 – зеленовато-черная жидкость, сильный окислитель. Растворим в воде. Отвечающая ему марганцовая кислота HMnO 4 известна только в растворах. Эти растворы, а также растворы ее солей (перманганаты), окрашены в фиолетово-малиновый цвет, характерный для иона (MnO 4 ) − . При нагревании перманганаты разлагаются с выделением кислорода: 2КMnO 4 = K 2 MnO 4 + MnO 2 + O 2 .
Производные Mn (VII) – сильные окислители. В кислой среде они восстанавливаются до солей марганца (II), в нейтральной, а также в слабокислой и слабощелочной – до MnO 2 , в сильнощелочной до манганатов, которые затем постепенно переходят в соединения Mn (IV).
Задачи и упражнения для самостоятельного решения
1 . Как получить сульфат марганца (II) из: а) оксида марганца (II);
б) металлического марганца;
Составить соответствующие уравнения реакций.
2 . Какая масса перманганата калия потребуется для окисления 7,6 г FeSO 4 в
кислой среде? ( Ответ : 1,58 г).
3 . Расставить коэффициенты в уравнении реакции:
KMnO 4 + PH 3 + H 2 SO 4 = H 3 PO 4 + ….
Какая масса H 3 PO 4 образуется, если в реакции участвовало 17 г PH 3 ?
4 . Под действием HNO 3 манганаты диспропорционируют следующим
образом: 3K 2 MnO 4 + 4HNO 3 = 2KMnO 4 + MnO 2 + 4KNO 3 + 2H 2 O.
Какой объем раствора HNO 3 (ρ = 1,185 г/мл) с массовой долей 30 % необходим для получения 9,48 г перманганата калия? ( Ответ : 21,3 мл).
5 . Как получить соединения марганца (VI) из соединений с более высокой и с более низкой степенью окисления? Составить соответствующие уравнения реакций.
6 . Окисление сульфата железа (II) перманганатом калия в нейтральной среде
протекает по уравнению KMnO 4 + FeSO 4 + Н 2 О = FeОНSO 4 + ….
Какая масса перманганата калия потребуется для окисления 7,6 г FeSO 4 ?
7 . Закончить уравнения реакций: а) MnO + H 2 SO 4 = …;
б) Mn 2 O 7 + KOH = …;
в) MnSO 4 + KClO 3 + KOH = сплавление K 2 MnO 4 + ….
8 . Закончить уравнения реакций, в которых соединения марганца проявляют свойства: а) окислительные Fe(OH) 2 + KMnO 4 + H 2 O = …;
б) восстановительные MnSO 4 + PbO 2 + HNO 3 = …;
в) окислительные и восстановительные одновременно K 2 MnO 4 + H 2 O = ….
9 . Почему оксид марганца (IV) может проявлять и окислительные и
восстановительные свойства? Закончить уравнения реакций:
а) MnO 2 + KI + H 2 SO 4 = …;
б) MnO 2 + KNO 3 + KOH = ….
10 . Как меняется степень окисления марганца при восстановлении KMnO 4 в кислой, щелочной и нейтральной среде? Закончить уравнения реакций:
а) KMnO 4 + К 2 SO 3 + H 2 SO 4 = …;
б) KMnO 4 + К 2 SO 3 + КОН = …;
в) KMnO 4 + К 2 SO 3 + H 2 O = ….
11 . Восстановление перманганата калия сульфатом железа (II) в кислой
среде протекает по уравнению KMnO 4 + FeSO 4 + H 2 SO 4 =….
На восстановление KMnO 4 израсходовано 47 мл 0,208 н. раствора FeSO 4 . Какая масса KMnO 4 содержалось в исходном растворе? ( Ответ : 0,154 г).
12 . Закончить уравнения реакций: а) Mn + H 2 SO 4 (разб.) = …;
в) MnCl 2 + H 2 O ↔ …;
г) Mn + HNO 3 (разб.) = ….
13 . Окисление сульфата железа (II) перманганатом калия в щелочной среде протекает по уравнению KM nO 4 + FeSO 4 + КОН = FeОНSO 4 + ….
Какая масса перманганата калия потребуется для окисления 7,6 г FeSO 4 ?
14 . Как можно перевести в растворимое состояние марганец? Составить
соответствующие уравнения реакций.
15 . Закончить уравнения реакций: NaNO 2 + KMnO 4 + H 2 SO 4 = ….
16 . Закончить уравнения реакций: а) KMnO 4 + H 2 SO 4 (конц.) = …;
б) Mn 2 O 7 + HCl = …;
в) Mn 2 O 7 + NaOH = …;
17 . Закончить уравнения реакций: а) K 2 MnO 4 + Cl 2 = …;
б) Mn(NO 3 ) 2 + H 2 O ↔ …;
в) MnSO 4 + H 2 O ↔ …;
Реакции б), в), г) написать в молекулярном и ионно-молекулярном виде.
Видео:Химические св-ва соединений марганца Mn (+7) (KMnO4). Решаем окислительно-восстановительные р-ции.Скачать

По теме: методические разработки, презентации и конспекты
Бинарные соединения – оксиды и летучие водородные соединения
урок знакомит более подробно с оксидами, их применением, физическими и химическими свойствами. также даётся основное правило современной международной номенклатуры .
Важнейшие классы неорганических соединений. Генетическая связь между классами неорганических соединений.
Цели:1)Обобщить и систематизировать знания учащихся о составе, номенклатуре важнейших классов неорганических соединений, химических свойствах, генетической связи ; совершенствовать навыки состав.
важнейшие классы бинарных соединений — оксиды и летучие водородные соединения
презентация по данной теме может быть использована для проведения урока химии в 8 классе по программе Габриеляна О.С. Содержит 12 слайдов, позволяющие актуализировать знания обучающихся по ранее изуче.
«Основные классы неорганических соединений. генетическая связь неорганических соединений»
Заключительный урок обобщения по химии в 8 классе.
Урок по теме «Важнейшие классы бинарных соединений – оксиды и летучие водородные соединения.»
Открытый урок по химии по теме «Важнейшие классы бинарных соединений — оксиды и летучие водородные соединения». с применением интерактивной приставки MIMIO.
презентация на тему «Марганец»
Данная презентация может быть использована при изучении химии в 11 классе на профильном уровне (УМК Габриелян О. С.).
Постерная презентация по теме «Марганец»
Постерная презентация является продуктом творческой работы учащихся и может быть использована при изучении соответствующей темы. Содержит материал достаточный для изучения темы на профильном уровне.
Видео:8 класс. Массовая доля растворенного вещества. Решение задач.Скачать

Марганец, цинк и серебро
Марганец
Содержится в количестве 0,03% по массе в земной коре. Наряду с железом и его сплавами относится к черным металлам.
Для соединений марганца характерны степени окисления +2, +3, +4, +6 +7. В соединения +2 и +3 марганец проявляет основные свойства, +4 — амфотерные, +6, +7 — кислотные.
Наиболее известными минералами, в которых содержится марганец, являются:
- MnO2 — пиролюзит
- MnO(OH) — бурая марганцевая руда, манганит
- 3Mn2O3*MnSiO3 — браунит
Получают марганец алюминотермией, восстановлением коксом, электролизом.
MnO2 + C = (t) Mn + CO
- Реакции с неметаллами
На воздухе марганец вступает во взаимодействие с кислородом, пассивируется: на поверхности металла образуется оксидная пленка.
При нагревании марганец реагирует с азотом, углеродом, кремнием, бором и фосфором.
При нагревании марганец вытесняет водород из воды.
Реакции с кислотами
Марганец стоит в ряду напряжений до водорода и способен вытеснить его из кислот.
Под воздействием кислот, которые обладают окислительными свойствами, марганец окисляется.
Соединения марганца (II)
Для соединений марганца (II) характерны основные свойства. Оксид марганца (II) может быть получен разложением карбоната марганца, либо восстановлением оксида марганца (IV) до оксида марганца (II).
При растворении (и нагревании!) марганца в воде образуется гидроксид марганца (II).
Соединения марганца (II) на воздухе неустойчивы, Mn(OH)2 быстро буреет, превращаясь в оксид-гидроксид марганца (IV).
Оксид и гидроксид марганца (II) проявляют основные свойства. При реакции с кислотами дает соответствующие соли.
Соли марганца (II) получаются при его растворении в разбавленных кислотах. Эти соли способны вступать в реакции с другими солями, кислотами, если выпадает осадок, выделяется газ или образуется слабый электролит.
При действии сильных окислителей ион Mn 2+ способен переходить в ион Mn 7+
Соединения марганца (IV) проявляют амфотерный характер. Оксид марганца (IV) можно получить разложением нитрата марганца (II).
Кислород в продуктах реакции не указываем, так как он участвует в окислении MnO до MnO2.
В реакциях с щелочами марганец переходит в СО +6, в кислой среде — принимает СО +2.
MnO2 + Na2CO3 + NaNO3 = Na2MnO4 + NaNO2 + CO2 (гидролиз карбоната натрия идет по аниону, среда — щелочная)
Соединения марганца (VI) — MnO3, H2MnO4 — неустойчивы, в свободном виде не получены. Обладают кислотными свойствами. Наиболее устойчивые соли — манганаты, окрашивающие раствор в зеленый цвет.
Манганаты получают в ходе разложения перманганатов, а также реакциями в щелочной среде.
В водной среде манганаты разлагаются на с.о. +7 и +4. Манганаты окисляют хлором.
Соединения марганца (VII) — неустойчивый Mn2O7, и относительно устойчивая в разбавленных растворах HMnO4 — проявляют кислотные свойства. Соли марганцовой кислоты — перманганаты.
В различных средах — кислотной, нейтральной и щелочной — марганец принимает различные степени окисления. Внимательно изучите таблицу ниже.
Оксид марганца (VII) получают в реакции перманганата с сильными кислотами.
При растворении оксида марганца (VII) (кислотного оксида) в щелочи образуются соли марганцовой кислоты — перманганаты.
Марганцовая кислота получается в реакциях сильных окислителей с солями марганца (II).
В растворах с концентрацией марганцовой кислоты более 20% происходит ее разложение.
При нагревании перманганата калия (в быту — марганцовка) разлагается с образованием бурого MnO2, выделением кислорода.
При стоянии в растворе постепенно разлагается водой.
В кислой среде марганец принимает наиболее устойчивую (для кислой среды) — Mn 2+ , в щелочной — Mn 6+ .
Название цинка, вероятно, связано формой его кристаллитов: в переводе с немецкого Zinke — зубец. С древнейших времен известен сплав меди с цинком — латунь.
Для цинка характерна постоянная степень окисления +2.
Наиболее известные минералы, в которых содержится цинк:
- ZnS — цинковая обманка, сфалерит
- ZnO — цинкит
- ZnCO3 — симсонит, цинковый шпат
- 2ZnO*SiO2*H2O — гемиморфит
Пирометаллургический метод получения цинка заключается в обжиге цинковой обманки, и последующем восстановлении оксида цинка различными восстановителями: чаще всего C, также возможно CO и H2.
ZnO + C = (t) Zn + CO
ZnO + CO = (t) Zn + CO2
Гидрометаллургический метод получения основывается на электролизе сульфата цинка.
- Реакции с неметаллами (и аммиаком 🙂
На воздухе цинк покрывается оксидной пленкой. При нагревании цинк реагирует с галогенами, фосфором, серой, селеном.
Для цинка не характерны реакции с водородом, бором, кремнием, азотом, углеродом. Нитрид цинка можно получить в ходе реакции цинка с аммиаком.
Реакции с кислотами
Цинк способен проявлять амфотерные (двойственные) свойства: реагирует как с кислотами, так и с основаниями. При добавлении цинка в раствор щелочи выделяется водород.
Zn + H2O + NaOH = Na2[Zn(OH)4] + H2↑ (тетрагидроксоцинкат натрия)
Соединения цинка (II)
Эти соединения обладают амфотерными свойствами. Оксид цинка (II) можно получить в ходе реакции горения цинка или при разложении нитрата цинка.
Оксид цинка (II) проявляет амфотерные свойства, реагирует как с кислотами, так и с щелочами.
ZnO + H2O + 2NaOH = Na2[Zn(OH)4] (тетрагидроксоцинкат натрия)
Комплексные соли образуются в растворе, при прокаливании они не образуются.
ZnO + 2NaOH = (t) H2O + Na2ZnO2 (цинкат натрия)
Оксид цинка (II) может быть восстановлен до чистого цинка различными восстановителями.
ZnO + C = (t) Zn + CO
ZnO + CO = (t) Zn + CO2
Гидроксид цинка (II) получается в ходе реакций между растворимыми солями цинка и щелочами.
Гидроксид цинка (II) обладает амфотерными свойствами, реагирует как с кислотами, так и с основаниями.
При прокаливании комплексные соли распадаются, вода испаряется.
Серебро
Драгоценный металл, известный человеку с древнейших времен. Встречаемся в самородном виде. Будучи благородным металлом, серебро обладает низкой реакционной способностью.
- Реакции с неметаллами
Серебро не окисляется кислородом даже при высокой температуре. Галогены легко окисляют серебро до соответствующих галогенидов. При нагревании с серой получается сульфид серебра.
Реакции с кислотами
Серебро не растворяется в соляной и разбавленной серной кислотах, однако способно реагировать с концентрированными кислотами.
Потемнение серебряных изделий обусловлено реакцией серебра с сероводородом в присутствии кислорода.
С органическими веществами
В дальнейшем, при изучении органической химии, вы не раз столкнетесь с соединением серебра — аммиачным раствором оксида серебра.
Будет полезно, если вы уже сейчас познакомитесь с его формулой на примере реакции окисления уксусного альдегида до уксусной кислоты.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Марганец, цинк и серебро
Видео:ВАЛЕНТНОСТЬ 8 КЛАСС ХИМИЯ // Урок Химии 8 класс: Валентность Химических ЭлементовСкачать

Марганец
Марганец на воздухе покрывается защитной оксидной пленкой, но в виде порошка при нагревании реагирует с галогенами, серой, фосфором, кремнием, углеродом, бором и азотом:
Mn + Cl 2 → MnCl 2
2 Mn + Si → Mn 2 Si
С кислородом при нагревании, в зависимости от температуры образуются различные оксиды марганца, самый устойчивый из них MnO2:
Mn + 2 HCl → MnCl 2 + H 2 ↑
С растворами щелочей практически не взаимодействует. Но со щелочными расплавами окислителей марганец и его соединения образуют манганаты:
Mn + KClO 3 + 2 KOH → K 2 MnO 4 + KCl + H 2 O
Если вести окисление соединений марганца в кислой среде – образуется перманганат ион:
2MnO 2 + 3PbO 2 + 6HNO 3 → 2H MnO 4 + 3Pb(NO 3) 2 + 2H 2O
Марганец металл средней активности, при этом он является d-элементом, поэтому для него, как и для других d-элементов характерно наличие нескольких степеней окисления, в которых его соединения проявляют различные свойства:
Степень окисления марганца +2 – основные свойства:
MnO + 2 HCl → MnCl 2 + H 2 O
В степени окисления +4 мы считаем соединения марганца амфотерными (и кислотные и основные свойства выражены слабо). Этой степени окисления соответствуют оксид MnO2 и не устойчивый гидроксид Mn(OH)4. MnO 2 с кислотами образует соли марганца ( II ), т.к. соли марганца ( IV ) так же не устойчивы:
MnO 2 + 4 HCl (конц.) → MnCl 2 + Cl 2 ↑ + 2 H 2 O
Со щелочами и оксидами активных металлов образует устойчивые манганаты (IV):
MnO 2 + 2 KOH → K 2 MnO 3 + H 2 O
MnO 2 + K 2 O → K 2 MnO 3
В ЕГЭ обычно не встречаются две последние реакции, но могут быть вопросы на возможность протекания реакции амфотерного оксида MnO 2 со щелочами и оксидами активных металлов. Т.е. нужно просто запомнить, что Mn+4 – амфотерен, а значит, как и другие амфотерные соединения, реагирует и с кислотами, и со щелочами, и с оксидами очень активных металлов при сплавлении.
В степенях окисления +6 и +7 марганец проявляет кислотные свойства, образуя сильную марганцовую кислоту HMnO4 и соли – манганаты K 2 MnO 4 и перманганаты KMnO 4 .
По большей части вопросы про марганец в ЕГЭ связаны с окислительно-восстановительными реакциями, поэтому самое важное запомнить продукты, которые у нас образуются при различных средах протекания реакции:
Перманганат калия в кислой среде всегда переходит в ион Mn +2 , в водной (и слабощелочной) среде наш продукт всегда MnO2, т.к. Mn(OH)4 и соли марганца (IV) не устойчивые соединения, а в сильнощелочных средах записываем соли марганца в степени окисления +6 – манганаты:
2KMnO 4 + 5Na 2SO 3 + 3H 2SO 4 → 2MnSO 4 + 5Na 2SO 4 + 3H 2O + K 2SO 4
2KMnO 4 + 3Na 2SO 3 + H 2O→ 2MnO 2 ↓ + 3Na 2SO 4 + 2KOH
2KMnO 4 + Na 2SO 3 + 2KOH→ 2K 2MnO 4 + Na 2SO 4 + H 2O
! Манганат калия K 2 MnO 4 устойчив только в сильнощелочных средах поэтому например, при окислении ацетилена перманганатом в слабощелочной среде мы указываем в продуктах не манганат, а оксид марганца MnO 2:
При нагревании перманганат разлагается:
2 KMnO 4 → K 2 MnO 4 + MnO 2 ↓ + O 2
Эту реакцию используют для получения кислорода в лаборатории.
Манганат калия выступает окислителем, в водной среде так же образуя MnO 2 , а в кислой соли марганца ( II ):
K 2MnO 4 + 2Na 2SO 3 + 2H 2SO 4 → MnSO 4 + 2Na 2SO 4 + 2H 2O + K 2SO 4
K 2MnO 4 + Na 2SO 3 + H 2O→ MnO 2 ↓ + Na 2SO 4 + 2KOH
Если как исходное вещество в ОВР вам предлагают MnO2, то в зависимости от среды реакции он может выступать как окислитель в кислой среде :
MnO 2 + Na 2SO 3 + H 2SO 4 → MnSO 4 + Na 2SO 4 + H 2O
И как восстановитель при реакции с сильными окислителями в щелочной среде :
3 MnO 2 + KClO 3 + 6 KOH → 3 K 2 MnO 4 + KCl + 3 H 2 O
Mn +2 может выступать восстановителем в реакциях с окислителями в водной и щелочной средах:
3MnSO 4 + 2KMnO 4 + 2H 2O → 5 MnO 2 ↓ + K 2SO 4 + 2H 2SO 4
📽️ Видео
Как составить формулы гидроксидов и соответствующих им оксидов I ЕГЭ по химииСкачать

Реакция на результаты ЕГЭ 2022 по русскому языкуСкачать

ОВР с соединениями марганца, хрома железа и меди | Химия с Юлией ВишневскойСкачать

10 класс (профиль).Ч.2.Окисление алкенов раствором марганцовки в кислой среде.Скачать

Диоксид Марганца - ПОЛУЧЕНИЕСкачать

Видео №3. Как составить изомерыСкачать

Получение оксида марганца VII. Химический опытСкачать

Химические свойства марганца. Часть 1.Скачать

d-Элементы. Элементы VIВ и VIIВ групп. Хром. Марганец.Скачать

ОВР: как решать быстро и правильно | ХИМИЯ ЕГЭ | Лия МенделееваСкачать

Окислительно-восстановительные реакции в заданиях ЕГЭ по химииСкачать

Самые сложные ОВР с перманганатом калия | Химия ЕГЭ 2023 | УмскулСкачать

Занятие 26. Переходные металлы хром и марганецСкачать

СОЕДИНЕНИЯ МАРГАНЦА IV и VII | Таисия Фламель | ВебиумСкачать

Подгруппа Марганца. МарганецСкачать