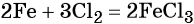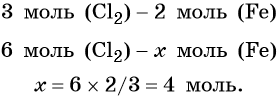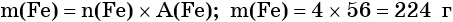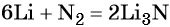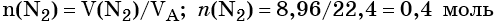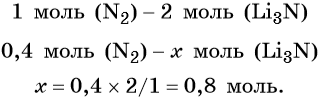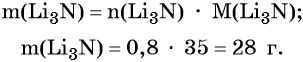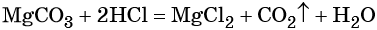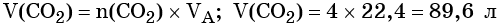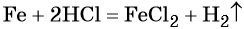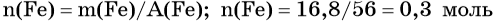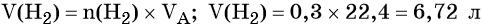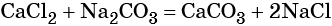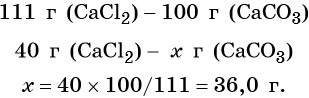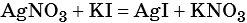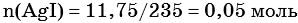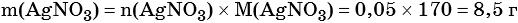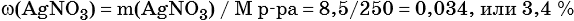Основой для проведения количественных расчётов в химии является закон сохранения массы. Согласно этому закону масса реагентов равна массе продуктов реакции.
Отсюда следует, что для любой химической реакции массы реагентов и продуктов реакции относятся между собой как молярные массы веществ, умноженные на их стехиометрические коэффициенты.
Для расчёта по химическим уравнениям можно использовать два эквивалентных способа: через количество вещества или через пропорцию.
Для определения массы (или количества вещества) продуктов реакции или исходных веществ по уравнениям химических реакций вначале составляют уравнение химической реакции и устанавливают стехиометрические коэффициенты; затем определяют молярную массу, массу и количество вещества известных реагентов химической реакции; составляют и решают пропорцию, в которую в зависимости от условий задачи вводят числовые значение величин: молярные массы, массы, количества веществ или их объёмы (для газов).
При этом в одном столбце пропорций должны находиться одинаковые характеристики вещества с одной и той же размерностью.
Пример 1. Масса железа, вступившего в реакцию с 6 моль хлора, равна _________ г. (Ответ запишите с точностью до целого числа.)
Решение. Составляем уравнение химической реакции:
Из этого уравнения следует, что 3 моль Cl2 реагируют с 2 моль Fe, т. е.:
Определяем массу железа:
Пример 2. Масса нитрида лития, образовавшегося в результате его реакции с азотом объёмом 8,96 л, равна_______________ г.
Решение. Составляем уравнение химической реакции:
Определяем количество вещества азота, вступившего в реакцию:
Из уравнения реакции следует, что из 1 моль N2 образуется 2 моль Li3N, т. е.:
Определим массу Li3N:
Пример 3. Объём углекислого газа, образовавшегося в результате разложения карбоната магния количеством вещества 4 моль избытком соляной кислоты, равен________ л.
Решение. Составляем уравнение химической реакции:
Из этого уравнения следует, что количество вещества углекислого газа и карбоната магния равны между собой, т. е. n(CO2) = 4 моль.
Пример 4. Объём водорода, который выделится при растворении 16,8 г железа в избытке разбавленной соляной кислоты, равен _________ л.
Решение. Составляем уравнение химической реакции:
Определим количество вещества железа:
Количество вещества железа и водорода в данном уравнении реакции равны между собой. Следовательно, количество вещества водорода также равно 0,3 моль.
Вычислим объём водорода:
Пример 5. Масса осадка, который образуется в результате взаимодействия 40,0 г хлорида кальция с избытком карбоната натрия, равна _________г.
Решение. Составляем уравнение реакции:
Согласно уравнению химической реакции составим пропорцию и решим её:
Пример 6. 250 г раствора нитрата серебра смешали с избытком раствора йодида калия. Выпал осадок массой 11,75 г. Вычислите массовую долю нитрата серебра в исходном растворе.
Элементы ответа (допускаются иные формулировки ответа, не искажающие его смысла)
1) Составлено уравнение химической реакции:
2) По массе осадка йодида серебра рассчитано его количество вещества, а затем в соответствии с уравнением реакции — количество вещества и масса нитрата серебра, содержащегося в исходном растворе:
Из уравнения реакции следует, что n(AgI) = n(AgNO3) = 0,05 моль, тогда:
3) Вычислена массовая доля нитрата серебра в исходном растворе:
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Тренировочные задания
1. К 300 г раствора нитрата бария прибавили избыток раствора сульфата натрия. Масса выпавшего осадка составила 23,3 г. Определите концентрацию соли в исходном растворе.
2. К 150 г раствора сульфата натрия прибавили избыток раствора хлорида бария. Масса выпавшего осадка составила 23,3 г. Определите концентрацию соли в исходном растворе.
3. К 300 г раствора силиката натрия прибавили избыток раствора нитрата кальция. Масса выпавшего осадка составила 12,0 г. Определите концентрацию соли в исходном растворе.
4. К 150 г раствора карбоната калия прибавили избыток раствора соляной кислоты. При этом выделился газ объёмом 3,36 л (н. у.). Определите концентрацию соли в исходном растворе.
5. К 250 г раствора гидрокарбоната натрия прибавили избыток раствора бромоводородной кислоты. При этом выделился газ объёмом 5,6 л. Определите концентрацию соли в исходном растворе.
6. К 50 г раствора карбоната натрия прибавили избыток раствора хлорида бария. Масса выпавшего осадка составила 7,88 г. Определите концентрацию соли в исходном растворе.
7. К 200 г раствора хлорида бария прибавили избыток раствора карбоната калия. Масса выпавшего осадка составила 7,88 г. Определите концентрацию соли в исходном растворе.
8. К 200 г раствора хлорида железа (II) прибавили избыток раствора гидроксида калия. Масса выпавшего осадка составила 18,0 г. Определите концентрацию соли в исходном растворе.
9. К 400 г раствора нитрата свинца прибавили избыток раствора йодида натрия. Масса выпавшего осадка составила 23,05 г. Определите концентрацию соли в исходном растворе.
10. К 300 г раствора йодида натрия прибавили избыток раствора нитрата свинца. Масса выпавшего осадка составила 23,05 г. Определите концентрацию соли в исходном растворе.
11. Определите массу осадка, который выпадет при взаимодействии 150 г 14,8%-ного раствора хлорида кальция с избытком раствора карбоната натрия.
12. Определите объём газа (н. у.), который выделится при взаимодействии 120 г 8,8%-ного раствора карбоната натрия с избытком раствора соляной кислоты.
13. Определите массу соли, которая выпадет в осадок при взаимодействии 140 г 13,5%-ного раствора нитрата цинка с избытком раствора сульфида натрия.
14. Определите массу осадка, который выделится при взаимодействии 200 г 18,8%-ного раствора нитрата меди с избытком раствора сульфида натрия.
15. Определите массу осадка, который выпадет при взаимодействии 200 г 6,1%-ного раствора силиката натрия с избытком раствора хлорида цинка.
16. Определите массу осадка, который выделится при взаимодействии 200 г 12,7%-ного раствора хлорида железа (II) с избытком раствора сульфида натрия.
17. Определите массу осадка, который выделится при взаимодействии 50 г 17%-ного раствора нитрата серебра с избытком раствора бромида калия.
18. Определите массу осадка, который образуется при взаимодействии 200 г 6,1%-ного раствора силиката натрия с избытком раствора нитрата кальция.
19. Определите массу осадка, который образуется при взаимодействии 50 г 5,8%-ного раствора хлорида магния с избытком раствора фосфата натрия.
20. Определите объём газа, который выделится при взаимодействии 200 г 6,9%-ного раствора карбоната калия с избытком раствора соляной кислоты.
21. Оксид фосфора (V) массой 21,3 г растворили в растворе гидроксида калия, в результате чего был получен раствор средней соли массой 500 г. Определите концентрацию фосфата калия в конечном растворе.
22. Раствор хлорида железа (II) полностью прореагировал со 120 г раствора гидроксида натрия, в результате чего образовалось 6,0 г осадка. Определите массовую долю гидроксида натрия в исходном растворе.
23. Какой объём аммиака (н. у.) может полностью прореагировать со 150 г 20%-ного раствора серной кислоты с образованием средней соли?
24. В 200 г 20%-ного раствора соляной кислоты растворили магний до прекращения выделения газа. Определите объём выделившегося при этом водорода (н. у.).
25. Аммиак объёмом 10 л (н. у.) пропустили через раствор серной кислоты с массовой долей 8% до образования средней соли. Определите массу исходного раствора.
26. Определите объём сероводорода (н. у.), который необходимо пропустить через 130 г 6%-ного раствора хлорида меди (II) до полного осаждения сульфида меди (II).
27. Сероводород объёмом 3,36 л (н. у.) пропустили через раствор гидроксида натрия, в результате чего получили 180 г раствора сульфида натрия. Определите массовую долю соли в полученном растворе.
28. Алюминий массой 8,1 г может нацело прореагировать с 250 г раствора серной кислоты. Определите массовую долю серной кислоты в исходном растворе.
29. К 250 г раствора нитрата серебра добавили раствор хлорида калия до прекращения выделения осадка, масса которого составила 14,35 г. Определите массовую долю нитрата серебра в исходном растворе.
30. К 300 г 5%-ного раствора хлорида магния добавили избыток раствора фосфата калия. Вычислите массу выпавшего при этом осадка.
Видео:ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Расчёты по уравнениям химических реакций.
Стехиометрия – количественные соотношения между вступающими в реакцию веществами.
Если реагенты вступают в химическое взаимодействие в строго определенных количествах, а в результате реакции образуются вещества, количество которых можно расчитать, то такие реакции называются стехиометрическими.
Законы стехиометрии:
Коэффициенты в химических уравнениях перед формулами химических соединений называются стехиометрическими.
Все расчёты по химическим уравнениям основаны на использовании стехиометрических коэффициентов и связаны с нахождением количеств вещества (чисел молей).
Количество вещества в уравнении реакции (число молей) = коэффициенту перед соответствующей молекулой.
Моль – это такое количество вещества, в котором содержится определённое число частиц (молекул, атомов, ионов), равное постоянной Авогадро:
Выход реакции η – отношение реальной массы продукта mp к теоретически возможной mт, выраженное в долях единицы или в процентах.
Если в условии выход продуктов реакции не указан, то в расчетах его принимают равным 100% (количественный выход).
Схема расчёта по уравнениям химических реакций:
- Составить уравнение химической реакции.
- Над химическими формулами веществ написать известные и неизвестные величины с единицами измерения.
- Под химическими формулами веществ с известными и неизвестными записать соответствующие значения этих величин, найденные по уравнению реакций.
- Составить и решить пропорцию.
Пример. Вычислить массу и количество вещества оксида магния, образовавшегося при полном сгорании 24 г магния.
1. Составим уравнение химической реакции:
2. Под формулами веществ укажем количество вещества (число молей), которое соответствует стехиометрическим коэффициентам:
3. Определим молярную массу магния:
Относительная атомная масса магния Ar(Mg) = 24.
Т.к. значение молярной массы равно относительной атомной или молекулярной массе, то M(Mg) = 24 г/моль.
4. По массе вещества, заданной в условии, вычислим количество вещества:
5. Над химической формулой оксида магния MgO, масса которого неизвестна, ставим x моль, над формулой магния Mg пишем его молярную массу:
6. Составим пропорцию:
По правилам решения пропорции:
Количество оксида магния ν(MgO) = 1 моль.
Видео:Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

Количество вещества
Содержание:
Количество вещества — физическая величина, характеризующая количество однотипных структурных единиц, содержащихся в веществе. Под структурными единицами понимаются любые частицы, из которых состоит вещество (атомы, молекулы, ионы, электроны или любые другие частицы).
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Количество вещества
Химическое количество вещества — физическая величина, пропорциональная числу структурных единиц, содержащихся в данной порции вещества.
Относительная атомная и молекулярная масса:
Часто при решении расчетных задач по химии приходится вычислять массу, объем реагирующих веществ или продуктов реакций. Кроме этих величин, в химии используется также величина количество вещества. Как измеряют количество вещества?
Каждое вещество состоит из огромного числа частиц, поэтому для удобства была выбрана единица измерения, содержащая большое число частиц, – моль. Моль – мера количества вещества (атомов, молекул, ионов), обозначается греческой буквой 
Из курса физики вам знакомо число Авогадро:
В одном моль любого вещества число структурных единиц равно числу Авогадро.
Масса одного моль вещества называется молярной массой, обозначается буквой М. Молярная масса вещества (г/моль) численно равна относительной молекулярной массе вещества.
Рассмотрите внимательно таблицу 7. Из нее видно, что в 18 г воды, 44 г углекислого газа, 23 г Na содержится столько же структурных единиц, сколько содержится в 12 г атома углерода.
Моль – мера количества вещества, в котором содержится столько структурных единиц, сколько атомов содержится в 12 граммах углерода.
При решении расчетных задач по химии удобно пользоваться этой единицей измерения. Допустим, вам нужно определить число молекул в два моль воды.
Для этого составляется пропорция: первая часть – по определению, а вторая – по условию задачи.
Для решения этой задачи можно использовать формулы
Моль, количество вещества, молярная масса, число Авогадро.
Взаимосвязь массы, молярной массы и количества вещества
Из пройденного материала вам известны такие формулы:
Объединив формулы (1) и (2), можно получить:
А. Определение массы вещества по количеству вещества.
Рассчитайте массу воды количеством вещества 2 моль.

B. Определение количества вещества по его массе.
Сколько молей составляет 176 г углекислого газа?

C. Расчет числа структурных единиц.
Рассчитайте число структурных частиц, которое содержат 2 моль элемента
водорода, 3 моль газообразного водорода, 5 моль серной кислоты.
В молекуле 
D. Расчет молярной массы вещества.
Рассчитайте молярную массу вещества, если 1,204 · 1024 молекул вещества весит 160 г.

- 1. Моль — мера количества вещества, в котором содержится столько структурных единиц (атомов, молекул, ионов), сколько атомов содержится в 12 г углерода.
- 2. В одном моль любого вещества содержится число Авогадро структурных единиц. Na = 6,02 • 1023 моль1.
- 3. Масса одного моль вещества называется молярной массой, обозначается буквой М. Молярная масса вещества (г/моль) численно равна относительно молекулярной массе.
🎦 Видео
Количество вещества. Моль. Число Авогадро. 8 класс.Скачать

Как за 4 МИНУТЫ выучить Химию? Химическое Количество, Моль и Закон АвогадроСкачать

Решение задач на термохимические уравнения. 8 класс.Скачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Химия ПростоСкачать

Химия 8 класс (Урок№7 - Закон сохранения массы веществ. Химические уравнения.)Скачать

Закон Авогадро. Молярный объем. Практическая часть. 8 класс.Скачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Химия 8 класс (Урок№10 - Расчёты по уравнениям химических реакций.)Скачать

8 класс. Количество вещества.Решение задач.Скачать

8 класс.Ч.1.Решение задач по уравнению реакций.Скачать

#635 НАУКА Структура вакуума. Устройство Мироздания: версия Межзвездного Союза. Юмор в разных мирах.Скачать

Молярная масса. 8 класс.Скачать

8 класс. Химия. Как расставить коэффициенты в уравнении?Скачать

Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 1 ч. 9 класс.Скачать