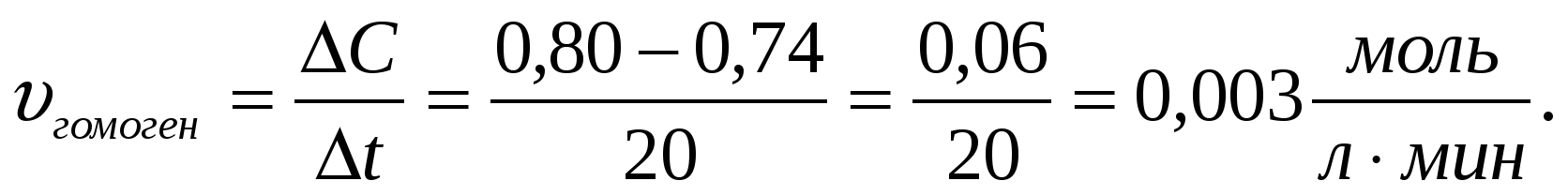Тема урока «Скорость химических реакций. Факторы, влияющие на скорость химической реакции» Цель: выясним, что есть скорость химической реакции, и от каких факторов она зависит. В ходе урока познакомимся с теорией вопроса по вышеназванной теме. На практике подтвердим некоторые наши теоретические предположения.
Обсудим следующие вопросы: Зачем нужны знания о скорости химических реакций? Какими примерами можно подтвердить то, что химические реакции протекают с различными скоростями? Как определяют скорость механического движения? Какова единица измерения этой скорости? Как определяют скорость химической реакции? Какие условия необходимо создать, чтобы началась химическая реакция?
Скорость реакции определяется изменением количества вещества в единицу времени.
Анализ таблицы, выводы: по приведённым формулам можно рассчитать лишь некоторую среднюю скорость данной реакции в выбранном интервале времени (ведь для большинства реакций скорость уменьшается по мере их протекания); рассчитанная величина скорости будет зависеть от того, по какому веществу её определяют, а выбор последнего зависит от удобства и лёгкости измерения его количества. Например, для реакции 2Н2 +О2 = 2Н2О: v (по Н2) = 2v (по О2) = v (по Н2О)
Задача на применение знаний по «Скорости химических реакций» Химическая реакция протекает в растворе, согласно уравнению: А+В = С. Исходные концентрации: вещества А – 0,80 моль/л, вещества В – 1,00 моль/л. Через 20 минут концентрация вещества А снизилась до 0, 74 моль/л. Определите: а) среднюю скорость реакции за этот промежуток времени; б) концентрацию вещества В через 20 мин.
Факторы, влияющие на скорость химической реакции природа реагирующих веществ; температура; концентрация реагирующих веществ; действие катализаторов; поверхность соприкосновения реагирующих веществ (в гетерогенных реакциях).
Теория столкновений. Основная идея её такова: реакции происходят при столкновении частиц реагентов, которые обладают определённой энергией. Выводы: Чем больше частиц реагентов, чем ближе они друг к другу, тем больше шансов у них столкнуться и прореагировать. К реакции приводят лишь эффективные соударения, т.е. такие при которых разрушаются или ослабляются «старые связи» и поэтому могут образоваться «новые». Но для этого частицы должны обладать достаточной энергией. Минимальный избыток энергии (над средней энергией частиц в системе), необходимый для эффективного соударения частиц в системе), необходимый для эффективного соударения частиц реагентов, называется энергией активации Еа.
1. Природа реагирующих веществ. Под природой реагирующих веществ понимают их состав, строение, взаимное влияние атомов в неорганических и органических веществах. Величина энергии активации веществ – это фактор, посредством которого сказывается влияние природы реагирующих веществ на скорость реакции.
Задание на применение знаний Объясните разную скорость взаимодействия цинка и магния с уксусной кислотой; цинка с соляной и уксусной кислотой. Напишите соответствующие реакции (в протоколе).
2. Температура При увеличении температуры на каждые 10° С общее число столкновений увеличивается только на
1,6 %, а скорость реакции увеличивается в 2-4 раза (на 100-300%). Число, показывающее, во сколько раз увеличивается скорость реакции при повышении температуры на 10° С, называют температурным коэффициентом. Правило Вант-Гоффа математически выражается следующей формулой: где –скорость реакции при температуре t2, – скорость реакции при температуре t1, – температурный коэффициент.
Задача на применение знаний: Определите, как изменится скорость некоторой реакции: а) при повышении температуры от 10° до 50° С; б) при понижении температуры от 10° – 0° С. Температурный коэффициент реакции равен 3.
Самопроверка а) подставить данные задачи в формулу: скорость реакции увеличится в 81 раз. б) Скорость реакции уменьшится в 3 раза.
3. Концентрации реагирующих веществ. На основе большого экспериментального материала в 1867 г. норвежские учёные К. Гульдберг, и П Вааге и независимо от них в 1865 г. русский учёный Н.И. Бекетов сформулировали основной закон химической кинетики, устанавливающий зависимость скорости реакции от концентраций реагирующих веществ: скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях равных их коэффициентам в уравнении реакции. Этот закон ещё называют законом действующих масс.
Математическое выражение закона действующих масс. По закону действующих масс скорость реакции, уравнение которой А+В=С может быть вычислена по формуле: v1= k1CACB, а скорость реакции, уравнение которой А+2В=D, может быть вычислена по формуле: v2= k2CACB . В этих формулах: CA и CB – концентрации веществ А и В (моль/л), k1 и k2 – коэффициенты пропорциональности, называемые константами скоростей реакции. Эти формулы также называют кинетическими уравнениями.
Задача на применение знаний: 1. Составьте кинетические уравнения для следующих реакций: А) H2+I2=2HI; Б) 2 Fe + 3CI2= 2 FeCI3. 2. Как изменится скорость реакции, имеющей кинетическое уравнение v= kCA 2CB, если А) концентрацию вещества А увеличить в 3 раза; Б) концентрацию вещества А увеличить в 3 раза, а концентрацию В уменьшить в 3 раза?
Самопроверка. Решение. Подставим соответствующие данные в кинетическое уравнение, сравним скорости реакций. а) скорость реакции увеличится в 9 раз. б) скорость реакции увеличится в 8 раз.
4. Действие катализатора Обсуждение вопросов: 1.Что такое катализатор и каталитические реакции? 2. Приведите примеры известных вам каталитических реакций из органической и неорганической химии. Укажите названия веществ – катализаторов. 3. Выскажите предположение о механизме действия катализаторов (на основе теории столкновений). 4. Каково значение каталитических реакций?
5.Поверхность соприкосновения реагирующих веществ. Скорость реакции увеличивается благодаря: -увеличению площади поверхности соприкосновения реагентов (измельчение); -повышению реакционной способности частиц на поверхности образующихся при измельчении микрокристаллов; -непрерывному подводу реагентов и хорошему отводу продуктов с поверхности, где идёт реакция. Фактор связан с гетерогенными реакциями, которые протекают на поверхности соприкосновения реагирующих веществ: газ — твердое вещество, газ — жидкость, жидкость — твердое вещество, жидкость — другая жидкость, твердое вещество — другое твердое вещество, при условии, что они не растворимы друг в друге. Приведите примеры гетерогенных реакций.
Выводы по теме урока Химические реакции протекают с различными скоростями. Величина скорости реакции не зависит от объёма в гомогенной системе и от площади соприкосновения реагентов – в гетерогенной. На пути всех частиц, вступающих в химическую реакцию, имеется энергетический барьер, равный энергии активации Eа. Скорость реакции зависит от факторов: -природа реагирующих веществ; -температура; -концентрация реагирующих веществ; — действие катализаторов; -поверхность соприкосновения реагирующих веществ (в гетерогенных реакциях).
Выводы по теме урока Величина энергии активации веществ – это фактор, посредством которого сказывается влияние природы реагирующих веществ на скорость реакции. Чем меньше энергия активации, тем больше эффективных соударений реагирующих частиц. При увеличении температуры на 10º С общее число активных соударений увеличивается в 2-4 раза. Чем больше концентрации реагентов, тем больше соударений реагирующих частиц, а среди них и эффективных соударений. Катализатор изменяет механизм реакции и направляет её по энергетически более выгодному пути с меньшей энергией активации. Ингибитор замедляет ход реакции. Гетерогенные реакции протекают на поверхности соприкосновения реагирующих веществ. Нарушение правильной структуры кристаллической решётки приводит к тому, что частицы на поверхности образующихся микрокристаллов значительно реакционноспособнее, чем те же частицы на «гладкой» поверхности.
Видео:Скорость химических реакций. 9 класс.Скачать

Урок химии 10 класс на тему «Скорость химических реакций» Решение задач.
Данная разработка урока предназначена для проведения урока по теме: «Скорость химических реакций» для учащихся 10 класса в разделе «Классификация химических реакцийЙ»
Просмотр содержимого документа
«Урок химии 10 класс на тему «Скорость химических реакций» Решение задач.»
Зеленовский районный отдел образования
Открытый урок химии
Тема: Решение расчетных задач (вычисление изменения скорости
реакции от концентрации
реагирующих веществ и от температуры.)
Урок 27 /68 Химия 10
Решение расчетных задач (вычисление изменения скорости реакции от концентрации реагирующих веществ и от температуры.)
продолжить формирование понятия «скорость химических реакций», вывести формулы для вычисления скорости гомогенных и гетерогенных реакций, рассмотреть от каких факторов зависит скорость химических реакций.
Знают: понятие о скорости химических реакций и единицах её измерения, факторы влияющие на скорость реакции. Уметь: выяснять взаимосвязь между скоростью химических реакций и внешними факторами; устанавливать причинно-следственные связи, проводить эксперимент, развивать умения осуществлять самоконтроль и взаимоконтроль.
Решение расчетных задач.
Мозговой штурм.(составление вопросов по таксономии Блума)
Проведение эксперимента (фронтальная работа)
Решение задач. (работа в паре)
Тест (индивид работа)
Учебник «Химия 10 кл», тетрадь раб. Презентация. Компьютер. Проектор. Химическая посуда. Реактивы. Оценочный лист.
Организационный момент нацеливание на определенный результат.
1. Готовятся к активной учебно-познавательной деятельности. Знакомятся с оценочными листами.
Сегодня на уроке мы продолжим изучение темы «Химические реакции» и продолжим знакомится с понятием «скорость реакции».
В курсе физики и математики вы сталкивались с термином «скорость», что он означал, в каких единицах измерения рассчитывался?
В химии тоже есть такое понятие, но оно характеризует химические процессы.
С этими процессами вы сталкивались, но, порой, не задумывались об этом: почему продукты питания портятся (многие быстро), зачем их помещают в холодильник, как быстро сгорает топливо в авто, а коррозия продолжается годы (но зимой этот процесс гораздо интенсивнее)?!
Усвоив материал урока, вы сможете ответить на данные вопросы, выявите, какие факторы влияют на эти процессы.
Сообщение темы урока.
выяснить, что есть скорость химической реакции, и от каких факторов она зависит. В ходе урока познакомимся с теорией вопроса по вышеназванной теме. На практике подтвердим некоторые наши теоретические предположения.
Активизация опорных знаний и умений.
Прием «Мозговой штурм».
Зачем нужны знания о скорости химических реакций?
Какими примерами можно подтвердить то, что химические реакции протекают с различными скоростями?
Как определяют скорость химической реакции?
Какие условия необходимо создать, чтобы началась химическая реакция?
Учащиеся записывают тему урока, формулируют задачи урока, выдвигают свои предположения.
Учащиеся задают вопросы (по таксономии Блума) друг другу по теме «скорость химической реакции»
Учащиеся отвечают на вопросы учителя. Приводят примеры.
Рассмотрим два примера (эксперимент проводит ученик ).
На столе – две пробирки, в одной раствор щелочи (КOH), в другой – гвоздь; в обе пробирки приливаем раствор CuSO4. Что мы наблюдаем?
В первой пробирке реакция произошла мгновенно, во второй – видимых изменений пока нет.
Составим уравнения реакций
Какой вывод по проведённым реакциям мы можем сделать? Почему одна реакция идёт мгновенно, другая медленно? Для этого необходимо вспомнить, что есть химические реакции, которые протекают во всём объёме реакционного пространства (в газах или растворах), а есть другие, протекающие лишь на поверхности соприкосновения веществ (горение твёрдого тела в газе, взаимодействие металла с кислотой, солью менее активного металла).
На прошлом уроке мы выяснили сто скорость химической реакции зависит от таких факторов как концентрация реагирующих веществ и температура.
Решение задач .на закон действующих масс.
Как изменится скорость реакции, имеющей кинетическое уравнение
А) концентрацию вещества А увеличить в 3 раза; (решает учитель у доски)
Б) концентрацию обоих веществ увеличить в 2 раза..(решают ученики самостоятельно)
Решение. Подставим соответствующие данные в кинетическое уравнение, сравним скорости реакций.
а) 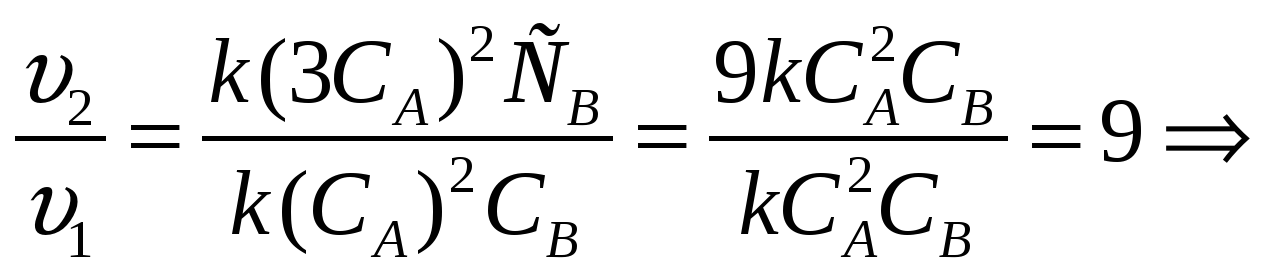
б) 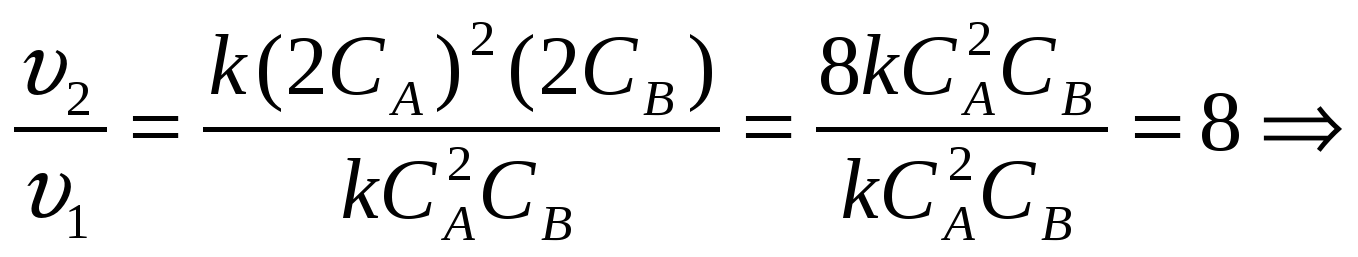
С помощью химического эксперимента мы выявим закономерности изменения скорости химических реакций в зависимости от условий (работа в тройках ).
Площадь соприкосновения реагирующих веществ
Fe(порошок) + HCL = (V1)
Fe(кнопка) + HCL = (V2)
Чем больше площадь соприкосновения, тем выше скорость реакции.
Присутствие некоторых веществ
(повторить понятие ферменты!)
Катализаторы- ускоряют химические реакции;
Природа реагирующих веществ
Чем активнее вещество, вступающее в реакцию, тем быстрее идёт реакция.
Демонстрация видео ролика. «Зависимость скорости химической реакции от различных факторов)
Контроль и самопроверка знаний
Цель: проверить качество усвоения учебного материала.
(работа в парах). Решение задач на применение правила Вант-Гоффа или закона действующих масс
После выполненной работы проецируем на экран образцы решённых задач, чтобы зрительно закрепить ход решения
Задача 1: Как изменится скорость реакции при понижении температуры на 70 градусов, если температурный коэффициент реакции равен двум?
Решение: ∆t= — 70 0С
v2/v1 = γ∆t/10 = 2-7 = 1/128
ответ: скорость реакции уменьшится в 128 раз.
Задача 2: При повышении температуры на 30 0С скорость некоторой реакции увеличивается в 64 раза. Чему равен температурный коэффициент этой реакции?
v2/v1= 64; : ∆t= 30 0С
Ответ: температурный коэффициент скорости реакции равен 4.
Задача 3:Как изменится скорость реакции синтеза аммиака из простых веществ при увеличении концентрации реагирующих веществ в 3 раза?
Решение: уравнение реакции N2 + 3H2 = 2NH3 (все вещества в газообразном состоянии)
пусть первоначальные концентрации веществ:
[N2]=х [H2]=y, тогда v= k x y3
Новые концентрации веществ: [N2]=3х [H2]=3y,
тогда v2= k 3x (3y)3= 81 k x y3
v2/v1= 81 k x y3/ k x y3
Ответ: скорость химической реакции увеличивается в 81 раз
Задача 4 . Химическая реакция протекает в растворе, согласно уравнению: А+В = С. Исходные концентрации: вещества А – 0,80 моль/л,. Через 20 минут концентрация вещества А снизилась до 0, 74 моль/л. Определите: а) среднюю скорость реакции за этот промежуток времени;
а) определение средней скорости реакции в растворе производится по формуле:
Закрепление знаний. Тест . Индивид работа.
1. На скорость химической реакции между серной кислотой и железом не влияет:
2. Измельчение железа
3.Температура реакционной смеси
4. Увеличение давления
2. В течение одной минуты выделится больше водорода, если для реакции использовать:
1. Zn(гранулы) и CH3COOH (10%-й раствор)
2. Zn(порошок) и HCl (10%-й раствор)
3. Zn(гранулы) и HCl (10%-й раствор)
4. Zn(порошок) и CH3COOH (10%-й раствор)
3. Какой из факторов не оказывает влияния на скорость химической реакции в растворах?
1. Концентрация веществ
2. Использование катализатора
3. Использование ингибитора
4. Объем реакционного сосуда
4. Быстрее при комнатной температуре будет протекать реакция между 10% раствором соляной кислоты и:
1. Цинком в гранулах
2. Большим куском цинка
3. Цинком, покрытым медью
4. Цинком в порошке
На примерах учащиеся судят о скорости реакций и делают соответствующие выводы. Запись на доске проделанных реакций (двое учащихся)
Два ученика записывают на доске уравнения:
Fe + CuSO4 = FeSO4 + Cu Fe 0 + Cu 2+ = Fe 2+ + Cu 0
По результатам демонстрированного эксперимента учащиеся делают вывод:
реакция 1 – гомогенная, реакция 2– гетерогенная.
Скорости этих реакций будут математически определяться по-разному.
Учащиеся у доски записывают формулы для определения скорости химической реакции
Учащиеся отвечают на вопрос. Записывают у доски закон действующих масс. Уравнение Вант –Гоффа.
Решают задачу на применение закона действующих масс.
Учащиеся проводят эксперимент
Учащиеся четко формулируют выводы. Записывают уравнения реакции.
1уч. – рассказывает эксперемент. 2 уч. Записывает ур-нение реакции.3. уч. – формулирует вывод. Записывают в тетрадь.
Смотрят видео ролик.
Осмысленное восприятие учебного материала
Каждая пара решает по 1-й задаче на применение правила Вант-Гоффа или закона действующих масс.
Решают у доски, объясняют решение задачи всему классу.
Учащиеся выполняют тест. Обмениваются тетрадями. Осуществляют вместе с учителем проверку.
1. А) Рефлексивное задание . заполняют оценочные листы.
Б) Мобилизует учащихся на рефлексию своего поведения, на осмысление усвоения материала, удовлетворение своей работой и работой в парах
2. Дом зад параграф 3.8.. Решить задачи:
1. В сосуде объемом 2л протекает реакция
2NO(г) + O2 (г) = 2NO2 (г). В некоторый момент времени количество вещества оксида азота (IV) составляло 0,12 моль. Через 8с оно стало равно 0,36 моль. Чему равна средняя скорость этой реакции?
(ответ: 0,015 моль/л*с)
2. Как изменится скорость реакции при понижении температуры на 70 градусов, если температурный коэффициент равен 2? (ответ: уменьшится в 128 раз)
1. Заполняют оценочные листы осмысливают свою деятельность на уроке.
25- 23 баллов — оценка 5
22 — 18 баллов — оценка 4
17 – 13 баллов – оценка 3
Проводят самооценку своей деятельности
2Учащиеся записывают домашнее задание.
Формативное (наблюдение, похвала, поощрение, сигналы рукой)
Изменения по уроку
Ученика (цы)________________ предмет: химия
Проведение эксперемента( работа в тройке)
Работа в паре (решение задач)
Оценивание каждого задания по пяти балльной системе.
25- 23 баллов — оценка 5
22 — 18 баллов — оценка 4
17 – 13 баллов – оценка 3
Удовлетворены ли вы результатом своей познавательности на уроке?
Проявился ли интерес к предмету на данном уроке?
Соответствовал ли уровень изложения материала степени вашей готовности к уроку?
Осознаёте ли вы важность полученных на сегодняшнем уроке знаний?
Возникала ли на уроке атмосфера сотрудничества между вами и другими учениками вашего класса?
Удовлетворены ли вы сегодняшним уроком?
Оцениваем по пятибалльной системе.
Ученика (цы)________________ предмет: химия
Проведение эксперемента( работа в тройке)
Работа в паре (решение задач)
Оценивание каждого задания по пяти балльной системе.
25- 23 баллов — оценка 5
22 — 18 баллов — оценка 4
17 – 13 баллов – оценка 3
Ученика (цы)________________ предмет: химия
Проведение эксперемента( работа в тройке)
Работа в паре (решение задач)
Оценивание каждого задания по пяти балльной системе.
25- 23 баллов — оценка 5
22 — 18 баллов — оценка 4
17 – 13 баллов – оценка 3
Задача 1: Как изменится скорость реакции при понижении температуры на 70 градусов, если температурный коэффициент реакции равен двум?
Задача 2: При повышении температуры на 30 0С скорость некоторой реакции увеличивается в 64 раза. Чему равен температурный коэффициент этой реакции?
Задача 3:Как изменится скорость реакции синтеза аммиака из простых веществ при увеличении концентрации реагирующих веществ в 3 раза?
Задача 4 . Химическая реакция протекает в растворе, согласно уравнению: А+В = С. Исходные концентрации: вещества А – 0,80 моль/л,. Через 20 минут концентрация вещества А снизилась до 0, 74 моль/л. Определите: а) среднюю скорость реакции за этот промежуток времени;
Домашнее задание. Решите задачи.
1. В сосуде объемом 2л протекает реакция
2NO(г) + O2 (г) = 2NO2 (г). В некоторый момент времени количество вещества оксида азота (IV) составляло 0,12 моль. Через 8с оно стало равно 0,36 моль. Чему равна средняя скорость этой реакции?
2. Как изменится скорость реакции при понижении температуры на 70 градусов, если температурный коэффициент равен 2?
Домашнее задание. Решите задачи.
1. В сосуде объемом 2л протекает реакция
2NO(г) + O2 (г) = 2NO2 (г). В некоторый момент времени количество вещества оксида азота (IV) составляло 0,12 моль. Через 8с оно стало равно 0,36 моль. Чему равна средняя скорость этой реакции?
2. Как изменится скорость реакции при понижении температуры на 70 градусов, если температурный коэффициент равен 2?
Домашнее задание. Решите задачи.
1. В сосуде объемом 2л протекает реакция
2NO(г) + O2 (г) = 2NO2 (г). В некоторый момент времени количество вещества оксида азота (IV) составляло 0,12 моль. Через 8с оно стало равно 0,36 моль. Чему равна средняя скорость этой реакции?
2. Как изменится скорость реакции при понижении температуры на 70 градусов, если температурный коэффициент равен 2?
Домашнее задание. Решите задачи.
1. В сосуде объемом 2л протекает реакция
2NO(г) + O2 (г) = 2NO2 (г). В некоторый момент времени количество вещества оксида азота (IV) составляло 0,12 моль. Через 8с оно стало равно 0,36 моль. Чему равна средняя скорость этой реакции?
2. Как изменится скорость реакции при понижении температуры на 70 градусов, если температурный коэффициент равен 2?
Домашнее задание. Решите задачи.
1. В сосуде объемом 2л протекает реакция
2NO(г) + O2 (г) = 2NO2 (г). В некоторый момент времени количество вещества оксида азота (IV) составляло 0,12 моль. Через 8с оно стало равно 0,36 моль. Чему равна средняя скорость этой реакции?
2. Как изменится скорость реакции при понижении температуры на 70 градусов, если температурный коэффициент равен 2?
Домашнее задание. Решите задачи.
1. В сосуде объемом 2л протекает реакция
2NO(г) + O2 (г) = 2NO2 (г). В некоторый момент времени количество вещества оксида азота (IV) составляло 0,12 моль. Через 8с оно стало равно 0,36 моль. Чему равна средняя скорость этой реакции?
2. Как изменится скорость реакции при понижении температуры на 70 градусов, если температурный коэффициент равен 2?
Домашнее задание. Решите задачи.
1. В сосуде объемом 2л протекает реакция
2NO(г) + O2 (г) = 2NO2 (г). В некоторый момент времени количество вещества оксида азота (IV) составляло 0,12 моль. Через 8с оно стало равно 0,36 моль. Чему равна средняя скорость этой реакции?
2. Как изменится скорость реакции при понижении температуры на 70 градусов, если температурный коэффициент равен 2?
Домашнее задание. Решите задачи.
1. В сосуде объемом 2л протекает реакция
2NO(г) + O2 (г) = 2NO2 (г). В некоторый момент времени количество вещества оксида азота (IV) составляло 0,12 моль. Через 8с оно стало равно 0,36 моль. Чему равна средняя скорость этой реакции?
2. Как изменится скорость реакции при понижении температуры на 70 градусов, если температурный коэффициент равен 2?
Домашнее задание. Решите задачи.
1. В сосуде объемом 2л протекает реакция
2NO(г) + O2 (г) = 2NO2 (г). В некоторый момент времени количество вещества оксида азота (IV) составляло 0,12 моль. Через 8с оно стало равно 0,36 моль. Чему равна средняя скорость этой реакции?
2. Как изменится скорость реакции при понижении температуры на 70 градусов, если температурный коэффициент равен 2?
Домашнее задание. Решите задачи.
1. В сосуде объемом 2л протекает реакция
2NO(г) + O2 (г) = 2NO2 (г). В некоторый момент времени количество вещества оксида азота (IV) составляло 0,12 моль. Через 8с оно стало равно 0,36 моль. Чему равна средняя скорость этой реакции?
Как изменится скорость реакции при понижении температуры на 70 градусов, если температурный коэффициент равен 2?
Видео:Влияние концентрации на скорость химических реакций. 10 класс.Скачать

Составьте кинетические уравнения
Задача на применение знаний: 1. Составьте кинетические уравнения для следующих реакций: А) H2+I2=2HI; Б) 2 Fe + 3CI2= 2 FeCI3. 2. Как изменится скорость реакции, имеющей кинетическое уравнение v= kCA 2CB, если А) концентрацию вещества А увеличить в 3 раза; Б) концентрацию вещества А увеличить в 3 раза, а концентрацию В уменьшить в 3 раза?
Слайд 16 из презентации «Факторы скорости химической реакции»
Размеры: 720 х 540 пикселей, формат: .jpg. Чтобы бесплатно скачать слайд для использования на уроке, щёлкните на изображении правой кнопкой мышки и нажмите «Сохранить изображение как. ». Скачать всю презентацию «Факторы скорости химической реакции.ppt» можно в zip-архиве размером 82 КБ.
Видео:259. Как изменится скорость хим реакции, если увеличить давлениеСкачать

Реакции
«Химические и физические явления» — Физические и химические явления. Практическая работа. Химические явления. Признаки химических реакций. Какие явления мы называем физическими? Текст. Что вы наблюдаете? Сделайте вывод. Химические явления- это…. Задание 1. Вы уже научились отличать химические явления от физических? Химические явления называют химическими реакциями.
«Химические реакции 11 класс» — Кроссворд. CuO – Класс соединения. Реакции, в которых указан тепловой эффект. NaOH +HCl = NaCl +H2O Тип реакции. Биологически активные катализаторы. 2NaNO3 ? 2NaNO2 + O2 Тип реакции. Отрицательно заряженные ионы. Реакция обмена с водой. Распад вещества на ионы. Реакции, протекающие с выделением теплоты.
«Скорость реакции» — Что такое энергия активации? Определите тип реагирующих систем. Влияние природы реагирующих веществ. 2 ряд. Влияние концентрации реагирующих веществ (для гомогенных систем) 3ряд. Чем определяется скорость реакций? Какие типы реакций называются гомо(гетеро) генными? Что мы изучали? Решение задач. Влияние температуры.
«Типы химических реакций» — Химические реакции происходят: при смешении или физическом контакте реагентов самопроизвольно при нагревании при участии катализаторов действии света электрического тока механического воздействия и т. п. Реакция, протекающая между простыми и сложными веществами, при которой атомы простого вещества замещают атомы одного из элементов в сложном веществе, называется реакцией замещения.
«Реакции» — Выделение газа. Чистый воздух в современном городе- дефицит! Дать начальные представления о химической реакции. Рузавкина Р.Р. учитель химии и биологии МОУ Ореховская СОШ. Краткий очерк истории химии. Учитель раскрывает огромное значение химии в современном мире. Превращение веществ. Грамотное применение достижений химии приносит пользу человечеству.
📸 Видео
Химическая кинетика. Скорость химической реакции | ХимияСкачать

257. Как изменится скорость хим реакции, если увеличить концентрацию одного из реагирующих веществСкачать

Влияние температуры на скорость химических реакций. 10 класс.Скачать

ЛЕКЦИЯ №2 || Химическая кинетика || Скорость реакции, Закон действия масс, Порядок реакцииСкачать

Задачи на скорость реакции в зависимости от концентрации реагентовСкачать

Все о скорости химической реакции | Химия ЕГЭ 10 класс | УмскулСкачать

Как выучить Химию с нуля за 10 минут? Принцип Ле-ШательеСкачать

Скорость химической реакцииСкачать

Составляем кинетические уравненияСкачать

Скорость реакции. Химия – ПростоСкачать

81. Факторы, влияющие на скорость реакции (часть 2)Скачать

Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать

Габриелян О. С. 8 класс §30 "Реакции разложения".Скачать

Скорость химической реакции. Практическая часть. 10 класс.Скачать

Решаем все типы 22 задания ЕГЭ по химии 2024 за 20 минут! | Екатерина СтрогановаСкачать

Решение задач по теме Скорость химической реакцииСкачать

Скорость химической реакции. 10 класс.Скачать