Сульфид калия K2S — белое вещество, плавится без разложения. Термически устойчивый. Хорошо растворяется в воде.
Относительная молекулярная масса Mr = 110,26; относительная плотность для тв. и ж. состояния d = 1,74; tпл = 912º C.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Способ получения
1. Сульфид калия можно получить путем взаимодействия калия и серы при температуре 100 — 200º C:
2K + S = K2S
2. При взаимодействии с углеродом (коксом) сульфат калия при температуре 900º C образует сульфид калия и угарный газ:
3. При температуре 600º C в присутствии оксида железа (III) сульфат калия реагирует с водородом . Взаимодействие сульфата калия с водородом приводит к образованию сульфида калия и воды:
Видео:Гробы #2 | Задачка с сульфидом калияСкачать

Качественная реакция
Качественная реакция на сульфид калия — взаимодействие его с хлоридом меди, в результате реакции происходит образование черного осадка:
1. При взаимодействии с хлоридом меди , сульфид калия образует осадок сульфид меди и хлорид калия:
CuCl2 + K2S = CuS↓ + 2KCl
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Химические свойства
1. Сульфид калия может реагировать с простыми веществами :
Твердый сульфид калия реагирует с кислородом при температуре выше 500º C. При этом образуется сульфат калия:
2. Сульфид калия вступает в реакцию со многими сложными веществами :
2.1. Сульфид калия способен реагировать со многими кислотами :
2.1.1. Сульфид калия реагирует с разбавленной хлороводородной кислотой . Взаимодействие сульфида калия с хлороводородной кислотой приводит к образованию хлорида калия и газа сероводорода:
K2S + 2HCl = 2KCl + H2S↑
2.1.2. Сульфид калия взаимодействует с концентрированной серной кислотой . При этом образуются гидросульфат калия, газ оксид серы, осадок сера и вода:
2.1.3. При взаимодействии сульфида калия с концентрированной азотной кислотой выделяются нитрат калия, газ оксид азота, сера и вода:
2.1.4 . Взаимодействуя с насыщенной сероводородной кислотой холодный сульфид калия образует гидросульфид калия:
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Сульфид калия
| Сульфид калия | |
|---|---|
 | |
| Систематическое наименование | калия сульфид |
| Традиционные названия | калий сернистый, сульфид калия, калия моносульфид |
| Хим. формула | K2S |
| Состояние | бесцветный порошок с запахом тухлых яиц |
| Молярная масса | 110,262 г/моль |
| Плотность | 1,805 г/см³ |
| Температура | |
| • плавления | 471; 948 °C |
| Мол. теплоёмк. | 76,15 Дж/(моль·К) |
| Энтальпия | |
| • образования | −387,3 кДж/моль |
| Растворимость | |
| • в воде | растворяется с образованием KSH, KOH |
| • в остальных веществах | растворяется в этаноле и глицерине |
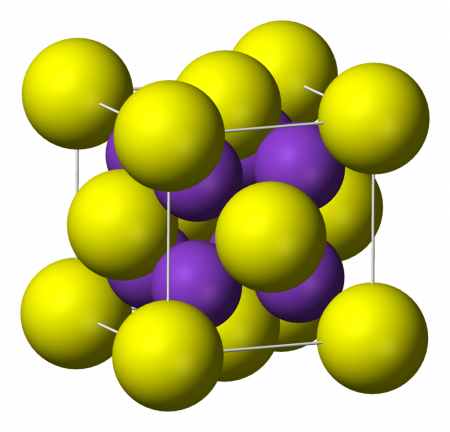
| Кристаллическая структура | кубическая сингония |
| Рег. номер CAS | 1312-73-8 |
| PubChem | 14800 |
| Рег. номер EINECS | 215-197-0 |
| SMILES | |
| RTECS | TT6000000 |
| ChemSpider | 14116 |
| Пиктограммы ECB |   |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Калия сульфид — бинарное неорганическое химическое соединение калия с серой. Представляет собой соединение с формулой K2S.
Видео:Очистка садового сульфата калияСкачать

Содержание
- 1 Физические свойства
- 2 Получение
- 3 Химические свойства
- 4 Применение
- 4.1 В пиротехническом деле
Видео:СУЛЬФАТ КАЛИЯ и 13-40-13❓️ СУЛЬФАТ КАЛИЯ лучший источник КАЛИЯ для цветочных культур в фазе цветенияСкачать

Физические свойства
Сульфид калия K2S — бесцветные кубические кристаллы (a = 0,739 нм, Z=4; пространственная группа Fm3m). Хорошо растворимы в воде (с гидролизом). Растворим в спирте и глицерине. Гигроскопичен, образует ди- и пентагидраты.
Видео:Кислотные остатки& как запомнить сульфат, сульфит и сульфидСкачать

Получение
Прямой синтез из элементов:
2K + S → 100−200oC K2S
Восстановление сульфата калия водородом:
или углеродом (в промышленности — кокс):
Сульфит калия при нагревании диспропорционирует:
Видео:Зачем Нужен Сульфат Калия ✔️ Сульфат Калия ОсеньюСкачать

Химические свойства
На воздухе медленно окисляется:
в зависимости от условий проведения этой реакции образуются побочные продукты: коллоидная сера, полисульфиды калия.
Сульфид калия при поджигании сгорает:
Так как сероводород является слабой кислотой, то сульфид калия разлагается кислотами:
Концентрированные кислоты могут окислять выделяемый сероводород:
При кипячении раствора сульфида калия с серой или сплавления его с серой образуются полисульфиды:
для калия выделены полисульфиды вплоть до n = 6.
При пропускании через раствор сульфида калия избытка сероводорода образуются гидросульфид калия:
Реагирует, образовывая соединения с сульфидами Ag, Sn и другими.
Видео:Химия 9 класс (Урок№11 - Сера. Серовород. Сульфиды.)Скачать

Применение
Калия сульфид компонент светочувствительных эмульсий в фотографии, аналитический реагент для разделения сульфидов металлов, является компонентом входящим в состав для удаления наружного слоя шкур.
В пиротехническом деле
Сульфид калия образуется при сжигании пороха.
Видео:СУЛЬФАТ КАЛИЯ. Сульфат Калия для цветов а Калиевая селитра для Томатов. КОГДА НЕТУ КОМП.УДОБ 3-11-38Скачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. 🎥 ВидеоГидролиз солей. 9 класс.Скачать  Сульфиды, сульфиты, сульфаты как отличитьСкачать  Составление формул соединений. 8 класс.Скачать  Кристаллы из сульфата калия - магнияСкачать  Не растворяется Сульфат Калия - как растворитьСкачать  8 класс. Кислоты и соли. Составление формул солей по валентности.Скачать  ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать  Как легко растворить сульфат калия.Все наглядно!Скачать  Сульфат калия марки Солюпоташ/Solupotasse/ важная добавка для растений в саду/ экспериментСкачать  185 Сульфат калия.Скачать  |
