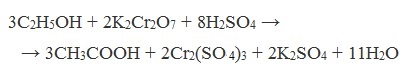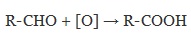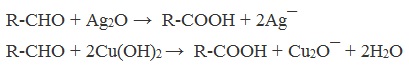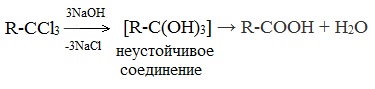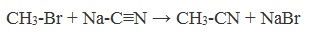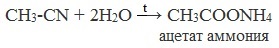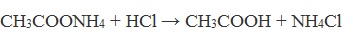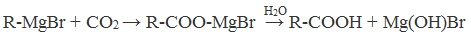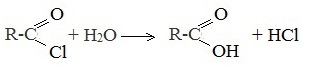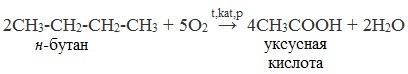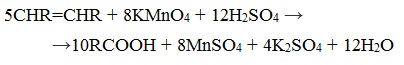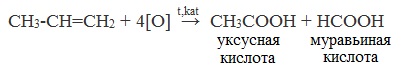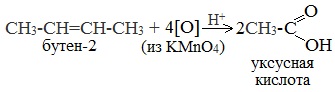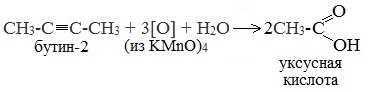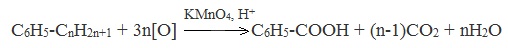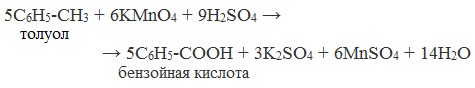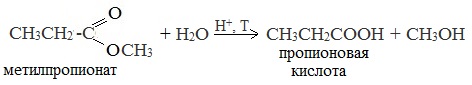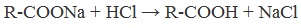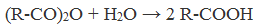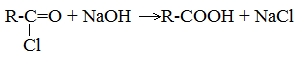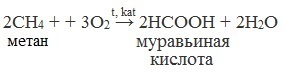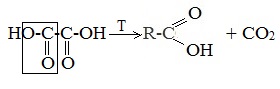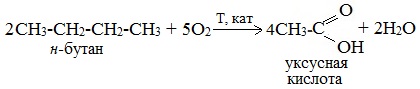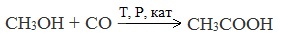Некоторые карбоновые кислоты встречаются в природе в свободном состоянии (муравьиная, уксусная, масляная, валериановая и др.). Однако, основным источником карбоновых кислот является органический синтез. Рассмотрим основные способы получения карбоновых кислот
- Общие способы получения карбоновых кислот
- В промышленности
- В лаборатории
- Специфические способы получения важнейших кислот
- Карбоновые кислоты
- Сложные эфиры карбоновых кислот: Получение, химические и физические свойства
- Сложные эфиры карбоновых кислот: Получение
- Сложные эфиры карбоновых кислот: Физические свойства
- 🎬 Видео
Общие способы получения карбоновых кислот
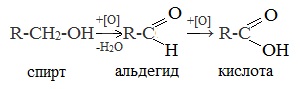
1. Окисление первичных спиртов и альдегидов под действием различных окислителей
В качестве окислителей применяют KMnO4 и K2Cr2O7.
Например:
Для окисления альдегидов используются те же реагенты, что и для спиртов.
При окислении перманганатом калия происходит обесцвечивание фиолетово-розового раствора.
При окислении дихроматом калия — цвет меняется с оранжевого на зеленый.
А также для них характерны реакции «серебряного зеркала» и окисление гидроксидом меди (II) – качественные реакции альдегидов:
2. Гидролиз галогензамещенных углеводородов, содержащих три атома галогена у одного атома углерода
В результате реакции образуются спирты, содержащие три группы ОН у одного атома углерода. Такие спирты неустойчивы и отщепляют воду с образованием карбоновой кислоты:
3. Получение карбоновых кислот из цианидов (нитрилов)
Этот способ позволяет наращивать углеродную цепь при получении исходного цианида. Дополнительный атом углерода вводят в состав молекулы, используя реакцию замещения галогена в молекуле галогенуглеводорода цианидом натрия:
Образующийся нитрил уксусной кислоты CH3-CN (ацетонитрил, метилцианид) при нагревании гидролизуется с образованием ацетата аммония:
При подкислении раствора выделяется кислота:
4. Использование реактива Гриньяра (по схеме)
5. Гидролиз галогенангидридов кислот
С водой низшие хлорангидриды реагируют чрезвычайно энергично, образуя соответствующую карбоновую кислоту и соляную кислоту:
В промышленности
1. Выделяют из природных продуктов
(жиров, восков, эфирных и растительных масел)
2. Окисление алканов кислородом воздуха ( в присутствии катализаторов – солей марганца или при нагревании под давлением)
Обычно образуется смесь кислот. При окислении бутана единственным продуктом является уксусная кислота:
3. Окисление алкенов и алкинов
При жестком окислении алкенов кипящим раствором KMnO4 в кислой среде происходит полный разрыв двойной связи:
При жестком окислении (нагревание, концентрированные растворы, кислая среда) происходит расщепление углеродного скелета молекулы алкина по тройной связи и образуются карбоновые кислоты:
4. Окисление гомологов бензола (получение бензойной кислоты)
Для получения бензойной кислоты можно использовать окисление монозамещенных гомологов бензола кислым раствором перманганата калия:
В лаборатории
1. Гидролиз сложных эфиров
При кислотном гидролизе получают карбоновые кислоты и спирты (реакция обратная этерификации):
2. Из солей карбоновых кислот
3. Гидролиз ангидридов кислот
При легком нагревании с водой ангидриды образуют соответствующие карбоновые кислоты:
4. Щелочной гидролиз галоген производных карбоновых кислот
Специфические способы получения важнейших кислот
Способы получения НСООН
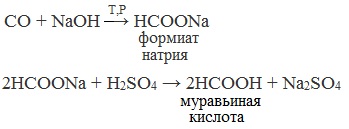
1. Взаимодействие оксида углерода (II) с гидроксидом натрия
Муравьиную кислоту получают нагреванием под давлением гидроксида натрия и оксида углерода (II) под давлением и обработкой полученного формиата натрия серной кислотой:
2. Каталитическое окисление метана
3. Декарбоксилирование щавелевой кислоты
Муравьиную кислоту можно получить при нагревании щавелевой кислоты:
Способы получения СН3СООН
Получение уксусной кислоты для химических целей
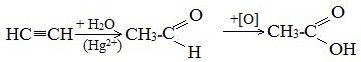
1. Синтез из ацетилена
Данный способ получения уксусной кислоты основан на окислении уксусного альдегида, который в свою очередь получают из ацетилена по реакции Кучерова (ацетилен получают из очень доступного сырья — метана):
2. Каталитическое окисление бутана
Большое значение имеет способ получения уксусной кислоты, основанный на окислении бутана кислородом воздуха:
Процесс получения уксусной кислоты из метана является многостадийным (метан – ацетилен – уксусный альдегид – уксусная кислота). Ее получение окислениям будана сокращает число стадий, что дает большой экономический эффект.
3. Каталитическое карбонилирование метанола
Получение уксусной кислоты для пищевых целей
4. Уксуснокислое брожение этанола
Уксусную кислоту для пищевых целей получают уксуснокислым брожением жидкостей, содержащих спирт (вино. пиво):
Видео:13.2. Сложные эфиры: Способы полученияСкачать

Карбоновые кислоты
Карбоновые кислоты — класс органических соединений, молекулы которых содержат одну или несколько карбоксильных групп COOH.
Имеют разнообразное промышленное применение и большое биологическое значение. Общая формула одноосновных карбоновых кислот CnH2nO2 .
Классификация карбоновых кислот
По количеству карбоксильных групп в молекуле карбоновые кислоты подразделяются на:
- Одноосновные — 1 карбоксильная группа
- Двухосновные — 2 карбоксильных группы
- Трехосновные — 3 карбоксильных группы
Высшие карбоновые кислоты называют жирными кислотами. Более подробно мы изучим их теме, посвященной жирам, в состав которых они входят.
Номенклатура и изомерия карбоновых кислот
Названия карбоновых кислот формируются путем добавления суффикса «овая» к названию алкана с соответствующим числом атомов углерода и слова кислота: метановая кислота, этановая кислота, пропановая кислота, и т.д.
Многие карбоновые кислоты имеют тривиальные названия. Наиболее известные:
- Метановая — HCOOH — муравьиная кислота
- Этановая — CH3-COOH — уксусная кислота
- Пропановая — C2H5-COOH — пропионовая кислота
- Бутановая — C3H7-COOH — масляная кислота
- Пентановая — C4H9-COOH — валериановая кислота
Для предельных карбоновых кислот характерна структурная изомерия: углеродного скелета, межклассовая изомерия со сложными эфирами.
Получение карбоновых кислот
- Окисление алканов
При повышенной температуре и в присутствии катализатора становится возможным неполное окисление алканов, в результате которого образуются кислоты.
При реакции спиртов с сильными окислителями, такими как подкисленный раствор перманганата калия, спирты окисляются до соответствующих кислот.
При окислении альдегиды образуют соответствующие карбоновые кислоты. Окисление можно проводить качественной реакцией на альдегиды — реакцией серебряного зеркала.
Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли.
Окисление альдегидов также может быть успешно осуществлено другим реагентом — свежеосажденным гидроксидом меди II. В результате такой реакции образуется осадок кирпично-красного цвета оксида меди I.
Существует специфический способ получения муравьиной кислоты, который заключается в реакции твердого гидроксида щелочного металла с угарным газом под давлением и температуре 200°С — образуется формиат (соль муравьиной кислоты).
При дальнейшей обработке формиата серной кислотой образуется муравьиная кислота.
Специфичность синтеза уксусной кислоты заключается в реакции угарного газа с метанолом, в результате которой она образуется.
Также уксусную кислоту можно получить другим путем: сначала провести реакцию Кучерова, в ходе которой образуется уксусный альдегид. Окислить его до уксусной кислоты можно аммиачным раствором оксида серебра или гидроксидом меди II.
Химические свойства карбоновых кислот
Для карбоновых кислот не характерны реакции присоединения. Карбоновые кислоты обладают более выраженными кислотными свойствами, чем спирты.
Карбоновые кислоты вступают в реакции с металлами, которые способны вытеснить водород (стоят левее водорода в ряду напряжений металлов) из кислоты. Реагируют также с основаниями, с солями более слабых кислот, например, угольной кислоты.
Галогенирование происходит по типу замещения в радикале, который соединен с карбоксильной группой. Напомню, что наиболее легко замещается водород у третичного, чуть сложнее — у вторичного, и значительно сложнее — у первичного атома углерода.
Сила карбоновых кислот тем выше, чем меньше электронной плотности сосредоточено на атоме углерода в карбоксильной группе. Поэтому самая слабая из трех кислот — уксусная, чуть сильнее — хлоруксусная, за ней — дихлоруксусная и самая сильная — трихлоруксусная.
Перераспределение электронной плотности в молекулах этих кислот для лучшего запоминания лучше увидеть наглядно. Это перераспределение обусловлено большей электроотрицательностью хлора, который притягивает электронную плотность.
Муравьиная кислота отличается от своих гомологов. За счет наличия у нее альдегидной группы, она, единственная из карбоновых кислот, способна вступать в реакцию серебряного зеркала.
В такой реакции идет ее окисление до нестойкой угольной кислоты, которая распадается на углекислый газ и воду.
При нагревании и в присутствии серной кислоты (водоотнимающего компонента) муравьиная кислота распадается на воду и угарный газ.
Сложные эфиры
Получение сложных эфиров происходит в реакции этерификации (лат. aether — эфир), заключающейся во взаимодействии карбоновой кислоты и спирта.
Названия сложных эфиров формируются в зависимости от того, какой кислотой и каким спиртом эфир образован. Примеры:
- Метановая кислота + метанол = метиловый эфир метановой кислоты (метилформиат)
- Этановая кислота + этанол = этиловый эфир уксусной кислоты (этилацетат)
- Метановая кислота + этанол = этиловый эфир метановой кислоты (этилформиат)
- Пропановая кислота + бутанол = бутиловый эфир пропионовой кислоты (бутилпропионат)
Для сложных эфиров характерной реакцией является гидролиз — их разложение. Возможен щелочной гидролиз, при котором образуется соль кислоты и спирт, и кислотный гидролиз, при котором образуются исходные спирт и кислота.
Кислотный гидролиз протекает обратимо, щелочной — необратимо. Реакция щелочного гидролиза по-другому называется реакция омыления, и напомнит о себе, когда мы дойдем до темы жиров.
Ангидриды
Ангидриды — химические соединения, производные неорганических и органических кислот, образующиеся при их дегидратации.
Хлорангидриды карбоновых кислот образуются в реакции карбоновых кислот с хлоридом фосфора V.
Следующая реакция не имеет отношения к ангидридам, однако (из-за их схожести) вы увидите ее здесь для наилучшего запоминания. Это реакция галогенирования гидроксикислот, в результате которой гидроксогруппа в радикале меняется на атом галогена.
Непредельные карбоновые кислоты
Распределение электронной плотности в молекулах творит чудеса: иногда реакции идут против правила Марковникова. Так происходит в непредельной акриловой кислоте.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Видео:11.2. Карбоновые кислоты: Способы получения. ЕГЭ по химииСкачать

Сложные эфиры карбоновых кислот: Получение, химические и физические свойства
Видео:Вся теория по карбоновым кислотам для ЕГЭ | Химия ЕГЭ для 10 класса | УмскулСкачать

Сложные эфиры карбоновых кислот: Получение
Сложные эфиры карбоновых кислот можно получить следующими способами:
- Этерификация карбоновых кислот:
- Этерификация амидов и нитрилов карбоновых кислот:
- Алкилирование солей карбоновых кислот:
- Ацилирование спиртов и алкоголятов галогенангидридами и ангидридами карбоновых кислот:
- Получение эфиров по Байеру-Виллигеру:
Видео:13.3. Сложные эфиры: Химические свойстваСкачать

Сложные эфиры карбоновых кислот: Физические свойства
Сложные эфиры, образованные низшими карбоновыми кислотами и спиртами являются летучими жидкостями. Многие из них имеют приятный запах цветов или фруктов.
В воде они практически нерастворимы. По сравнению с изомерными карбоновыми кислотами сложные эфиры имеют более низкие температуры кипения, т.к. их молекулы не связаны межмолекулярными водородными связями.
Сложные эфиры, образованные высшими жирными кислотами и спиртами имеют воскоподобную структуру. Это вещества не имеют запаха, нерастворимы в воде, но хорошо растворимы в органических растворителях.
🎬 Видео
Карбоновые кислоты и сложные эфиры | Демонеделя по химии | ЕГЭ 2024Скачать

РЕАКЦИЯ ЭТЕРИФИКАЦИИСкачать

Карбоновые кислоты. Химические свойства. Все 25 реакций ЕГЭ.Скачать

способы получения карбоновых кислотСкачать

Химические свойства карбоновых кислот | Химия ЕГЭ для 10 класса | УмскулСкачать

11.3. Карбоновые кислоты и их соли: Химические свойства. ЕГЭ по химииСкачать

Карбоновые кислоты. Получение. Химия 10 классСкачать

Гидролиз сложных эфировСкачать

Химия 9 класс (Урок№31 - Карбоновые кислоты. Сложные эфиры. Жиры.)Скачать

47. Простые и сложные эфиры (часть 1)Скачать

Получение альдегидов, карб кислот и эфировСкачать

Амиды, ангидриды, эфиры и ацилхлоридыСкачать

Все о получении карбоновых кислот за 45 минут | Химия ЕГЭ 10 класс | УмскулСкачать

Органика. Механизм реакции этерификации (карбоновая кислота + спирт)Скачать

производные карбоновых кислотСкачать

Сложные эфиры и мыла. 2 часть. 11 класс.Скачать