- Оксид цинка
- Способы получения
- Химические свойства
- Нитрат цинка
- Содержание
- Получение
- Физические свойства
- Нитрат цинка: состав, свойства, получение, применение.
- Содержание:
- Состав
- Номенклатура
- Свойства
- Физическое состояние
- Молекулярный вес
- Температура плавления
- Точка кипения
- Плотность
- Растворимость
- pH
- Химические свойства
- Получение
- Приложения
- В катализе реакций
- В композитных полимерах
- В оксидных цементах
- В покрытиях из оксида цинка и наноматериалах
- В гербицидах
- В производстве анодов
- Другие приложения
- Возможное использование в инженерии костной ткани
- Риски
- Напишите уравнение реакций, с помощью которых можно осуществить цепь превращений веществ :цинк — оксид цинка — сульфат цинка — нитрат цинка — гидроксид цинка — хлорид цинкабуду благодарна?
- В реакции обмена не вступают : а) цинк оксид ; б) цинк ; в) цинк гидроксид ; г) цинк хлорид?
- Цинк → оксид цинка → хлорид цинка → гилроксид цинка→ нитрат цинка — Х?
- Гидроксид цинка образуется при взаимодействии1 оксида цинка с водой2 оксида цинка с гидроксидом натрия3 хлорида цинка с гидроксидом меди (2)4 раствора хлорида цинка с раствором гидроксида натрия?
- Записать уравнения реакций :Литий — >гидроксид лития — >гидроксид цинка — >оксид цинка — >сульфат цинка?
- Составить уравнения реакций, при помощи которых можно сделать превращения :Хлорид цинка — — гидроксид цинка — — цинкат калия — — сульфат цинка — — гидроксид цинка — — оксид цинка?
- Напишите уравнение реакций отвечающие следующей цепочке превращений цинк — судьфИт цинка — гидроксид цинка?
- Какое вещество реагирует с водным раствором хлорида меди (||) :1) сульфат цинка2)оксид цинка3)гидроксид цинка4)цинк?
- Какое вещество реагирует с водным раствором хлорида меди (||) :1) сульфат цинка2)оксид цинка3)гидроксид цинка4)цинк?
- Запишите уравнение реакций для цепочки превращений : Цинк = > Оксид цинка = > Цинкат калия ; Нитрат цинка = > Гидроксид цинка = > 1) Оксид цинка 2) цинкат калия?
Оксид цинка
Способы получения
Оксид цинка можно получить различными методами :
1. Окислением цинка кислородом:
2Zn + O2 → 2ZnO
2. Разложением гидроксида цинка при нагревании:
3. Оксид цинка можно получить разложением нитрата цинка :
Химические свойства
Оксид цинка — типичный амфотерный оксид . Взаимодействует с кислотными и основными оксидами, кислотами, щелочами.
1. При взаимодействии оксида цинка с основными оксидами образуются соли-цинкаты.
Например , оксид цинка взаимодействует с оксидом натрия:
2. Оксид цинка взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—цинкаты, а в растворе – комплексные соли . При этом оксид цинка проявляет кислотные свойства.
Например , оксид цинка взаимодействует с гидроксидом натрия в расплаве с образованием цинката натрия и воды:
Оксид цинка растворяется в избытке раствора щелочи с образованием тетрагидроксоцинката:
3. Оксид цинка не взаимодействует с водой.
ZnO + H2O ≠
4. Оксид цинка взаимодействует с кислотными оксидами . При этом образуются соли цинка. В этих реакциях оксид цинка проявляет основные свойства.
Например , оксид цинка взаимодействует с оксидом серы (VI) с образованием сульфата цинка:
5. Оксид цинка взаимодействует с растворимыми кислотами с образованием солей.
Например , оксид цинка реагирует с соляной кислотой:
ZnO + 2HCl = ZnCl2 + H2O
6. Оксид цинка проявляет слабые окислительные свойства .
Например , оксид цинка при нагревании реагирует с водородом и угарным газом:
ZnO + С(кокс) → Zn + СО
ZnO + СО → Zn + СО2
7. Оксид цинка — твердый, нелетучий. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Например , из карбоната бария:
Видео:Опыты по химии. Амфотерность гидроксида цинкаСкачать

Нитрат цинка
| Нитрат цинка | |
|---|---|
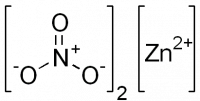 | |
| Систематическое наименование | Нитрат цинка |
| Традиционные названия | Азотнокислый цинк |
| Хим. формула | Zn(NO3)2 |
| Состояние | бесцветные кристаллы |
| Молярная масса | 189,40 г/моль |
| Растворимость | |
| • в воде | 128 25 ; 1250 73 г/100 мл |
| ГОСТ | ГОСТ 5106-77 |
| Рег. номер CAS | 7779-88-6 |
| PubChem | 24518 |
| Рег. номер EINECS | 231-943-8 |
| SMILES | |
| RTECS | ZH4772000 |
| Номер ООН | 1514 |
| ChemSpider | 22926 и 57426206 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Нитрат цинка — неорганическое соединение, соль металла цинка и азотной кислоты с формулой Zn(NO3)2, бесцветные кристаллы, растворяется в воде, образует кристаллогидраты.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Содержание
Видео:КАК СДЕЛАТЬ ОКСИД ЦИНКАСкачать

Получение
- Кристаллогидраты получают реакцией оксида, гидроксида или карбоната цинка с азотной кислотой:
ZnO + 2HNO3 → Zn(NO3)2 + H2O Zn(OH)2 + 2HNO3 → Zn(NO3)2 + 2 H2O ZnCO3 + 2HNO3 → Zn(NO3)2 + CO2↑ + H2O
- Безводную соль получают реакцией металлического цинка с диоксидом азота в ацетонитриле:
Zn + 2N2O4 → Zn(NO3)2 + 2NO↑
Видео:Опыты по химии. Растворение цинка в кислотах и щелочахСкачать

Физические свойства
Нитрат цинка образует бесцветные кристаллы.
Хорошо растворяется в воде и этаноле.
Образует кристаллогидраты состава Zn(NO3)2•n H2O, где n = 1, 2, 4, 6 и 9.
С аммиаком образует аддукты с общей формулой Zn(NO3)2•n NH3.
Видео:Гидролиз солей. 9 класс.Скачать

Нитрат цинка: состав, свойства, получение, применение.
Нитрат цинка: состав, свойства, получение, применение. — Наука
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Содержание:
В нитрат цинка Это неорганическое соединение, образованное элементами цинка (Zn), азота (N) и кислорода (O). Степень окисления цинка +2, азота +5 и кислорода -2.
Его химическая формула — Zn (NO3)2. Это бесцветное кристаллическое твердое вещество, которое имеет тенденцию поглощать воду из окружающей среды. Его можно получить, обработав металлический цинк разбавленной азотной кислотой. Это сильно окисляющее соединение.
Он служит ускорителем реакций органической химии и позволяет получать композитные полимеры с электропроводящими свойствами. Он используется для формирования слоев материалов, используемых в электронике.
Он входит в состав некоторых жидких удобрений и некоторых гербицидов с медленным высвобождением. Помогает в получении сложных оксидов, улучшая их плотность и электропроводность.
Он был успешно протестирован при получении структур, которые служат основой для регенерации и роста костной ткани, улучшают этот процесс и являются эффективным антибактериальным средством.
Хотя он негорючий, он может ускорить горение таких веществ, как уголь или органические материалы. Он раздражает кожу, глаза и слизистые оболочки и очень токсичен для водных организмов.
Видео:Качественная реакция ионов цинка со щелочью. Получение и свойства гидроксида цинкаСкачать

Состав
Нитрат цинка — ионное соединение. Имеет двухвалентный катион (Zn 2+ ) и два одновалентных аниона (NO3 – ). Нитрат-анион — это многоатомный ион, образованный атомом азота в степени окисления +5, ковалентно связанным с тремя атомами кислорода с валентностью -2.
На изображении ниже показана пространственная структура этого соединения. Центральная серая сфера — это цинк, синие сферы — азот, а красные сферы — кислород.
Видео:ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Номенклатура
- Нитрат цинка
- Динитрат цинка
Видео:ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Свойства
Видео:Никель - Ni. Реакция Сульфата Никеля и Цинка. Реакция NiSO4 и Zn. Получение Никеля.Скачать

Физическое состояние
Бесцветное или белое кристаллическое твердое вещество.
Видео:Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

Молекулярный вес
Видео:8 класс. Массовая доля растворенного вещества. Решение задач.Скачать

Температура плавления
Примерно 110 ºC.
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Точка кипения
Примерно 125 ºC.
Видео:Цинк и его соединения. Химия, ЕГЭСкачать

Плотность
Видео:Zn + 2HCl → ZnCl2 + H2 | Реакция цинка и соляной кислотыСкачать

Растворимость
Растворим в воде: 120 г / 100 г H2Или при 25 ° С. Растворим в спирте.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

pH
Его водные растворы кислые. 5% раствор имеет pH примерно 5.
Видео:Химическая реакция йода и алюминия.Скачать

Химические свойства
Будучи нитратом, это соединение является сильным окислителем. Реагирует бурно с углеродом, медью, сульфидами металлов, органическими веществами, фосфором и серой. Если его распылить на раскаленный уголь, он взорвется.
С другой стороны, он гигроскопичен и впитывает воду из окружающей среды. При нагревании образует оксид цинка, диоксид азота и кислород:
В щелочных растворах, таких как NaOH, цинк в этом соединении образует гидроксид и другие сложные формы:
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Получение
Его можно получить обработкой цинка или оксида цинка разбавленной азотной кислотой. В этой реакции образуется газообразный водород.
Видео:Решение упражнений Амфотерные соединенияСкачать

Приложения
Видео:Термит. Термитные составы. Металлотермия. 25+ реакций термитных (и не очень) смесей.Скачать

В катализе реакций
Он используется в качестве катализатора для получения других химических соединений, таких как смолы и полимеры. Это кислотный катализатор.
Другой случай ускорения реакций — каталитическая система Zn (NO3)2/ VOC2ИЛИ4, который позволяет окислять α-гидроксиэфиры до α-кетоэфиров с конверсией 99% даже при атмосферном давлении и температуре.
В композитных полимерах
Полиметилметакрилат и Zn (NO3)2 со свойствами электропроводности, которые делают их подходящими кандидатами для использования в суперконденсаторах и высокоскоростных компьютерах.
В оксидных цементах
С помощью водных растворов нитрата цинка и порошка оксида цинка получают материалы, которые относятся к классу цементов, образующихся в результате кислотно-щелочной реакции.
Они обладают разумной устойчивостью к растворению в разбавленных кислотах и щелочах, развивая сопротивление сжатию, сравнимое с сопротивлением других цементов, таких как оксихлориды цинка.
Это свойство увеличивается по мере того, как ZnO / Zn (NO3)2, а как концентрация Zn (NO3)2 в растворе. Полученные цементы полностью аморфны, то есть не имеют кристаллов.
В покрытиях из оксида цинка и наноматериалах
Zn (НЕТ3)2 Он используется для электролитического осаждения очень тонких слоев оксида цинка (ZnO) на различные подложки. Наноструктуры из этого оксида также изготавливаются на поверхностях.
ZnO представляет собой материал, представляющий большой интерес из-за множества применений в области оптоэлектроники, он также обладает полупроводниковыми свойствами и используется в датчиках и преобразователях.
В гербицидах
Нитрат цинка использовался в сочетании с некоторыми органическими соединениями для замедления скорости высвобождения определенных гербицидов в воду. Медленный выпуск этих продуктов позволяет им оставаться доступными в течение более длительного времени и требует меньшего количества приложений.
В производстве анодов
Он стимулирует процесс спекания и улучшает плотность некоторых оксидов, которые используются для изготовления анодов для топливных элементов. Спекание — это получение твердого материала путем нагревания и сжатия порошка без его плавления.
Испытанные материалы представляют собой сложные оксиды стронция, иридия, железа и титана. Присутствие цинка значительно увеличивает их электропроводность.
Другие приложения
Используется при получении лекарств. Он действует как протрава при нанесении чернил и красителей. Служит латексным коагулянтом. Это источник цинка и азота в жидких удобрениях.
Возможное использование в инженерии костной ткани
Этот состав использовался в качестве добавки при разработке каркасов или каркасов для регенерации костных волокон, поскольку он позволяет улучшить механическое сопротивление этих структур.
Было обнаружено, что цинкосодержащий каркас не токсичен для клеток-остеопрогениторов, поддерживает активность остеобластов, клеток, образующих кость, и улучшает их адгезию и пролиферацию.
Он способствует образованию апатита, минерала, образующего кости, а также обладает антибактериальным действием.
Риски
Это материал с потенциальной опасностью пожара и взрыва.
Он не горюч, но ускоряет горение горючих материалов. При попадании большого количества этого соединения в пожар или если горючий материал мелко измельчается, может произойти взрыв.
При воздействии сильной жары выделяются токсичные газы оксидов азота. А если выдерживать длительное время, она может взорваться.
Он раздражает кожу, может вызвать серьезное повреждение глаз, раздражение дыхательных путей, токсичен при проглатывании и вызывает повреждение пищеварительного тракта.
Очень токсично для водных организмов с долгосрочными последствиями.
Напишите уравнение реакций, с помощью которых можно осуществить цепь превращений веществ :цинк — оксид цинка — сульфат цинка — нитрат цинка — гидроксид цинка — хлорид цинкабуду благодарна?
Химия | 5 — 9 классы
Напишите уравнение реакций, с помощью которых можно осуществить цепь превращений веществ :
цинк — оксид цинка — сульфат цинка — нитрат цинка — гидроксид цинка — хлорид цинка
1) 2Zn + O2 = 2ZnO
2)ZnO + H2SO4 = ZnSO4 + H2O
3)ZnSO4 + 2HNO3 = Zn(NO3)2 + H2SO4
4)Zn(NO3)2 + 2H2O = Zn(OH)2 + 2HNO3
5)Zn(OH)2 + 2HCl = ZnCl2 + 2H2O.
В реакции обмена не вступают : а) цинк оксид ; б) цинк ; в) цинк гидроксид ; г) цинк хлорид?
В реакции обмена не вступают : а) цинк оксид ; б) цинк ; в) цинк гидроксид ; г) цинк хлорид.
= > гидроксид цинка = > хлорид цинка = > цинк
Как найти неизвестное?
Цинк → оксид цинка → хлорид цинка → гилроксид цинка→ нитрат цинка — Х?
Цинк → оксид цинка → хлорид цинка → гилроксид цинка→ нитрат цинка — Х.
Гидроксид цинка образуется при взаимодействии1 оксида цинка с водой2 оксида цинка с гидроксидом натрия3 хлорида цинка с гидроксидом меди (2)4 раствора хлорида цинка с раствором гидроксида натрия?
Гидроксид цинка образуется при взаимодействии
1 оксида цинка с водой
2 оксида цинка с гидроксидом натрия
3 хлорида цинка с гидроксидом меди (2)
4 раствора хлорида цинка с раствором гидроксида натрия.
Записать уравнения реакций :Литий — >гидроксид лития — >гидроксид цинка — >оксид цинка — >сульфат цинка?
Записать уравнения реакций :
Литий — >гидроксид лития — >гидроксид цинка — >оксид цинка — >сульфат цинка.
Заранее спасибо большое!
Составить уравнения реакций, при помощи которых можно сделать превращения :Хлорид цинка — — гидроксид цинка — — цинкат калия — — сульфат цинка — — гидроксид цинка — — оксид цинка?
Составить уравнения реакций, при помощи которых можно сделать превращения :
Хлорид цинка — — гидроксид цинка — — цинкат калия — — сульфат цинка — — гидроксид цинка — — оксид цинка.
Напишите уравнение реакций отвечающие следующей цепочке превращений цинк — судьфИт цинка — гидроксид цинка?
Напишите уравнение реакций отвечающие следующей цепочке превращений цинк — судьфИт цинка — гидроксид цинка.
Какое вещество реагирует с водным раствором хлорида меди (||) :1) сульфат цинка2)оксид цинка3)гидроксид цинка4)цинк?
Какое вещество реагирует с водным раствором хлорида меди (||) :
1) сульфат цинка
Какое вещество реагирует с водным раствором хлорида меди (||) :1) сульфат цинка2)оксид цинка3)гидроксид цинка4)цинк?
Какое вещество реагирует с водным раствором хлорида меди (||) :
1) сульфат цинка
Запишите уравнение реакций для цепочки превращений : Цинк = > Оксид цинка = > Цинкат калия ; Нитрат цинка = > Гидроксид цинка = > 1) Оксид цинка 2) цинкат калия?
Запишите уравнение реакций для цепочки превращений : Цинк = > Оксид цинка = > Цинкат калия ; Нитрат цинка = > Гидроксид цинка = > 1) Оксид цинка 2) цинкат калия.
На этой странице сайта вы найдете ответы на вопрос Напишите уравнение реакций, с помощью которых можно осуществить цепь превращений веществ :цинк — оксид цинка — сульфат цинка — нитрат цинка — гидроксид цинка — хлорид цинкабуду благодарна?, относящийся к категории Химия. Сложность вопроса соответствует базовым знаниям учеников 5 — 9 классов. Для получения дополнительной информации найдите другие вопросы, относящимися к данной тематике, с помощью поисковой системы. Или сформулируйте новый вопрос: нажмите кнопку вверху страницы, и задайте нужный запрос с помощью ключевых слов, отвечающих вашим критериям. Общайтесь с посетителями страницы, обсуждайте тему. Возможно, их ответы помогут найти нужную информацию.
W = m (в — ва) / m (смеси)w = Ar (э) * n / Mrw( Al2O3) = 27 * 2 / 27 * 2 + 16 * 3 = 54 / 102 = 0, 53 = 53 %следовательно кислорода 47%w( P2S5) = 31 * 2 / 31 * 2 + 32 * 5 = 62 / 160 = 0, 39 = 39 %следовательно cеры 61%w( Fe3O4) = 56 * 3 / 56 * 3 + 16 ..
Я бы помогла но нет картинки или точного вопроса.
Дано : m(Zn) = 26г m(H2SO4) = 20г w(H2SO4) = 49% Vm = 22. 4 л / моль Найти : V(H2) Решение : Zn + H2SO4 = H2 + ZnSO4 __ __ 1моль. 1моль M(Zn) = Mr(Zn) = 65г / моль n(Zn) = 26 / 65 = 0. 4моль n(H2) = 0. 4 * 1 / 1 = 0. 4моль V(H2) = 22. 4 * 0. 4..
Дано : H2SO4Найти : W(H), W(S), W(O). Решение : Mr(H2SO4) = 2 * 1 + 32 + 4 * 16 = 98г / мольТеперь рассчитаем массовые доли каждого из элементов : W(H) = (2 * 1) / 98 = 2, 04%W(S) = 32 / 98 = 32, 65%W(O) = (4 * 16) / 98 = 65, 3%.
Во втором задании P4O10 каждый атом P должен быть связан двойной связью с 1 атом O и с оставшимися 3 атомами P через кислородный мостик.
1Al2O3, Cl207, Na2O, FeO, SO3.
2Mg + O2 = 2MgO n(Mg) = 50 / 24 = 2. 1моль 2. 1 / 2 = x / 2 x = 2. 1 M(MgO) = 16 + 24 = 40г / моль m(MgO) = 40 * 2. 1 = 84г.
К солям относятся : 2, 3, 4.
Связь будет ионная, так как соединение металла и не металла.
1) CaO + CO2 = CaCO3 2) CaCO3 + H2O + CO2 = Ca(HCO3)2 3) Ca(HCO3)2 + Ca(OH)2 = 2CaCO3 + 2H2O 4) CaCO3 + 2HNO3 = Ca(HNO3)2 + H2O + CO2.











