Оксид меди (II)
Оксид меди (II) CuO – твердое кристаллическое вещество черного цвета.
Способы получения оксида меди (II)
Оксид меди (II) можно получить различными методами :
1. Термическим разложением гидроксида меди (II) при 200°С :
2. В лаборатории оксид меди (II) получают окислением меди при нагревании на воздухе при 400–500°С:
2Cu + O2 → 2CuO
3. В лаборатории оксид меди (II) также получают прокаливанием солей (CuOH)2CO3, Cu(NO3)2:
Химические свойства оксида меди (II)
Оксид меди (II) – основный оксид (при этом у него есть слабо выраженные амфотерные свойства) . При этом он является довольно сильным окислителем.
1. При взаимодействии оксида меди (II) с сильными и растворимыми кислотами образуются соли.
Например , оксид меди (II) взаимодействует с соляной кислотой:
СuO + 2HBr = CuBr2 + H2O
CuO + 2HCl = CuCl2 + H2O
2. Оксид меди (II) вступает в реакцию с кислотными оксидами.
Например , оксид меди (II) взаимодействует с оксидом серы (VI) с образованием сульфата меди (II):
3. Оксид меди (II) не взаимодействует с водой.
4. В окислительно-восстановительных реакциях соединения меди (II) проявляют окислительные свойства:
Например , оксид меди (II) окисляет аммиак :
3CuO + 2NH3 → 3Cu + N2 + 3H2O
Оксид меди (II) можно восстановить углеродом, водородом или угарным газом при нагревании:
СuO + C → Cu + CO
Более активные металлы вытесняют медь из оксида.
Например , алюминий восстанавливает оксид меди (II):
3CuO + 2Al = 3Cu + Al2O3
Видео:8 класс. Химия. Как получить оксид меди (ll).Скачать

как из нитрата меди два получить медь
Медь из раствора нитрата меди (достаточно чистую! ) можно получить электролизом раствора:
Электролиз раствора нитрата меди (II):
Cu(NO3)2—> Cu(2+) +
Н2O—> H(+) + OH(–);
катод (–) (Cu2+; Н+): Cu(2+) + 2е = Cu(0),
анод (+) ( OН–): OH(–) – е = OH(0),
4H(0) = O2 + 2H2O;
В растворе накапливаются ионы водорода H(+) и анионы кислотного остатка NO3(-), которые образуют азотную кислоту.
2Cu(NO3)2 + 2H2O = 2Cu + O2 + 4HNO3.
Таким образом, в результате электролиза раствора нитрата меди получается чистая металлическая медь, кислород и азотная кислота
Термическим разложением кристаллического нитрата меди саму медь получить не удастся, т. к. в результате такого разложения образуется не медь, а оксид меди черного цвета CuO, бурый газ NО2 и кислород.
Видео:Получение нитрата меди(Cu(NO3)2)Скачать

Оксид меди (I, II, III): свойства, получение, применение
Как вам известно, в химии существует четыре класса неорганических соединений. Веществ, представляющих каждый из них, очень много, но лидирующее положение, несомненно, занимают оксиды. У одного химического элемента может быть сразу несколько разных бинарных соединений с кислородом. Такое свойство имеет и медь. У нее существует три оксида. Давайте рассмотрим их детальнее.
Оксид меди (I)
Его формула — Cu2O. В некоторых источниках данное соединение могут называть гемиоксидом меди, оксидом димеди или закисью меди.
Свойства
Является кристаллическим веществом, имеющим коричнево-красный цвет. Этот оксид не растворяется в воде и этиловом спирте. Может плавиться, не разлагаясь, при температуре чуть больше 1240 о С. Данное вещество не взаимодействует с водой, но может переводиться в раствор, если участниками реакции с ним будут концентрированные хлоровородная кислота, щелочь, азотная кислота, гидрат аммиака, соли аммония, серная кислота.
Получение оксида меди (I)
Его можно получить, нагрев металлическую медь, или в такой среде, где кислород имеет малую концентрацию, а также в токе некоторых оксидов азота и вместе с оксидом меди (II). Кроме того, он может стать продуктом реакции термического разложения последнего. Оксид меди (I) получится и в том случае, если нагреть сульфид меди (I) в токе кислорода. Есть и другие, более сложные способы его получения (например, восстановление одного из гидроксидов меди, ионный обмен любой соли одновалентной меди с щелочью и т.п.), но их практикуют только в лабораториях.
Применение
Нужен в качестве пигмента, когда окрашивают керамику, стекло; компонента красок, которые защищают подводную часть судна от обрастания. Используется также как фунгицид. Без него не обходятся и меднозакисные вентили.
Оксид меди (II)
Его формула — CuO. Во многих источниках может встречаться под названием окиси меди.
Свойства
Это высший оксид меди. Вещество имеет вид черных кристаллов, которые почти не растворяются в воде. Взаимодействует с кислотой и при этой реакции образует соответствующую соль двухвалентной меди, а также воду. При его сплавлении с щелочью продукты реакции представлены купратами. Разложение оксида меди (II) происходит при температуре около 1100 о С. Аммиак, монооксид углерода, водород и уголь способны извлекать из этого соединения металлическую медь.
Получение
Его можно получить при нагревании металлической меди в воздушной среде при одном условии — температура нагревания должна быть ниже 1100 о С. Также оксид меди (II) может получиться, если нагреть карбонат, нитрат, двухвалентный гидроксид меди.
Применение
С помощью данного оксида окрашивают в зеленый или синий цвет эмаль и стекло, а также производят медно-рубиновую разновидность последнего. В лаборатории этим оксидом обнаруживают восстановительные свойства веществ.
Оксид меди (III)
Его формула — Cu2O3. Имеет традиционное название, которое звучит, наверное, немного необычно — окисел медь.
Свойства
Имеет вид красных кристаллов, не растворяющихся в воде. Разложение этого вещества происходит при температуре 400 о С, продукты данной реакции — оксид меди (II) и кислород.
Получение
Его можно получить, окисляя двухвалентный гидроксид меди с помощью пероксидисульфата калия. Необходимое условие реакции — щелочная среда, в которой она должна происходить.
Применение
Данное вещество само по себе не используется. В науке и промышленности более широкое распространение находят продукты его разложения — оксид меди (II) и кислород.
Заключение
Вот и все оксиды меди. Их несколько из-за того, что медь имеет переменную валентность. Существуют и другие элементы, у которых есть по несколько оксидов, но о них поговорим в другой раз.
🎥 Видео
Качественная реакция на оксид медиСкачать

🔥 Оксид меди 2. Получение двухвалентного оксида меди [CuO]- Preparation of bivalent copper oxide.Скачать
![🔥 Оксид меди 2. Получение двухвалентного оксида меди [CuO]- Preparation of bivalent copper oxide.](https://i.ytimg.com/vi/sP6je5DSl9c/0.jpg)
На что способна ЗАКИСЬ МЕДИ?Скачать

Термическое разложение нитрата меди | Cu(NO3)2 = CuO + 2NO2 + O2Скачать

ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Получение оксида меди(1) - Cu2O. Реакция сульфата меди и сульфита натрия. Реакция CuSO4 и Na2SO3Скачать

Заканчиваем решать 13-й вариант сборника Добротина (номера 29-34)Скачать

Получение ЗАКИСИ МЕДИ!Скачать

Получение Оксида Кальция - CaO. Разложение Нитрата Кальция - Ca(NO3)2Скачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

оксид меди + соляная кислотаСкачать

получение оксида и гидроксида медиСкачать

Опыты по химии. Качественные реакции на нитрат-ион: взаимодействие нитрата с медью и серной кислотойСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Разложение нитратовСкачать
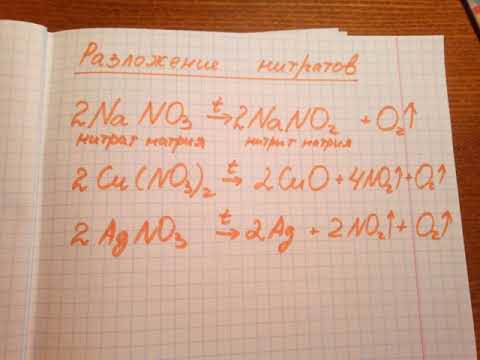
Опыты по химии. Получение гидроксида меди (II) и изучение его свойствСкачать

Опыты по химии. Взаимодействие угля и оксида меди (II)Скачать



