- Строение молекулы и физические свойства
- Способы получения
- Химические свойства
- Основные способов получения азотной кислоты
- Нитраты. Нитриты
- Получение азотной кислоты в домашних условиях: как обращаться с реагентами
- Где используется вещество?
- Способ 1
- Способ 2
- Особенности метода выпаривания
- Инструменты и реагенты для практического получения вещества
- 💥 Видео
Видео:Получение концентрированной азотной кислотыСкачать

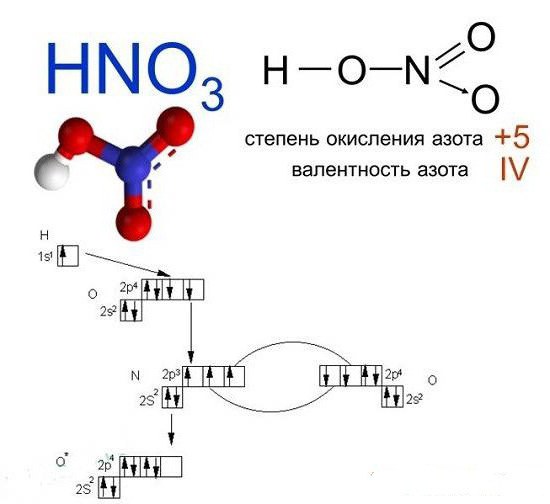
Строение молекулы и физические свойства
Азотная кислота HNO3 – это сильная одноосновная кислота-гидроксид. При обычных условиях бесцветная, дымящая на воздухе жидкость, температура плавления −41,59 °C, кипения +82,6 °C ( при нормальном атмосферном давлении). Азотная кислота смешивается с водой во всех соотношениях. На свету частично разлагается.
Валентность азота в азотной кислоте равна IV, так как валентность V у азота отсутствует. При этом степень окисления атома азота равна +5. Так происходит потому, что атом азота образует 3 обменные связи и одну донорно-акцепторную, является донором электронной пары.
Поэтому строение молекулы азотной кислоты можно описать резонансными структурами:
Обозначим дополнительные связи между азотом и кислородом пунктиром. Этот пунктир по сути обозначает делокализованные электроны. Получается формула:
Видео:Синтез азотной кислоты из нитрата калияСкачать

Способы получения
В лаборатории азотную кислоту можно получить разными способами:
1. Азотная кислота образуется при действии концентрированной серной кислоты на твердые нитраты металлов. При этом менее летучая серная кислота вытесняет более летучую азотную.
Например , концентрированная серная кислота вытесняет азотную из кристаллического нитрата калия:
2. В промышленности азотную кислоту получают из аммиака . Процесс осуществляется постадийно.
1 стадия. Каталитическое окисление аммиака.
2 стадия. Окисление оксида азота (II) до оксида азота (IV) кислородом воздуха.
3 стадия. Поглощение оксида азота (IV) водой в присутствии избытка кислорода.
Видео:Разложение нитрата калия при нагревании. Реакция нитрата калия с углем - 9 - 11 классСкачать

Химические свойства
Азотная кислота – это сильная кислота . За счет азота со степенью окисления +5 азотная кислота проявляет сильные окислительные свойства .
1. Азотная кислота практически полностью диссоциирует в водном растворе.
2. Азотная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например , азотная кислота взаимодействует с оксидом меди (II):
Еще пример : азотная кислота реагирует с гидроксидом натрия:
3. Азотная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов, сульфитов).
Например , азотная кислота взаимодействует с карбонатом натрия:
4. Азотная кислота частично разлагается при кипении или под действием света:
5. Азотная кислота активно взаимодействует с металлами. При этом никогда не выделяется водород! При взаимодействии азотной кислоты с металлами окислителем всегда выступает азот +5. Азот в степени окисления +5 может восстанавливаться до степеней окисления -3, 0, +1, +2 или +4 в зависимости от концентрации кислоты и активности металла.
металл + HNO3 → нитрат металла + вода + газ (или соль аммония)
С алюминием, хромом и железом на холоду концентрированная HNO3 не реагирует – кислота «пассивирует» металлы, т.к. на их поверхности образуется пленка оксидов, непроницаемая для концентрированной азотной кислоты. При нагревании реакция идет. При этом азот восстанавливается до степени окисления +4:
Золото и платина не реагируют с азотной кислотой, но растворяются в «царской водке» – смеси концентрированных азотной и соляной кислот в соотношении 1 : 3 (по объему):
HNO3 + 3HCl + Au → AuCl3 + NO + 2H2O
Концентрированная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (IV), азот восстанавливается минимально:
С активными металлами (щелочными и щелочноземельными) концентрированная азотная кислота реагирует с образованием оксида азота (I):
Разбавленная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (II).
С активными металлами (щелочными и щелочноземельными), а также оловом и железом разбавленная азотная кислота реагирует с образованием молекулярного азота:
При взаимодействии кальция и магния с азотной кислотой любой концентрации (кроме очень разбавленной) образуется оксид азота (I):
Очень разбавленная азотная кислота реагирует с металлами с образованием нитрата аммония:
Таблица . Взаимодействие азотной кислоты с металлами.
| Азотная кислота | ||||
| Концентрированная | Разбавленная | |||
| с Fe, Al, Cr | с неактивными металлами и металлами средней активности (после Al) | с щелочными и щелочноземельными металлами | с неактивными металлами и металлами средней активности (после Al) | с металлами до Al в ряду активности, Sn, Fe |
| пассивация при низкой Т | образуется NO2 | образуется N2O | образуется NO | образуется N2 |
6. Азотная кислота окисляет и неметаллы (кроме кислорода, водорода, хлора, фтора и некоторых других). При взаимодействии с неметаллами HNO3 обычно восстанавливается до NO или NO2, неметаллы окисляются до соответствующих кислот, либо оксидов (если кислота неустойчива).
Например , азотная кислота окисляет серу, фосфор, углерод, йод:
Безводная азотная кислота – сильный окислитель. Поэтому она легко взаимодействует с красным и белым фосфором . Реакция с белым фосфором протекает очень бурно. Иногда она сопровождается взрывом.
Видеоопыт взаимодействия фосфора с безводной азотной кислотой можно посмотреть здесь.
Видеоопыт взаимодействия угля с безводной азотной кислотой можно посмотреть здесь.
7. Концентрированная а зотная кислота окисляет сложные вещества (в которых есть элементы в отрицательной, либо промежуточной степени окисления): сульфиды металлов, сероводород, фосфиды, йодиды, соединения железа (II) и др. При этом азот восстанавливается до NO2, неметаллы окисляются до соответствующих кислот (или оксидов), а металлы окисляются до устойчивых степеней окисления.
Например , азотная кислота окисляет оксид серы (IV):
Еще пример : азотная кислота окисляет иодоводород:
Сера в степени окисления -2 окисляется без нагревания до простого вещества, при нагревании до серной кислоты.
Например , сероводород окисляется азотной кислотой без нагревания до молекулярной серы:
При нагревании до серной кислоты:
Соединения железа (II) азотная кислота окисляет до соединений железа (III):
8. Азотная кислота окрашивает белки в оранжево-желтый цвет («ксантопротеиновая реакция«).
Ксантопротеиновую реакцию проводят для обнаружения белков, содержащих в своем составе ароматические аминокислоты. К раствору белка прибавляем концентрированную азотную кислоту. Белок свертывается. При нагревании белок желтеет. При добавлении избытка аммиака окраска переходит в оранжевую.
Видеоопыт обнаружения белков с помощью азотной кислоты можно посмотреть здесь.
Видео:Разложение нитратов (солей азотной кислоты)Скачать

Основные способов получения азотной кислоты
Задача 904.
Указать химические реакции, в результате которых из природных веществ получают в настоящее время азотную кислоту.
Решение:
а) Современные промышленные способы получения азотной кислоты основаны на каталитическом окислении аммиака кислородом воздуха. Аммиак получают фиксацией атмосферного азота водородом. Реакция между азотом и водородом протекает при высокой температуре, давлении и в присутствии катализатора:
Затем аммиак окисляют кислородом воздуха при нагревании и в присутствии катализатора:
Образовавшийся NO легко переходит в NO2:
Оксид NO2 с водой даёт азотную кислоту:
б) Существует способ получения азотной кислоты из селитры:
в) Существуют заводы, которые используют для получения азотной кислоты аммиак, как побочный продукт коксования каменного угля (газовая вода) и при карбидном получении аммиака:
Задача 905.
Почему при получении азотной кислоты из селитры необходимо брать концентрированную серную кислоту, а селитру — в виде твердого вещества? Почему реакционную смесь нельзя сильно нагревать?
Решение:
При получении азотной кислоты из селитры протекает реакция:
Из уравнения реакции следует, что образуется азотная кислота и сульфат натрия, которые в водном растворе будут полностью диссоциированы на ионы:
В водном растворе связывание ионов Н + и NO3 – , Na + и SO2 — не происходит, т. е. реакция обмена в водном растворе практически не происходит. Поэтому для получения азотной кислоты из селитры необходимо процесс проводить в неводном растворе или проводить процесс с твёрдой селитрой и безводной (концентрированной) серной кислотой.
Реакционную смесь нельзя сильно нагревать, потому что при нагревании селитра разлагается с образованием нитрита натрия и кислорода:
2NaNO3 
Образуемый при этом нитрит натриz разлагается на Na2O, NO и NO2:
2NaNO2 
Видео:Синтез АЗОТНОЙ КИСЛОТЫ. Реакция НИТРАТА КАЛИЯ и КОНЦЕНТРИРОВАННОЙ СЕРНОЙ КИСЛОТЫ.Опыты по химии домаСкачать

Нитраты. Нитриты
Задача 906.
Какова термическая устойчивость нитратов и нитритов? Что происходит при нагревании следующих солей: NaNO2, Рb(NO2)2, NH4NO2, NaNO3, Рb(NO3)2, АgNO3, NH4NO3? Написать уравнения протекающих реакций.
Решение:
Соли азотистой кислоты – нитриты и соли азотной кислоты – нитраты термически неустойчивые соединения. Поэтому при нагревании они разлагаются:
а) При нагревании нитрита натрия происходит его расплавление:
NaNO2(тв) 
б) При нагревании нитрита свинца образуются оксид свинца, оксид азота (I) и кислород:
2Pb(NO2)2 
в) При нагревании нитрита аммония образуется молекулярный азот и пары воды:
NH4NO2 
г) При нагревании нитрата натрия образуются нитрит натрия и кислород:
2NaNO3 
д) При нагревании нитрата свинца (II) образуются оксид свинца (II), кислород и диоксид азота:
2Pb(NO3)2 
е) При нагревании нитрата серебра образуются серебро, кислород и диоксид азота:
2AgNO3 
ж) При нагревании нитрата аммония образуются оксид азота (I), и вода:
NH4NO3 
2NH4NO3 
Видео:Реакция азотной кислоты и карбоната кальция, получение нитрата кальция/Obtaining calcium nitrateСкачать

Получение азотной кислоты в домашних условиях: как обращаться с реагентами
Химия — увлекательная наука. Те, кто интересуются не только теорией, но и пробует свои навыки на практике, точно знают, о чем идет речь. С большинством элементов из таблицы Менделеева знаком каждый школьник. Но всем ли удалось попробовать на собственном опыте смешивать реагенты и проводить химические испытания? Даже сегодня не во всех современных школах имеется в наличии необходимое оборудование и реагенты, потому химия остается наукой открытой для самостоятельного изучения. Многие стремятся познать ее глубже, проводя исследования в домашних условиях.
Ни один самодельщик не обойдется без азотной кислоты — крайне важной в хозяйстве вещи. Достать вещество сложно: приобрести его можно только в специализированном магазине, где покупка осуществляется по подтверждающим мирное использование вещества документам. Потому если вы мастер-самоделка, достать этот компонент, скорее всего, не получится. Здесь и возникает вопрос о том, как сделать азотную кислоту в домашних условиях. Процесс вроде не отличается сложностью, тем не менее на выходе должно получиться вещество достаточного уровня чистоты и необходимой концентрации. Здесь без навыков химика-экспериментатора никак не обойтись.
Видео:Три способа получения азотной кислоты [NurdRage]Скачать
![Три способа получения азотной кислоты [NurdRage]](https://i.ytimg.com/vi/T0IGRlvcU4I/0.jpg)
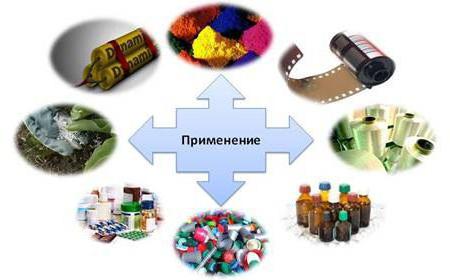
Где используется вещество?
Применение азотной кислоты разумно в безопасных целях. Вещество используется в таких сферах деятельности человека:
- создание красящих пигментов;
- проявление фотопленок;
- приготовление лекарственных препаратов;
- переработка пластиковых изделий;
- использование в химии;
- удобрение садовых и огородных культур;
- производство динамита.
Чистая азотная кислота в неизмененном виде выглядит как жидкое вещество, которое при контакте с воздухом начинает выпускать белые пары. Замерзание его происходит уже при -42 о С, а кипение — при +80 о С. Как вывести такое вещество, как азотная кислота, своими руками в домашних условиях?
Видео:Реакции 16ти металлов с азотной кислотой разной концентрации Reactions of 16 metals with nitric acidСкачать

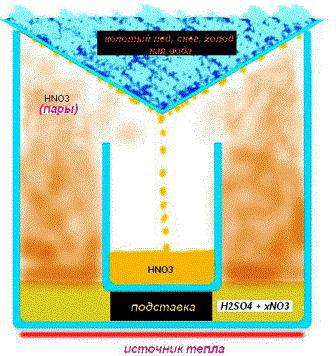
Способ 1
Дымящееся вещество получают посредством воздействия концентрата серной кислоты на натриевую (калийную) селитру (натрий (калий) нитрат). В результате реакции получается искомое вещество и гидросульфат натрия (калия). Схема реакции выглядит таким образом: NaNO3+H2SO4=>HNO3+NaHSO4. Запомните, что концентрация полученного вещества зависит от концентрации серной кислоты перед вступлением в реакцию.
Видео:Термитная смесь из АЛЮМИНИЯ и НИТРАТА КАЛИЯ. Простые опыты дома.ALUMINUM and POTASSIUM NITRATE.Скачать

Способ 2
Получение азотной кислоты в домашних условиях с меньшей концентрацией вещества происходит тем же способом, необходимо только заменить натриевую селитру нитратом аммония. Химическое уравнение выглядит так: NH4NO3+H2SO4=>(NH4)2SO4+HNO3. Заметьте, что аммиачная селитра доступнее, чем калийная или натриевая, потому большинство исследователей проводят реакцию на ее основе.
Чем выше концентрация H2SO4, тем более концентрированной будет азотная кислота. Чтобы получить сбалансированное вещество, требуется увеличить объем электролита, необходимого для проведения реакции. Чтобы достичь желаемого результата, на практике пользуются методом выпаривания, который заключается в постепенном уменьшении объема электролита примерно в 4 раза от первоначального.
Видео:Азотная кислота на ОГЭ по химии | ОГЭ 2023 | УмскулСкачать

Особенности метода выпаривания
На дно посуды высыпают просеянный песок и ставят резервуар с электролитом. При этом процесс кипячения регулируют вентилем газовой плиты, поддавая или уменьшая огонь. Процесс отличается длительностью, поэтому в таком деле важно терпение. Эксперты рекомендуют использовать кипелки — стеклянные или керамические трубочки, предназначенные для проведения химических опытов, в том числе и выпаривания. Они нейтрализуют образование пузырей и снижают силу кипения, предотвращая разбрызгивание вещества. В таких условиях допустимо получение азотной кислоты в домашних условиях с концентрацией около 93 %.
Видео:Решаем два варианта Добротина за 2 часаСкачать

Инструменты и реагенты для практического получения вещества
Для проведения реакции потребуется наличие:
- концентрированного H2SO4 (>95%) — 50 мл;
- нитрата аммония, калия, натрия;
- 100 мл емкости;
- 1000 мл контейнера;
- стеклянной воронки;
- резинки;
- водяной бани;
- колотого льда (можно заменить на снег или холодную воду);
- термометра.
Получение азотной кислоты в домашних условиях, как и проведение любой другой химической реакции, требует соблюдения мер предосторожности:
- В процессе получения азотной кислоты в домашних условиях необходимо поддерживать температуру в рамках 60-70 о С. Если превысить эти границы, кислота начнет распадаться.
- Во время проведения реакции могут выделяться пары и газы, поэтому, работая с кислотами, обязательно пользуйтесь защитной маской. Руки должны быть защищены от внезапного попадания вещества на кожу, потому химики работают в резиновых перчатках. На больших химических производствах, где человек контактирует с опасными для здоровья веществами, рабочие вообще работают в специальных защитных костюмах.
Теперь вы знаете, как получить азотную кислоту в процессе проведения простой реакции. Будьте осторожны с использованием такого вещества и применяйте его только в мирных целях.
💥 Видео
Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Разложение нитратовСкачать
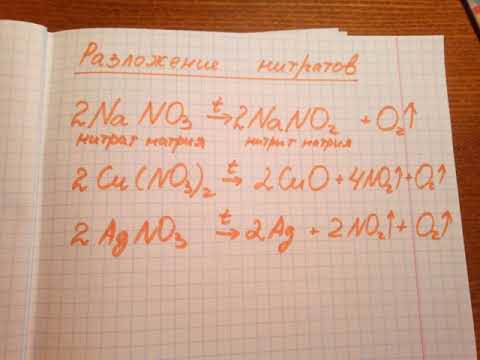
Получение нитрита из нитрата / Transformation of nitrate into nitriteСкачать

Химия 9 класс (Урок№15 - Азотная кислота. Строение молекулы.Соли азотной кислоты.Азотные удобрения.)Скачать

Азотная кислота. Физические и химические свойства азотной кислоты. Подготовка к ЕГЭ по химии | ХимияСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

реакция меди с азотной кислотойСкачать

Новейший способ синтеза азотной кислоты .Скачать

Соли азотной кислоты - нитратыСкачать