Магний Mg — это щелочной металл. Серебристо-белый, относительно мягкий, пластичный, ковкий металл. На воздухе покрыт оксидной пленкой. Сильный восстановитель.
Относительная молекулярная масса Mr = 24,305; относительная плотность для твердого и жидкого состояния d = 1,737; tпл = 648º C; tкип = 1095º C.
- Способ получения
- Качественная реакция
- Химические свойства
- Формула гидрида магния, химическая структура и свойства
- Подготовка и формула
- Химическая структура
- Физико-химические свойства
- физическое
- химическая
- приложений
- Хранение водорода
- Реакции гидрирования и дегидрирования
- грязи
- Топливные элементы
- Транспорт и энергия
- алкилирование
- риски
- Реакция с водой
- Это пирофор
- Способ хранения и получения водорода гидролизом магния для автономных энергетических установок с электрохимическими генераторами
- 📸 Видео
Видео:Водород/способы получения/реакции/8 классСкачать

Способ получения
1. В результате электролиза расплава хлорида магния образуются магний и хлор :
2. Нитрид магния разлагается при 700 — 1500º С образуя магний и азот:
3. Оксид магния легко восстанавливается углеродом при температуре выше 2000º С, образуя магний и угарный газ:
MgO + C = Mg + CO
4. Оксид магния также легко восстанавливается кальцием при 1300º С с образованием магния и оксида кальция:
MgO + Ca = CaO + Mg
Видео:Водород. 8 класс.Скачать

Качественная реакция
Качественной реакцией для магния является взаимодействие соли магния с любой сильной щелочью, в результате которой происходит выпадение студенистого осадка:
1. Хлорид магния взаимодействует с гидроксидом калия и образует гидроксид магния и хлорид калия:
MgCl2 + 2KOH = Mg(OH)2 + 2KCI
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Химические свойства
1. Магний — сильный восстановитель . Поэтому он реагирует почти со всеми неметаллами :
1.1. Магний взаимодействует с азотом при 780 — 800º С образуя нитрид магния:
1.2. Магний сгорает в кислороде (воздухе) при 600 — 650º С с образованием оксида магния:
2Mg + O2 = 2MgO
1.3. Магний активно реагирует при комнатной температуре с влажным хлором . При этом образуется хлорид магния :
1.4. С водородом магний реагирует при температуре 175º C, избыточном давлении и в присутствии катализатора MgI2 с образованием гидрида магния:
2. Магний активно взаимодействует со сложными веществами:
2.1. Магний реагирует с горячей водой . Взаимодействие магния с водой приводит к образованию гидроксида магния и газа водорода:
2.2. Магний взаимодействует с кислотами:
2.2.1. Магний реагирует с разбавленной соляной кислотой, при этом образуются хлорид магния и водород :
Mg + 2HCl = MgCl2 + H2 ↑
2.2.2. Реагируя с разбавленной азотной кислотой магний образует нитрат магния, оксид азота (I) и воду:
2.2.3. В результате реакции сероводородной кислоты и магния при 500º С образуется сульфид магния и водород:
Mg + H2S = MgS + H2
2.3. Магний вступает в реакцию с газом аммиаком при 600 — 850º С. В результате данной реакции образуется нитрид магния и водород:
2.4. Магний может вступать в реакцию с оксидами :
2.4.1. В результате взаимодействия магния и оксида азота (IV) при температуре 150º С в вакууме, в этилацетилене образуется нитрат магния и оксид азота (II):
2.4.2. Магний взаимодействует с оксидом кремния при температуре ниже 800º С в атмосфере водорода образуя силицид магния и оксид магния:
4Mg + SiO2 = Mg2Si + MgO,
а если температуру поднять до 1000º С, то в результате реакции образуется кремний и оксид магния:
2Mg + SiO2 = Si + 2MgO
Видео:Водород/химические свойства водорода/8 классСкачать

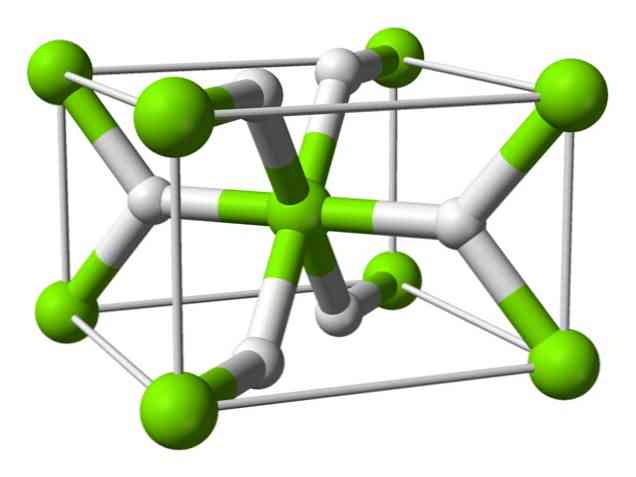
Формула гидрида магния, химическая структура и свойства
гидрид магния (MGH2 молекулярной формулы), представляет собой химическое соединение с содержанием по массе 7,66% водорода, встречающееся в природе в виде белого кристаллического твердого вещества. Он используется в основном для приготовления других химических веществ, хотя он также был изучен как потенциальный носитель водорода.
Он принадлежит к семейству солевых (или ионных) гидридов, определяемых отрицательно заряженным ионом H. Эти гидриды считаются такими, которые образуются из щелочных металлов и щелочноземельных металлов, но в случае магния (и бериллия) имеют ковалентные связи, в дополнение к ионам, которые характеризуют это семейство гидридов..
- 1 Приготовление и формула
- 2 Химическая структура
- 3 Физические и химические свойства
- 3.1 Физический
- 3.2 Химические вещества
- 4 использования
- 4.1 Хранение водорода
- 4.2 Реакции гидрирования и дегидрирования
- 4.3 Грязь
- 4.4 Топливные элементы
- 4.5 Транспорт и энергия
- 4.6 Алкилирование
- 5 рисков
- 5.1 Реакция с водой
- 5.2 Это пирофорный
- 6 Ссылки
Видео:37. Водород. Методы полученияСкачать

Подготовка и формула
Гидрид магния образуется путем прямого гидрирования металлического магния (Mg) в условиях высокого давления и температуры (200 атмосфер, 500ºC) с катализатором MgI.2. Его реакция эквивалентна:
Производство MgH также было исследовано2 при более низких температурах с использованием нанокристаллического магния, получаемого в шаровых мельницах.
Существуют и другие способы получения, но они представляют собой более сложные химические реакции (гидрирование магния-антрацена, реакция между диэтилмагнием с литий-алюминиевым гидридом и как продукт комплекса MgH.2).
Видео:Получение чистого водорода путем химической реакции алюминия со щелочамиСкачать

Химическая структура
Этот атом имеет структуру рутила при комнатной температуре, с тетрагональной кристаллической структурой. Он имеет по меньшей мере четыре различные формы в условиях высокого давления, и также наблюдается нестехиометрическая структура с недостатком водорода; последний встречается только в очень небольших количествах частиц при образовании.
Как упомянуто выше, связи, которые существуют в структуре рутила, имеют частично ковалентные свойства, а не являются чисто ионными, как другие солевые гидриды.
Это приводит к тому, что атом магния имеет сферическую форму, полностью ионизированную, но его гидрид-ион имеет удлиненную структуру.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Физико-химические свойства
физическое
- Внешний вид: белые кристаллы.
- Молярная масса: 26,3209 г / моль
- Плотность: 1,45 г / см 3
- Температура плавления: 285 ° C разлагается
- Растворимость: в воде разлагается.
Это химическое соединение имеет молекулярную массу 26,321 г / моль, плотность 1,45 г / см3 и температуру плавления 327 ° С..
химическая
- Прекурсор для изготовления других химических веществ.
- Хранение водорода, как возможный источник энергии.
- Восстановитель в органическом синтезе.
Важно указать, что это соединение нельзя довести до жидкого состояния, и когда его переносят или его температура плавления или вводят в воду, оно разлагается. Этот гидрид нерастворим в эфире.
Это очень реактивное и легковоспламеняющееся вещество, а также пирофорное, то есть оно может самовозгораться в воздухе. Эти три условия представляют риски для безопасности, которые будут упомянуты в последнем разделе этой статьи.
Видео:Реакции металлов с кислородом и водой. 8 класс.Скачать

приложений
Хранение водорода
Гидрид магния легко реагирует с водой с образованием газообразного водорода посредством следующей химической реакции:
Кроме того, это вещество разлагается при температуре 287 ° С и давлении 1 бар следующим образом:
Поэтому было предложено использовать гидрид магния в качестве носителя для хранения водорода для его использования и транспортировки..
Гидрирование и дегидрирование некоторого количества металлического магния предлагается в качестве способа транспортировки количеств газообразного водорода, таким образом обеспечивая отсутствие утечки при его транспортировке и представляя более безопасный и практичный способ, чем при использовании сосудов высокого давления..
Реакции гидрирования и дегидрирования
Хотя температура разложения гидрида магния представляет собой ограничивающий фактор для его использования, были предложены способы для улучшения кинетики реакций гидрирования и дегидрирования. Одним из них является уменьшение размера частиц магния с помощью шаровых мельниц.
грязи
Кроме того, была предложена система, которая производит гидрид магния в форме грязи (более управляемой и безопасной, чем в порошке или других твердых частицах), которая будет реагировать с водой для получения желаемого водорода.
Предполагается, что ранее названный шлам будет образован тонко измельченным гидридом, защищен защитным слоем масел и суспендирован в диспергирующих агентах, чтобы гарантировать, что он сохраняет свою консистенцию без потери материала и что он не впитывает влагу из окружающей среды..
Преимущество этого ила состоит в том, что его можно перекачивать через любой обычный дизельный, бензиновый или водяной насос, что делает это экономическое предложение также эффективным.
Топливные элементы
Гидрид магния может быть использован в производстве современных топливных элементов, а также в создании аккумуляторов и накопителей энергии..
Транспорт и энергия
В течение последних десятилетий рассматривалось использование водорода в качестве источника энергии. Имплантация водорода в качестве топлива требует поиска безопасных и обратимых систем хранения и с большими объемными емкостями (количество водорода на единицу объема) и гравиметрическими (количество водорода на единицу массы).
алкилирование
Алкилирование (добавляют СН алкильные группы3R) органических соединений в основной среде, где присутствуют группы -ОН при низких концентрациях и температурах, превышающих температуру плавления гидрида.
В этом случае водороды присутствуют в гидриде магния (MgH2), присоединяются к группам -ОН, образующим воду. Свободный магний может получить галоген, который часто сопровождает алкильную молекулу, которая предназначена для связывания с углеводородной цепью.
Видео:Опыты по химии. Каталитическое разложение пероксида водородаСкачать

риски
Реакция с водой
Как уже упоминалось, гидрид магния является веществом, которое очень легко и бурно реагирует с водой, демонстрируя способность взрываться при более высоких концентрациях..
Это происходит потому, что его экзотермическая реакция генерирует достаточно тепла, чтобы зажечь газообразный водород, выделяющийся в реакции разложения, что приводит к довольно опасной цепной реакции..
Это пирофор
Гидрид магния также пирофорен, что означает, что он может самопроизвольно воспламеняться в присутствии влажного воздуха и образует оксид магния и воду.
Его вдыхание не рекомендуется в твердом состоянии или в контакте с его парами: вещество в своем естественном состоянии и продукты его разложения могут вызвать серьезные травмы или даже смерть.
Он может генерировать коррозийные растворы при контакте с водой и ее загрязнении. Контакт с кожей и глазами не рекомендуется, а также вызывает раздражение слизистых оболочек.
Не было продемонстрировано, что гидрид магния может вызывать хронические последствия для здоровья, такие как рак, репродуктивные дефекты или другие физические или психические последствия, но рекомендуется использовать защитное оборудование при обращении с ним (особенно респираторы или маски, для его мелкий пыль характер).
При работе с этим веществом влажность воздуха должна поддерживаться на низком уровне, гасить все источники возгорания и транспортировать его в бочках или других контейнерных контейнерах..
Всегда следует избегать работы с большими концентрациями этого вещества, когда его можно избежать, так как вероятность взрыва значительно уменьшается.
В случае разлива гидрида магния рабочая зона должна быть изолирована, а пыль собирается пылесосом. Вы никогда не должны использовать сухой метод подметания; увеличивает шансы реакции с гидридом.
Видео:Горение магния - химическая реакция.Скачать

Способ хранения и получения водорода гидролизом магния для автономных энергетических установок с электрохимическими генераторами
Изобретение относится к способу хранения и получения водорода в автономных энергетических установках с электрохимическими генераторами с циклом функционирования от нескольких часов до нескольких тысяч часов. Способ включает получение водорода путем гидролиза магния при подаче воды в виде насыщенного или перегретого пара. Магний используют в виде листа, проволоки, гранул правильной или неправильной формы, с условием, чтобы один из линейных размеров используемой формы не превышал 1-2 мм. Для реакции используют воду, генерируемую в электрохимическом генераторе, а также используют тепло, выделяющееся в ходе самой реакции. В энергоустановках с малой автономностью, до нескольких часов, гидролиз осуществляют при температуре 400-450°С, при этом применяют контейнерный способ хранения и замены целиком отработавшего контейнера. В энергоустановках с большей автономностью процесс осуществляют при 120-150°С, при этом применяются несменяемые контейнеры, а удаление продуктов реакции осуществляется путем обработки окиси магния кислотой, например соляной, с получением соли магния, ее последующим растворением и выдавливанием из контейнера. Регулирование расхода получаемого водорода осуществляют регулированием количества подаваемой воды в виде пара. Для уменьшения затрат энергии на подготовку к проведению реакции гидролиза контейнер (хранилище) магния секционируют и одну или несколько секций используют в качестве “запальных”. Технический результат заключается в значительном увеличении массового процента получаемого водорода, при условии, что пополнение извне исходных продуктов и сброс продуктов реакции в период автономности отсутствуют. 6 з.п. ф-лы.
Изобретение относится к области автономных энергетических установок, преимущественно с электрохимическими генераторами.
Отличительной особенностью автономных энергетических установок (ЭУ) является периодичность их функционирования в течение сравнительно короткого времени, длительность которого определяется запасами реагентов (топлива и окислителя).
К таким ЭУ можно отнести установки для подводных лодок, подводных аппаратов, судов, железнодорожного и автомобильного транспорта, бытовые источники энергии периодического действия, а также периодически действующие стационарные ЭУ, используемые на особо ответственных объектах, не допускающих перерыва электропитания.
Способ хранения и получения водорода в автономных ЭУ должен обеспечивать длительное и безопасное его хранение, а также безопасное его получение при минимальных стоимости, массе и объеме системы хранения и получения водорода, простоте эксплуатации ЭУ и утилизации продуктов реакции.
Известны следующие способы хранения и получения водорода для автономных энергетических установок (см. Лидоренко Н.С., Мучник Г.Ф. Электрохимические генераторы. — М., 1982; Коровин Н.В. Электрохимическая энергетика. — М.: Энергоатомиздат, 1991):
— хранение в газообразном состоянии, при котором водород хранится в сосудах под высоким давлением (до 50 МПа) и после дросселирования подается в электрохимический генератор (ЭХГ);
— хранение в жидком состоянии (криогенное), при котором водород перед подачей в ЭХГ газифицируется;
— хранение в составе интерметаллических соединений, в которые он предварительно сорбирован, а перед подачей в ЭХГ десорбируется с поглощением тепла;
— хранение водорода в химически связанном состоянии в составе водородсодержащих соединений, когда водород получают путем соответствующего химического процесса.
К последнему способу хранения и получения водорода относятся:
— хранение водорода в составе аммиака и получение его путем диссоциации;
— хранение водорода в составе метанола и других жидких углеводородов и получение его путем паровой или парокислородной их конверсии;
— хранение водорода в составе гидридов металлов и получение его путем их термического разложения;
— хранение водорода в составе гидридов металлов и воды и получение его путем гидролиза гидридов металлов.
Ни один из перечисленных выше способов хранения и получения водорода не удовлетворяет всем требованиям к системам хранения и получения водорода для автономных ЭУ.
Наиболее безопасен и удобен в эксплуатации способ хранения в интерметаллидах, но он дорог в изготовлении и предопределяет большую массу ЭУ, поскольку стоимость 1 кг интерметаллида составляет $ 15-35, а массовая водородоемкость нашедших широкое применение сорбентов составляет всего 1,5-2,0%.
Наименьшую массу и объемы установки при достаточном уровне безопасности можно получить, используя конверсию метанола или углеводородного топлива, но при этом неизбежны газообразные продукты реакции, которые в ряде случаев недопустимы (на подводных лодках и других подобных объектах), т.к. могут привести к потере скрытности.
Известны также способы получения водорода путем взаимодействия воды с алюминием и магнием.
Но гидролиз алюминия водой идет только в присутствии щелочи по одной из приведенных ниже реакций
Массовый выход водорода по реакции (1) составляет около 1,5%, а продукт реакции нерастворим в воде, поэтому дальнейшее рассмотрение реакции (1) не представляет интереса.
Массовый выход по реакции (2) теоретически достигает 3,5%, продукт реакции ограниченно растворим в воде, поэтому для возможности последующего удаления продуктов реакции после завершения цикла эксплуатации их обычно хранят в виде раствора, для чего требуется дополнительное количество воды, что может снизить массовый выход водорода до 1,5-2%.
Это обстоятельство, учитывая необратимость процесса, также делает реакцию (2) малоинтересной.
Гидролиз магния водой может идти по реакции
Массовый выход водорода составляет 3,3%, а продукт реакции нерастворим в воде.
Предлагаемое изобретение направлено на то, чтобы значительно увеличить массовый процент получаемого водорода по отношению к суммарной массе исходных продуктов реакции, при условии, что пополнение извне исходных продуктов, например воды, и сброс продуктов реакции в период автономности, — отсутствуют, что очень важно для обеспечения скрытности объекта, оснащенного ЭУ с ЭХГ.
Проведенные эксперименты показали, что при определенных условиях процесс может быть реализован по реакции, отличной от (3), а именно
В результате реакции магния с водой получается чистая окись магния и водород. При этом массовый выход водорода составляет более 4,7%, а если учесть, что потребное для реакции количество воды невелико и равно генерируемому в ЭХГ в процессе эксплуатации ЭУ, то при ее использовании массовый выход водорода достигает 8,23%.
Обязательным условием реализации (4) является подача воды в паровой фазе, в виде насыщенного или перегретого пара в количестве, близком к стехиометрии. При этом количество выделяющегося водорода регулируется количеством подаваемой воды.
Магний может использоваться в любом виде: листа, проволоки, гранул правильной и неправильной формы и т.п. Важно обеспечить максимальную поверхность реакции и ее полноту.
В обоих случаях это предполагает, чтобы один из линейных размеров используемой формы был достаточно мал и не превышал 1-2 мм.
Уровень температур, при котором целесообразно проводить реакцию, а также способ хранения исходных продуктов и способ замены продуктов реакции на исходные зависят от типа энергоустановки и ее назначения.
В энергоустановках с относительно небольшой автономностью, не превышающей нескольких часов, например в автотранспортных ЭУ, целесообразно использовать контейнерный способ хранения и замены, а реакцию проводить при температуре 400-450°С. При этом способе магний в виде листа, проволоки, гранул правильной или неправильной формы размещается в специальных контейнерах, в которых осуществляется реакция окисления магния водяным паром с интенсивным выделением водорода. После того как весь магний в контейнере прореагирует с водяным паром и превратится в окись магния, контейнер из установки извлекается и отправляется на специализированное предприятие, а на место отработавшего контейнера устанавливается новый контейнер с магнием.
В энергоустановках с большой автономностью, составляющей десятки, сотни и тысячи часов (например, в энергоустановках подводных лодок) для хранения магния целесообразно использовать несменяемые контейнеры (хранилища), а реакцию окисления Мg достаточно вести при температуре 120-150°С. При этом удаление продуктов реакции (окиси магния) из стационарного хранилища можно проводить в базовых условиях по следующей схеме: предварительная обработка окиси магния кислотой с получением растворимой в воде соли магния; растворение этой соли; выдавливание раствора из контейнера; промывка контейнера водой.
Для этой цели может быть использована, например, реакция
После очистки от продуктов реакции контейнер заполняется свежей порцией Mg, который целесообразно использовать в виде гранул или в любом другом виде, обеспечивающем сыпучесть материала и отсутствие мелкой пыли, способной привести к самовозгоранию.
Для того, чтобы обеспечить начало реакции (4), необходимо получить пар и подогреть магний до заданной температуры. Для этой цели может быть использовано, например, любое электрическое устройство (электрогрелка, электроразряд и т.п.), питаемое либо от базового источника, либо от источника на борту. Поскольку реакция сильно экзотермична, важно ее сынициировать и далее поддерживать заданный температурный режим путем съема избыточного тепла.
Для сокращения затрат энергии на подготовку к проведению реакции гидролиза магния (производство пара и подогрев Мg до заданной температуры) целесообразно секционировать хранилище магния и иметь одну или несколько “запальных” секций. При этом первоначально разогревается только “запальная” секция, а затем за счет выделяющегося в ней в результате реакции тепла разогреваются остальные.
1. Способ хранения и получения водорода в автономных энергетических установках с электрохимическими генераторами с циклом функционирования от единиц до тысяч часов, преимущественно для энергоустановок подводных лодок, подводных аппаратов, автомобильного транспорта и периодически действующих стационарных установок, используемых на особо ответственных объектах, не допускающих перерыва электропитания, предусматривающий получение водорода путем гидролиза магния при повышенной температуре, отличающийся тем, что гидролиз магния осуществляют при подаче воды в виде насыщенного или перегретого пара в количестве, близком к стехиометрическому, согласно реакции Mg+Н2О 

2. Способ по п.1, отличающийся тем, что в реакции гидролиза магния используют воду, генерируемую в электрохимическом генераторе.
3. Способ по п.1, отличающийся тем, что для генерации водяного пара и нагрева магния до заданной температуры используют тепло, выделяющееся при гидролизе магния.
4. Способ по п.1, отличающийся тем, что регулирование количества получаемого водорода обеспечивают регулированием количества подаваемой на реакцию воды.
5. Способ по п.1, отличающийся тем, что для уменьшения затрат энергии на подготовку к проведению реакции хранилище магния секционируют и одну или несколько секций используют в качестве “запальных”.
6. Способ по п.1, отличающийся тем, что для энергоустановок с относительно небольшой автономностью, не превышающей нескольких часов, преимущественно автомобильных, процесс гидролиза ведут при температуре 400-450° С, при этом магний в виде листа, проката или гранул правильной или неправильной формы, у которых один из линейных размеров используемой формы не превышает 1-2 мм, размещают в специальных легкосъемных контейнерах, которые после завершения реакции извлекаются из установки и отправляют на переработку окиси магния на специализированное предприятие, а на его место устанавливают новый контейнер с магнием.
7. Способ по п.1, отличающийся тем, что для энергоустановок с относительно большой автономностью, составляющей десятки, сотни и тысячи часов, преимущественно для энергоустановок для подводных лодок, для хранения магния используются несменяемые контейнеры (хранилища), а процесс гидролиза осуществляют при температуре 120-150° С, при этом удаление продуктов реакции (окиси магния) производят в базовых условиях после предварительной обработки окиси магния раствором кислоты, например соляной (MgO+НСl 
📸 Видео
Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

8 класс. Составление уравнений химических реакций.Скачать

Получение водорода из МАГНИЯ!!!Скачать

Получение ПЕРОКСИДА МАГНИЯ. Реакция ХЛОРИДА МАГНИЯ, ГИДРОКСИДА НАТРИЯ и ПЕРЕКИСИ ВОДОРОДА. ОпытыСкачать

Поджигаем спичку марганцовкой и перекисью водорода #shortsСкачать

Свойства и применение водорода. 8 класс.Скачать

Лабораторный способ получения ВОДОРОДА | Реакция металла с кислотой | Mg + H2SO4 = MgSO4 + H2Скачать

Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

Получение водорода и проверка его на чистотуСкачать

Химия 8 класс. Водород.Скачать