Рассмотрим некоторые способы получения серебра, а также остановимся на его физических и химических свойствах. Этот металл привлекал человека еще в далекие античные времена. Своему наименованию серебро обязано санскритскому слову «аргента», что переводится как «светлый». От слова «аргента» пошло и латинское «аргентум».
- Интересные факты о происхождении
- Серебро на Руси
- Характеристика свойств
- Области применения
- Электролиз растворов солей
- Химизм процесса
- Получение в лаборатории
- Добыча и открытие
- Заключение
- Хлорид Серебра (свойства реакции применение FAQ)
- Что такое хлорид серебра (AgCl)
- Получение в лабораторных условиях
- Реакции хлорида серебра
- Минерал хлорид серебра
- Применение хлорида серебра
- Что мы узнали о хлориде серебра?
- Похожие страницы:
- Leave a Comment
- Извлечение серебра из лабораторных отходов
- 1. СВОЙСТВА И ПРИМЕНЕНИЕ СЕРЕБРА
- 1.1. Химические свойства
- 1.2. Серебряные припои
- 1.3. Химически устойчивые покрытия и проводники
- 1.4. Атомная служба серебра
- 1.5. Серебро и медицина
- 2.1. Аналитические сведения
- 3. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
- ВЫВОД
- Литература
Видео:Восстановление хлорида серебра алюминием и цинком Дешевый методСкачать

Интересные факты о происхождении
Существует множество версий о происхождении этого загадочного металла. Все они связаны с Древним миром. К примеру, в Древней Индии серебро ассоциировали с Луной и Серпом – древнейшим орудием земледельца. Отблеск этого благородного металла подобен свету Луны, поэтому в алхимический период серебро обозначали символом Луны.
Видео:Серебро из хлорида серебраСкачать

Серебро на Руси
В древней Руси мерой стоимости различных предметов являлись бруски серебра. В тех случаях, когда какой-то предмет торговли стоил меньше всего бруска, от него отрубали часть, соответствующую указываемой стоимости вещи. Эти части назывались «рублями», Именно от них пошло название принятой в России денежной единицы — рубль.
Еще за 2500 лет до нашей эры египетские воины применяли серебро для лечения боевых ран. Они накладывали на них тонкие пластины серебра, и раны быстро заживали. В русской православной церкви святую воду для прихожан выдерживали только в серебряных сосудах. С середины прошлого века появились такие отрасли промышленности, как фотография, электротехника, радиоэлектроника, что привело к резкому росту спроса на серебро, его изъятию из денежного оборота.
Высокая электропроводность, хорошая пластичность, невысокая температура плавления, небольшая химическая активность серебра заинтересовала и радиотехников.
Видео:Как добыть чистое серебро?Скачать

Характеристика свойств
Все способы получения серебра основываются на его свойствах. Это металл белого цвета, практически не меняющийся под действием кислорода воздуха при комнатной температуре. Из-за присутствия в воздухе сероводорода, он со временем покрывается темным налетом сульфида серебра Ag2S. Удаляют данное соединение с поверхности серебряного изделия механически, применяя чистящие пасты либо тонкий зубной порошок.
Серебро довольно устойчиво к воде. Соляная, а также разбавленная серная кислота и царская водка на него не действуют, так как на поверхности металла образуется защитная пленка его хлорида AgCl.
Получение нитрата серебра основывается на способности металла вступать в реакцию с азотной кислотой. В зависимости от ее концентрации в продуктах реакции помимо серебра могут находиться оксиды азота (2 или 4).
Получение оксида серебра осуществляется путем добавления раствора щелочи к нитрату серебра. Получаемое соединение имеет темно-коричневый цвет.
Видео:АФФИНАЖ СЕРЕБРА НОВЫМ МЕТОДОМ! Минуя ХЛОРИД СЕРЕБРА.. АЛЮМИНИЙ, МЕДЬ и ПРОЧЕЕ..!Скачать

Области применения
Благодаря физическим и механическим свойствам именно серебром покрывают радиодетали для повышения электрической проводимости и коррозионной устойчивости. Металлическое серебро используется при изготовлении серебряных электродов для различных видов современных аккумуляторов. Вопросами электролитического серебрения и никелирования достаточно долго занимались специалисты в области гальванотехники: А. Ф. и П.Ф. Симоненко, А. П. Сапожников и др. И.М. Федоровский перенес вопрос, касающийся антикоррозийной стойкости покрытий, из лаборатории в промышленное производство. Соединения серебра (AgBr, AgCl, AgI) применяются для производства кино- и фотоматериалов.
Видео:Восстановление хлорида серебра до 999 металла. Convert silver chloride to 999 metal.Скачать

Электролиз растворов солей
Рассмотрим получение серебра электролизом его солей. Собирается электрическая схема, в которой в качестве источника тока выступает гальванический сухой элемент. Максимальный ток в цепи не должен превышать 0,01 А. При применении сухой батарейки (4,5 В) ток ограничивается с помощью добавки проводника с сопротивлением не больше 1000 Ом.
Ванной для процесса серебрения может служить любой стеклянный сосуд. Анодом ванны выступает пластинка металла, имеющего толщину 1 мм и площадь чуть побольше, чем у самой детали. Серебро выбирают для анодного покрытия. В качестве рабочего раствора (электролита) для получения серебра выступает раствор ляписа. До опускания в ванну для серебрения необходимо обезжирить и отполировать деталь, затем протереть ее зубной пастой.
После удаления жира она промывается проточной водой. Судить о полном обезжиривании можно по равномерному смачиванию всей поверхности детали водой. При промывке пользуются пинцетом, чтобы на детали не оставались жировые следы от пальцев. Сразу после промывки деталь фиксируется на проволоке и помещается в ванну. Время получения серебра при серебряном аноде составляет 30 — 40 минут.
Если в качестве анода выбирается нержавеющая сталь, в таком случае скорость процесса меняется. Получение серебра из нитрата будет составлять 30 минут.
Вынутую из ванны деталь качественно промывают, обсушивают, начищают до блеска. При образовании темного осадка серебра ток снижается, для этого подключается дополнительное сопротивление. Это позволяет повысить качество получения серебра электрохимическим способом. Для равномерности покрытия в процессе электролиза деталь периодически поворачивается. Можно отложить металл на латунь, сталь, бронзу.
Видео:Как получить хлорид серебраСкачать

Химизм процесса
С какими процессами связано получение серебра? Реакции основываются на расположении металла после водорода в ряде стандартных электродных потенциалов. На катоде будет происходить восстановление катионов серебра из его нитрата в чистый металл. На аноде осуществляется окисление воды, сопровождающееся образованием газообразного кислорода, поскольку ляпис образован кислородсодержащей кислотой. Суммарное уравнение электролиза имеет следующий вид:
4Ag NO3 + 2Н2О электролиз 4Ag + О2 + 4HNO3
Видео:Очистка серебра. Получение нитрата серебра ~ 99,9Скачать

Получение в лаборатории
Рабочим раствором (электролитом) может стать отработанный фиксаж, в котором присутствуют катионы серебра. Галогениды этого металла образуют с тиосульфатом ряд комплексных солей. При электролизе на катоде выделяется серебро – металл. Получение его подобным способом сопровождается и выделением серы, что приводит к появлению на его поверхности тонкого черного слоя сульфида серебра.
Видео:Серебро в ОСАДКЕ. Творожок ХЛОРИДА СЕРЕБРА 🥰 #химия #experiment #chem #chemolife #amazing #сереброСкачать

Добыча и открытие
Первые упоминания о добыче серебра связаны с месторождениями, которые были обнаружены финикиянами на Кипре, в Сардинии, Испании, Армении. Металл присутствовал в них в соединении с серой, хлором, мышьяком. Удавалось обнаруживать и самородное серебро внушительных размеров. К примеру, крупнейшим самородком серебра является образец, вес которого составлял тринадцать с половиной тонн. При очистке природных самородков расплавленным свинцом получался тусклый металл. В Древней Греции его именовали Электроном, предугадывая его отличные электропроводные свойства.
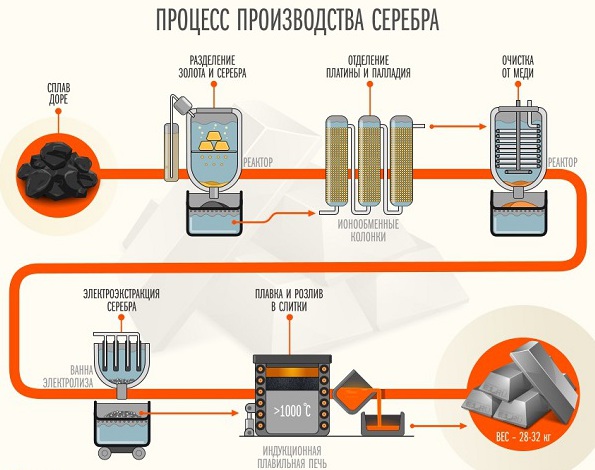
В настоящее время электролизом получают плотный слой металлического серебра. В качестве электролита применяют не только нитрат, но и цианиды. Отделение от меди серебра осуществляют выполняя электролиз из холодного раствора, в составе которого около одного процента серной кислоты, 2-3% персульфата калия. Порядка 20 мг металла можно отделить от меди за 20 минут, используя напряжение около 2 В.
В процессе электролиза в растворе должен оставаться избыток персульфата калия. Также среди вариантов разделения этих металлов можно рассмотреть электролиз кипящей уксуснокислой смеси. В настоящее время используются методики, предполагающие применение комплексантов. В растворе, который содержит ион этилендиаминтетрауксусной кислоты (ЭДТА) при кислой среде, серебро осаждается за 25 минут. Его отделяют от пластины путем электролитического осаждения на протяжении 2,5-3 часов.
От висмута и алюминия серебро отделяют путем проведения электролиза азотнокислого раствора при условиях, аналогичных разделению его смеси с медью.
Видео:Хлорид серебра, избежать потери. Как можно повторно использовать реагенты.Скачать

Заключение
Отметим, что получение ацетиленида серебра является качественной реакцией в органической химии на присутствие в смеси ацетилена и других алкинов, в которых тройная связь располагается в первом положении. В промышленных масштабах серебро используется в электротехнической и металлургической промышленности. Оно является побочным продуктом при переработке комплексных сульфидов металлов, в составе которых есть аргенит (сульфид серебра).
В процессе пирометаллургической переработки полиметаллических сульфидов цинка, меди серебро извлекается вместе с основными металлами в качестве серебросодержащих соединений. Для того чтобы проводить обогащение чистым серебром серебросодержащего свинца, используют процесс Паркеса либо Паттисона. Второй способ основывается на охлаждении расплавленного свинца, в котором есть серебро. У металлов разные температуры плавления, поэтому они будут поочередно осаждаться и выделяться из раствора. Оставшуюся жидкость Патиссон предложил подвергать окислению в струе воздуха. Процесс сопровождался образованием оксида двухвалентного свинца, который удаляли, а серебро, остававшееся в расплавленном виде, очищали от примесей.
Еще в Древней Греции применялся метод получения серебра путем купелирования.
Данная технология применяется и в настоящее время в промышленности. Метод основывается на способности расплавленного свинца окисляться кислородом, содержащимся в атмосфере.
Видео:780 грамм серебра 999. Аффинаж серебра при помощи щелочи.Скачать

Хлорид Серебра (свойства реакции применение FAQ)
Хлорид серебра это химическое вещество состоящее из серебра и хлора, сложное вещество, в природе встречается в виде минералов хлораргирит (chlorargyrit) фото, синоним — роговая серебряная обманка.
Основное применение хлорида серебра в производстве некоторых органических веществ, лекарственных препаратов, светочувствительных компонентов и т.д.
Видео:АФФИНАЖ СЕРЕБРА 999 ПРОСТОЙ СПОСОБ СМОЖЕТ КАЖДЫЙ.Скачать

Что такое хлорид серебра (AgCl)
Это белый порошок который на свету темнеет становясь серым , при нагревании плавится становясь жёлто — коричневым , при дальнейшем нагревании кипит без разложения.
Не растворим в воде и не образует кристаллогидратов. С концентрированными гидратом аммиака , образуя комплексное соединение.

Температура кипения — 1554°C
Состояние — Твёрдое
Молярная масса — 143,32г/моль
Плотность -5,56
Твёрдость -2,5
Видео:самый простой и быстрый метод аффинажа тех. серебра! Метод Соды! Как очистить техническое серебро.Скачать

Получение в лабораторных условиях
Реакцией всех растворимых солей серебра с соляной кислотой :
Реакцией растворимых солей с солями хлоридов :
Нагреванием сульфида серебра с хлоридом натрия в кислороде при нагревании 600°C :
Видео:Получение хлорида серебра | Серебро из технического серебра контактов, автоматов и пускателейСкачать

Реакции хлорида серебра
Хлорид серебра обладает слабыми свойствами фотолиза и медленно разлагается на свету на простые вещества серебро и хлор :
При температуре выше 450°C в присутствии щелочей разлагается получением простого вещества серебра , хлорида щелочного металла и кислорода :
4AgCl + 4КОН = 4КСl + 4Ag + O2 + 2Н2O
Нагревание до температуры свыше 850°C приводит к получению свободного вещества серебра , хлорида натрия , углекислого газа и кислорода :

4AgCl + 2BaO = 2BaCl2 + 4Ag + O2
Реакция с перекисью водорода , гидроксида калия ( разб . ) даёт свободное вещество серебро , хлорид калия и кислород :
С сульфидом натрия натрия при нагревании , получается сульфид серебра и хлорид натрия :
Фтор будучи более сильным галогеном чем хлор вытесняет его , образуя фторид серебра и хлор :

Соединение аммиакат серебра с ацетиленом дает стабильный ацетиленид серебра, который считается инициирующим взрывчатым веществом и работа с ним очень опасна так как ацетиленид легко детонирует от трения, удара и нагрева:
Единственный способ утилизации его реакция с серной кислотой.
Подобно ( нашатырному спирту ) реагирует с карбонатом аммония образуя комплексного соединения и углекислого газа :
Реакция с тиосульфатом натрия ( конц .) даёт комплексное соединение бис(тиосульфато)аргентат(I) и хлорид натрия :
Хлорид серебра реагирует солями цианидов ( конц .) образуя комплексные соединения и хлорид калия :
AgCl + 2KCN = K[Ag(CN)2] + KCl
Реакция с (тиоцианидом, роданидом, сульфоцианидом) калия даёт сложное комплексное соединение при комнатной температуре и хлорид калия :
Видео:Чистое серебро растет на глазах. Реакция восстановления серебра из нитрата серебра медью.Скачать

Минерал хлорид серебра
Это минерал хлораргирит химический состав: Ag — 75,3%, Сl — 24,7%. В качестве примесей иногда присутствует Hg (Br, Cl).
В свежих образцах бесцветный, прибывание на свету окрашивает его вначале фиолетово-серый, а потом даже черный цвет.
Образуется в зоне окисления серебросодержащих месторождений, где ассоциирует с минералами серебра, меди, кальцитом, баритом и др.
Используется как руда в получении серебра и иногда как сопутствующие с ним вещества ртуть и бром.
Видео:Полное осаждение хлорида серебраСкачать

Применение хлорида серебра
- В фотографической промышленности для получения светочувствительных компонентов.
- В производстве некоторых косметических средств на основе ионов серебра , борющихся с проблемной кожей в основном у молодёжи.
- Хлорид серебра используется в производстве лекарственных препараторов .
- В гомеопатии используется как материал с антибактериальными свойствами .
- Использование в производстве материала для линз в ИК — спектроскопии .
- Как промежуточный продукт в производстве серебра из руд содержащих сульфид серебра Ag2S .
- Применяется в производстве серебро органических соединений, например ацетиленид серебра и т.д.
Видео:Получение НИТРАТА СЕРЕБРАСкачать

Что мы узнали о хлориде серебра?
- Что такое хлорид серебра
Это химическое соединение в состав которого входит серебро и хлор.
Какого цвета осадок хлорида серебра
Хлорид серебра (I) в расплавленном виде, имеет желто–коричневый цвет. Расплав хлорида серебра (I) после остывания, образует полупрозрачную массу, которая в обиходной речи, иногда называется как — «роговое серебро».
Как из AgCl получить серебро
Для этого нужно прореагировать его с перекисью водорода в присутствии гидроксида калия.
Есть минерал в состав которого входит хлорид серебра
Это минерал называется хлораргирит, в его химическую формулу могут входить и другие химические элементы такие как ртуть и бром
Статья на тему хлорид серебра
Похожие страницы:
Понравилась статья поделись ей
Leave a Comment
Для отправки комментария вам необходимо авторизоваться.
Видео:серебро из хлорида серебра,плавка с содойСкачать

Извлечение серебра из лабораторных отходов
Международная Интернет-конференция школьников естественно-научного образовательного портала
«Юниор-Старт в Науку»
ИЗ ЛАБОРАТОРНЫХ ОТХОДОВ
Гимназия №3, 11в класс
Научный руководитель: ,д. х. н., профессор,
заведующий кафедрой химии
Оренбургского государственного университета
Школьный учитель: , учитель химии
1.5 Серебро и медицина________________________________________________7
2.1. Аналитические сведения____________________________________________7
2.2 Характеристика метода Мора_________________________________________8
3. Экспериментальная часть ____________________________________________10
3.1. Приготовление растворов___________________________________________10
3.3 Разработка методов утилизачии серебросодержащих отходов____________13
Серебро (Ag) (англ. Silver, франц. Argent, нем. Silber) стало известно человечеству очень давно, так как в природе встречается иногда в самородном состоянии. Этот элемент находится в Периодической таблице химических элементов в побочной подгруппе первой группы под №47 (атомный вес 107,88). Удельный вес 10,5 г/см3, температура его плавления 960,5оС, кипения – 1980оС. Серебро, подобно золоту, долгое время считалось бесполезным металлом, и лишь в последний век, век электричества, оптики и атома, его свойства и применение существенно повлияли на развитие техники.
Серебро является благородным металлом, оно практически не изменяется на воздухе, обладает очень большой электропроводностью и теплопроводностью, оно легко полируется, вытягивается в проволоку. Поэтому его широко применяют для изготовления украшений, различных поделок, в электроиндустрии, для изготовления химической посуды, в производстве медицинских инструментов и т. д.
«Светлое тело, которое ковать можно», – так определял металлы . «Типичный» металл должен обладать высокой пластичностью, металлическим блеском, звонкостью, высокой теплопроводностью и электропроводностью. Применительно к этим требованиям серебро, можно сказать, из металлов металл: из серебра можно получить листки толщиной всего лишь 0,25 мкм.
И по «звонкости» серебро заметно выделяется среди других металлов. Недаром во многих сказках фигурируют серебряные колокольчики. Колокольных дел мастера издавна добавляли серебро в бронзу «для малинового звона». В наше время струны некоторых музыкальных инструментов делают из сплава, в котором 90% серебра.
Важнейшей солью серебра является нитрат. В большинстве случаев он служит в качестве исходного продукта для приготовления других соединений серебра. В химических лабораториях нитрат серебра используется в качественном и количественном анализе для обнаружения и определения галогенид-ионов. Галогениды серебра обладают светочувствительностью, поэтому в больших масштабах применяются в фотопромышленности. Образующиеся отработанные растворы содержат нерастворимый осадок галогенидов серебра, их не выбрасывают, а сливают в отдельную посуду для последующей переработки, так как серебро имеет высокую стоимость. Поэтому переработка таких отходов весьма актуальна.
Целью нашей работы явилась отработка метода анализа и разработка способа утилизации лабораторных отходов, содержащих осадки хлорида серебра, с получением ценного химического реагента – нитрата серебра.
Видео:Восстановление хлорида серебраСкачать

1. СВОЙСТВА И ПРИМЕНЕНИЕ СЕРЕБРА
1.1. Химические свойства
В своих нормальных соединениях серебро проявляет степень окисления +1. Однако при действии восстановителей, даже при небольшом нагревании все соединения серебра легко разлагаются с выделением металлического серебра. Этот элемент вполне устойчив на воздухе и с кислородом не соединяется. Оксид серебра Ag2O получается косвенным путём из гидроксидов и кислородных соединений.
Очень велико сродство серебра к сере, при действии влажного сероводорода серебро чернеет вследствие образования Ag2S. C этим связано потемнение серебряных предметов, окладов икон и т. д. при продолжительном хранении. В природе также серебро содержится в медно-никелевых, свинцово-цинковых и других сульфидных рудах. Галогены соединяются с серебром медленно при комнатной температуре и довольно быстро при нагревании и в присутствии паров воды. Водные растворы бескислородных кислот в отсутствии окислителей или без доступа воздуха не действуют на серебро. Однако оно легко растворяется окисляющими кислотами (азотной и концентрированной серной).
Щелочные растворы и даже расплавы почти не действуют на металлическое серебро, но в присутствии окислителей (селитра) оно заметно растворяется. При доступе воздуха серебро легко растворяется в цианидных щелочных растворах с образованием довольно устойчивых комплексов.
Из соединений серебра в большом количестве используются хорошо растворимый нитрат. Многими органическими соединениями нитрат легко восстанавливается до металла, это используется для получения зеркал. Белок коагулирует под действием нитрата серебра, на этом основано его дезинфицирующее действие, используемое в медицине («ляпис»). Ионы серебра обладают антибактериальным действием даже в чрезвычайно разбавленных растворах (примерно до 2*10-11 моль/л), что используется как в религиозных («святая вода»), так и в медицинских целях.
Из галогенидов лишь фторид серебра растворим, остальные труднорастворимы. Они выпадают в виде белых творожистых осадков при взаимодействии нитрата серебра с любыми галогенсодержащими солями. На этом принципе основаны методы титриметрического анализа галогенов (и серебра, что использовано нами в работе).
Видео:ЛАЙКНАК.ГУБЧАТЫЙ ХЛОРИД СЕРЕБРА, КАК БЫСТРО СОБРАТЬ В КУЧУ.Скачать

1.2. Серебряные припои
Еще в древности серебро применяли для пайки. Температура плавления серебра не столь уже высока – 960,5°C, ниже, чем золота (1063°C) и меди (1083,2°C). В современных справочниках также есть многочисленные рецепты серебряных припоев. Им паяют судовые трубопроводы, котлы высокого давления, трансформаторы, электрические шины. Такой шов не только прочен и плотен, но и коррозионно устойчив. Чем выше требования к прочности и коррозионной устойчивости паяного шва, тем с большим процентом серебра применяются припои.
1.3. Химически устойчивые покрытия и проводники
В технике весьма распространено серебрение. Тончайшую серебряную пленку наносят не только ради высокой декоративности покрытия, а прежде всего ради химической стойкости и повышенной электропроводности. Кроме того, этому покрытию свойственны эластичность и прекрасное сцепление с основным металлом.
Серебро лучше многих других металлов противостоит действию щелочей. Именно поэтому стенки трубопроводов, автоклавов, реакторов и других аппаратов химической промышленности нередко покрывают серебром как защитным металлом. В электрических аккумуляторах с щелочным электролитом многие детали подвергаются опасности воздействия на них едкого кали или натра высокой концентрации. В то же время детали эти должны обладать высокой электропроводностью. Лучшего материала для них, чем серебро, обладающее устойчивостью к щелочам и замечательной электропроводностью, не найти. Из всех металлов серебро самый электропроводный. Но высокая стоимость элемента №47 во многих случаях заставляет пользоваться не чисто серебряными, а посеребренными деталями. Серебряные покрытия хороши еще и тем, что они прочны и плотны – беспористы. Серебряные проводники незаменимы в приборах высокой точности, когда недопустим риск. Серебро потребовалось авторам «Манхэттенского проекта» по созданию атомной бомбы.
1.4. Атомная служба серебра
Серебро проявляет высокую радиоактивность под действием бомбардировки нейтронами, период полураспада образующегося при этом излучателя не превышал 2 минут. Именно поэтому серебро стало рабочим материалом в дальнейших исследованиях Ферми, при которых было открыто такое практически важное явление, как замедление нейтронов.
Позже этой особенностью серебра воспользовались для создания индикаторов нейтронного излучения, а в 1952 г. серебро «прикоснулось» и к проблемам термоядерного синтеза: первый залп нейтронов из плазменного «шнура» был зафиксирован с помощью погруженных в парафин серебряных пластин.
1.5. Серебро и медицина
В клинической медицине применяют многочисленные препараты, содержащие серебро. Это органические соединения, преимущественно белковые, в которые введено до 25% серебра. А известное лекарство колларгол содержит его даже 78%. Любопытно, что в препаратах сильного действия (протаргол, протаргентум) серебра меньше, чем в препаратах мягкого действия (аргин, соларгеитум, аргирол и другие), но в раствор они отдают его значительно легче.
2. МЕТОДЫ ОПРЕДЕЛЕНИЯ СЕРЕБРА
2.1. Аналитические сведения
Характерным для серебра является способность осаждаться из растворов его простых солей под действием соляной кислоты в виде белого творожистого хлорида серебра, растворимого в водном растворе аммиака. Кроме того, характерна его легкая восстанавливаемость до металла, например при нагревании его солей на угле с содой при помощи паяльной трубки. Блестящие белые ковкие серебряные зерна удается легко перевести в раствор нагреванием с разбавленной азотной кислотой. Помимо указанного белого осадка с соляной кислотой, раствор солей серебра дает черный осадок с сероводородом (сульфид серебра), а после предварительной нейтрализации дает красно-коричневый осадок с хроматом калия (хромат серебра Ag2CrO4) и желтый осадок с кислым фосфатом натрия (фосфат серебра Ag3PO4).
Для микроаналитических определений, помимо хромата серебра, очень подходит хлорид серебра, кристаллизующийся в характерных формах при упаривании его аммиачного раствора (граница чувствительности 0,1 мкг Ag). Еще чувствительнее предложенная Фишером реакция с дифенилтиокарбазоном (дитизоном) С6Н5-N=N-CS-NH-NH-C6H5, однако она не применима в присутствии солей ртути и благородных металлов.
В весовом анализе серебро осаждают либо как хлорид, либо электролитически в виде металла и взвешивают. Для осаждения из растворов, в которых оно присутствует в виде комплекса, иногда применяют восстановление серебра до металла дитионатом натрия. Часто определение серебра производят титриметрически.
При титровании по методу Мора нейтральный раствор нитрата серебра прикапывают к нейтральному раствору хлорида натрия (известного содержания, если требуется определить содержание серебра в растворе), а в качестве индикатора для установления конца реакции используют хромат калия. Более растворимый, чем хлорид серебра, красный осадок хромата серебра образуется только после того, как все ионы хлора будут удалены.
По методу Фольгарда титрование ведут роданидом аммония или роданидом калия и в качестве индикатора используют раствор соли железа(III). В исследуемом pacтворе роданид серебра образуется до тех пор, пока в нем имеются еще ионы Ag+. Как только они исчезнут, появляется красное окрашивание вследствие образования роданида железа(III).
По данным Яндера, небольшие количества серебра удается определить кондуктометрическим титрованием раствором хлорида натрия даже в присутствии большого избытка солей свинца.
2.2. Характеристика метода Мора
Аргентометрический метод объемного анализа основан на применении в качестве осадителя стандартного раствора, содержащего ионы серебра, им пользуются главным образом для количественного определения галогенид-ионов и ионов серебра.
Стандартные растворы. В качестве стандартных растворов для определения анионов (An = Cl-, Br-, I-) применяют нитрат серебра; для определения катионов серебра — хлорид натрия.
Определение конечной точки титрования. В методе аргентометрии применяют как индикаторные, так и безындикаторные способы определения точки эквивалентности.
Индикаторный способ. В качестве индикатора применяют раствор хромата калия.
Применяемый в методе осаждения индикатор не должен изменять цвет до тех пор, пока определяемые ионы полностью не перейдут в осадок. Очевидно, этому условию может удовлетворять такой индикатор, который образует с ионами титрованного раствора окрашенный осадок, отличающийся большей растворимостью, чем растворимость основного осаждаемого вещества. Индикатор должен быть достаточно чувствительным по отношению к ничтожно малому избытку AgNO3. Таким условиям более или менее удовлетворяют хроматы и арсенаты щелочных металлов.
Наиболее широко в аналитической практике применяют хромат калия. Требуемую концентрацию индикатора вычисляют следующим образом. Например, при титровании хлоридов стандартным раствором AgNO3 в момент, когда начинает осаждаться хромат, концентрация серебра равна: [Ag+] =ПРAgCl/[Cl-]
[Ag+] =
Подставляя значение [Cl-] = 
откуда [CrO4—] = (1,7*10-10) : (1,44*10-8) ≈ 10-2 моль/л.
Зная, чему равняется [Ag+] в точке эквивалентности, можно также вычислить [CrO4—] по формуле: [Ag+]2*[CrO4—] = ПР(Ag2CrO4), откуда [CrO4—] = ПР(Ag2CrO4) / [Ag+]2.
Так как [Ag+]2 = [Cl-]2 = ПРAgCl, то, подставляя значение ПРAgCl = 1,7*10-10, получим [CrO4—] = 2*10-12 / 1,7*10-10 ≈ 10-2 моль/л.
Следовательно, теоретически осадок хромата серебра в точке эквивалентности образуется только в том случае, если концентрация индикатора будет равна 0,02 М. В действительности, для того чтобы заметить окраску хромата серебра, необходим некоторый избыток индикатора («холостой» опыт).
Метод Мора имеет ряд существенных недостатков:
Этот метод применим только для определения хлоридов и бромидов и не применим для определения иодидов и роданидов, титрование которых сопровождается образованием коллоидных систем и адсорбцией, затрудняющих установление конечной точки титрования. Метод нельзя применять в кислых и сильнощелочных средах. В кислых средах хромат переходит в бихромат, который образует с Ag+ осадок, растворимый в кислоте. В сильнощелочном растворе образуется окись и гидроокись серебра. Потому pH раствора должен быть не меньше 6,5 и не больше 10. В присутствии солей аммония pH раствора должен быть равен 6,5-7,2. Ионы, образующие с ионами индикатора осадки хроматов (Hg++, Pb++, Ba++ и другие), мешают титрованию по методу Мора. Это можно заключить на сравнении растворимости соответствующих хроматов : P(Ag3CrO4) = 1.4*10-8 моль/литр.
4. По методу Мора нельзя титровать окрашенные растворы, маскирующие окраску хромата серебра в точке эквивалентности.
3. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
3.1. Приготовление растворов
Приготовление 0,1 н. раствора нитрата серебра. 0,1 н. раствор нитрата серебра получают растворением рассчитанного количества химически чистого кристаллического AgNO3 в определенном объеме воды (от 0,5 до 1 л) или растворением определенной навески химически чистого серебра в химически чистой азотной кислоте.
Стандартные растворы нитрата серебра, приготовленные из продажных препаратов AgNО3, содержащих некоторое количество примесей, устанавливают по химически чистому хлориду натрия. Приготовленный раствор AgNO3 изменяется при длительном хранении. Под влиянием света разложение ускоряется. Поэтому раствор хранят в склянках оранжевого стекла или в посуде, обернутой черной бумагой или покрытой черным асфальтовым лаком.
Учитывая, что М(AgNO3) = 169,875, для приготовления 0,5 л 0,1 н. раствора нитрата серебра необходимо взять 169.9*0.1*500 : 1000 = 8,495 г AgNO3
Отвешивают на технических весах во взвешенном предварительно бюксе рассчитанное количество нитрата серебра. Осторожно переносят навеску через воронку в склянку емкостью 1 л из темного стекла, туда же наливают мерным цилиндром определенный объем дистиллированной воды, часть которой расходуют на промывание бюкса и воронки. Содержимое склянки тщательно перемешивают и затем приступают к установке титра полученного раствора.
Приготовление стандартного раствора хлорида натрия. Стандартный раствор хлорида натрия получают растворением точно известного количества химически чистого хлорида натрия в определенном объёме воды. Хлорид натрия высушивают, рассчитанную навеску, предварительно взвешенную на технических весах, взвешивают на аналитических весах и растворяют в мерной колбе емкостью 0,5 или 1 л. Установка титра AgNO3 по NaCI может быть проведена различными методами.
3.2. Установка титра 0.1 н. раствора нитрата серебра
по точной навеске хлорида натрия
Установка титра методом отдельных навесок. Для того чтобы на титрование пошло не более 25 мл раствора, необходимо взять навеску: m(NaCl) = 58,443*0,1*V : 1000, где V — объем титранта; 58,443 — масса 1 моль NaCl.
Высушенный хлорид натрия помещают во взвешенный бюкс; отвешивают на технических весах рассчитанное количество этой соли, затем навеску точно взвешивают на аналитических весах. Отвешенное количество хлорида натрия ссыпают в коническую колбу. Для титрования берут 4-5 навесок.
Титр раствора нитрата серебра по хлориду натрия устанавливают методом пpямoгo титрования в присутствии индикатора — хромата калия.
Для этого приготовленный раствор AgNO3 наливают в бюретку. Предварительно бюретка должна быть тщательно промыта малым количеством того же раствора нитрата серебра. К навеске хлорида натрия, находящийся в конической колбе и растворенной в малом объеме воды, прибавляют 1-2 мл 0,02 М раствора хромата калия и при энергичном перемешивании титруют раствором AgNO3, пока не появится неисчезающее красное окрашивание, сходное с окраской «свидетеля». Расчет результатов титрования проводят точно так же, как это делают при установке титров других растворов.
Установка титра методом пипетирования. Для приготовления 0,5 л 0,1 н. раствора NaCI берут m(NaCl) = 58,443*0,1 : 2 = 2,922 г NaCI.
Во взвешенном бюксе предварительно отвешивают на технических весах рассчитанное количество хлорида натрия, затем точно взвешивают на аналитических весах. Навеску осторожно через воронку переносят в колбу, смывают NaCI с воронки и бюкса дистиллированной водой и растворяют в малом количестве воды. После растворения навески раствор доливают водой до метки, закрывают мерную колбу пробкой и содержимое ее тщательно перемешивают.
Для титрования отбирают из мерной колбы по 25 мл раствора NaCI, переносят их в конические колбы емкостью по 250 мл, добавляют 1-2 мл (всякий раз одинаковое количество) раствора индикатора К2CrO4 и медленно при непрерывном перемешивании титруют приблизительно 0,1 н. раствором AgNO3. Титрование продолжают до тех пор, пока не появится неисчезающее красное окрашивание, сходное с окраской «свидетеля». Определение повторяют до тех пор, пока результаты трех титровании не будут расходиться больше чем на 0,05 мл. Расчет результатов титрования проводят по формулам.
Поправка на индикатор. На практике расходуют на титрование некоторый избыток AgNO3 для того, чтобы стал заметен красный осадок хромата серебра. При титровании сильно разбавленных растворов ошибка, вызываемая перетитрованием, возрастает и достигает недопустимых пределов. Поэтому при титровании сильно разбавленных растворов проводят «холостой» опыт и находят поправку на индикатор. Для этого берут такое же количество раствора индикатора, которое используется при установке титра AgNO3, разбавляют его 50 мл воды и титруют раствором AgNO3 до тех пор, пока не появится неисчезающее красное окрашивание, сходное с окраской, которую принял титруемый раствор определяемого вещества в конце титрования.
Количество стандартного раствора, расходуемое на титрование индикатора в «холостом» опыте, не должно превышать 0,03 мл. Найденную поправку на индикатор вычитают из объема стандартного раствора AgNO3, пошедшего на титрование галогенида.
3.3. Разработка метода утилизации серебросодержащих отходов
Задачей исследования являлась переработка серебросодержащих сливов, накопившихся в лаборатории. Эти сливы образовались при аргентометрическом титровании, они содержали осадок хлорида серебра.
После фильтрования и высушивания масса серебросодержащего осадка составила 14 г. Этот осадок мы тщательно смешали в стакане с порошком цинка (цинковой пылью) в соотношении 1:2 (взято 28 г цинка), залили раствором серной кислоты концентрации 0,1 моль/л и нагревали на плитке в течение 1 часа. При этом серебро восстанавливается до металлического:
2AgCl + Zn → 2Ag + ZnCl2
Избыток цинка растворяется в серной кислоте с образованием сульфата. В стакане образовался черный тяжелый осадок – порошок серебра, загрязнённый примесями. Его масса составила 10,55 г.
Дальнейшей задачей было определение содержания серебра в осадке и его переработка. Для этого осадок помещали в стакан, заливали 100 мл азотной кислоты с концентрацией 1 моль/л и кипятили в течение 1 часа. При этом серебро растворилось:
2Ag + 2HNO3 = 2AgNO3 + H2
Затем раствор отфильтровали через фильтр, остаток на фильтре промыли водой. Раствор нейтрализовали щёлочью до рН 6-7, при этом выпал бурый осадок, в котором содержатся примеси цинка, железа, меди и др. Раствор снова отфильтровали, общий объём полученного раствора составил 125 мл. В нём определяли содержание серебра титрованием с хлоридом натрия по описанной выше методике.
На титрование было взято 2 мл стандартного раствора NaCl с концентрацией 0,1 моль/л. С ним прореагировало до точки эквивалентности 19,4 мл полученного раствора. Можно составить пропорцию:
C(NaCl)*V(NaCl) = C(AgNO3)*V(AgNO3), или 0,1 моль/л * 2 мл = х * 19,4 мл.
Отсюда концентрация AgNO3 в полученном растворе составила:
х = 0,1 моль/л * 2 мл / 19,4 мл = 0,0103 моль/л,
или 0,0103 моль/л * 107,9 г/моль = 1,1114 г серебра в 19,4 мл раствора. Значит, в 125 мл этого раствора содержится 1,1114 * 125 / 19,4 = 7,1609 г серебра. Это количество серебра содержалось в 10,55 г осадка. По этим данным, процентное содержание серебра в осадке составляет 7,1609 * 100 / 10,55 = 67,88%.
Остаток раствора (125 – 19,4 = 105,6 мл) упарили до появления кристаллов на поверхности, охладили. Выпавшие кристаллы AgNO3 отфильтровали, высушили и взвесили, его вес составил 6,2835 г. Рассчитаем выход продукта. Всего в 105,6 мл раствора содержалось 7,1609 * 105,6 / 125 = 6,0495 г серебра. А в выделенном AgNO3 содержится 6,2835 * 107,9 / 169,9 = 3,9905 г серебра. Следовательно, степень извлечения серебра составила 3,9905 * 100% / 6,0495 = 65,96%. Оставшиеся 34,04% серебра содержатся в маточном растворе вместе с частью примесей, его полное выделение нецелесообразно из-за опасности получения загрязнённых кристаллов нитрата серебра.
ВЫВОД
Нами отработана титриметрическая методика анализа серебра в растворах и изучен процесс переработки серебросодержащих отходов, накапливающихся в химической лаборатории. Из осадка хлорида серебра был получен восстановленный продукт, содержащий 67,88 % серебра. Далее из него был получен нитрат серебра – ценный химический реактив с выходом 65,96%, который может быть использован в лаборатории.
Литература
3. , . Популярная библиотека химических элементов /Под ред. -Соколова, кн.2. — М: Наука, 1983.- 572с.