Гидроксид натрия (едкий натр) NaOH — белый, гигроскопичный, плавится и кипит без разложения. Хорошо растворяется в воде.
Относительная молекулярная масса Mr = 40; относительная плотность для тв. и ж. состояния d = 2,130; tпл = 321º C; tкип = 1390º C;
- Способы получения
- Качественная реакция
- Химические свойства
- Объясните процессы, в рез-те которых из хлорида натрия получают: а) металлический натрий; б) гидроксид натрия; в) карбонат натрия. Составьте
- Ваш ответ
- решение вопроса
- Похожие вопросы
- Характеристика электролитических способов получения щелочных металлов и едких щелочей
- 🔥 Видео
Видео:Как получить гидроксид натрия в домашних условиях ?Скачать

Способы получения
1. Гидроксид натрия получают электролизом раствора хлорида натрия :
2NaCl + 2H2O → 2NaOH + H2 + Cl2
2. При взаимодействии натрия, оксида натрия, гидрида натрия и пероксида натрия с водой также образуется гидроксид натрия:
2Na + 2H2O → 2NaOH + H2
Na2O + H2O → 2NaOH
2NaH + 2H2O → 2NaOH + H2
3. Карбонат натрия при взаимодействии с гидроксидом кальция образует гидроксид натрия:
Видео:Как сделать гидроксид натрияСкачать

Качественная реакция
Качественная реакция на гидроксид натрия — окрашивание фенолфталеина в малиновый цвет .
Видео:Самый *ПРОСТОЙ* способ ПОЛУЧИТЬ ГИДРОКСИД КАЛИЯСкачать

Химические свойства
1. Гидроксид натрия реагируют со всеми кислотами (и сильными, и слабыми, и растворимыми, и нерастворимыми). При этом образуются средние или кислые соли, в зависимости от соотношения реагентов:
2. Гидроксид натрия реагирует с кислотными оксидами . При этом образуются средние или кислые соли, в зависимости от соотношения реагентов:
3. Гидроксид натрия реагирует с амфотерными оксидами и гидроксидами . При этом в расплаве образуются средние соли, а в растворе комплексные соли:
в растворе образуется комплексная соль — тетрагидроксоалюминат:
4. С кислыми солями гидроксид натрия также может взаимодействовать. При этом образуются средние соли, или менее кислые соли:
5. Гидроксид натрия взаимодействует с простыми веществами-неметаллами (кроме инертных газов, азота, кислорода, водорода и углерода).
При этом кремний окисляется до силиката и водорода:
Фтор окисляет щелочь. При этом выделяется молекулярный кислород:
Другие галогены, сера и фосфор — диспропорционируют в растворе гидроксида натрия:
Сера взаимодействует с гидроксидом натрия только при нагревании:
6. Гидроксид натрия взаимодействует с амфотерными металлами , кроме железа и хрома. При этом в расплаве образуются соль и водород:
В растворе образуются комплексная соль и водород:
2NaOH + 2Al + 6Н2О = 2Na[Al(OH)4] + 3Н2
7. Гидроксид натрия вступает в обменные реакции с растворимыми солями .
Хлорид меди (II) реагирует с гидроксидом натрия с образованием хлорида натрия и осадка гидроксида меди (II):
2NaOH + CuCl2 = Cu(OH)2↓+ 2NaCl
Также с гидроксидом натрия взаимодействуют соли аммония .
Например , при взаимодействии хлорида аммония и гидроксида натрия образуются хлорид натрия, аммиак и вода:
NH4Cl + NaOH = NH3 + H2O + NaCl
8. Гидроксид натрия разлагается при нагревании до температуры 600°С:
2NaOH → Na2O + H2O
9. Гидроксид натрия проявляет свойства сильного основания. В воде практически полностью диссоциирует , образуя щелочную среду и меняя окраску индикаторов.
NaOH ↔ Na + + OH —
10. Гидроксид натрия в расплаве подвергается электролизу . При этом на катоде восстанавливается натрий, а на аноде выделяется молекулярный кислород:
4NaOH → 4Na + O2 + 2H2O
Видео:Как получить Гидроксид Натрия??? NaOH 2 способа.Скачать

Объясните процессы, в рез-те которых из хлорида натрия получают: а) металлический натрий; б) гидроксид натрия; в) карбонат натрия. Составьте
Видео:Натрий.Очистка от гидроксид натрия и хлорид натрия.Химия.Глазные капли натрия. без воды,но с маслом!Скачать

Ваш ответ
Видео:Гидроксид натрия.Цветные реакции с едким натром.Получение щелочи и опыты.Сульфид,сульфит из натрия!Скачать

решение вопроса
Видео:Получение гидроксида натрия электролизомСкачать

Похожие вопросы
- Все категории
- экономические 43,399
- гуманитарные 33,632
- юридические 17,905
- школьный раздел 607,960
- разное 16,854
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Видео:ГИДРОКСИД НАТРИЯ | NaOH | Химические свойства ГИДРОКСИДА НАТРИЯ | Качественные реакции | ХимияСкачать

Характеристика электролитических способов получения щелочных металлов и едких щелочей
Задача 973.
Чем отличается электролитический способ получения щелочных металлов от электролитического способа получения едких щелочей? Какие электрохимические процессы происходят в том и другом случае?
Решение:
а) Щелочные металлы получают электролизом расплавов их соединений, например, натрий можно получить электролизом расплава хлорида натрия. При этом на катоде выделяется металлический натрий, а на аноде – газообразный хлор.
Уравнения реакций электродных процессов при электролизе расплава NaCl:
На катоде: Na + + 
На аноде: Cl¯- 
Cl 0 +Cl 0 = Cl2↑
Побочным продуктом является газообразный хлор, который собирают и используют в промышленности.
б) Едкие щёлочи получают электролизом водных растворов солей щелочных металлов, например, едкое натрий получают электролизом водного раствора хлорида натрия. В ходе электролиза на катоде разряжаются ионы водорода и одновременно вблизи катода (в катодном пространстве) накапливаются ионы натрия и гидрокси-ионы (Na + и ОН ¯ ). На аноде выделяется хлор. Очень важно чтобы продукты электролиза не смешивались, так как NaOH легко взаимодействует с хлором. Для воспрепятствованию смешивания NaOH и Cl2 применяют диафрагменный метод (устанавливают диафрагму из асбеста или другого пористого материала ). Существуют два метода электролиза соли: Метод стального электрода (катода) и метод ртутного катода, анодом в обеих случаях является угольный стержень.
Уравнения реакций процессов на катоде и аноде при электролизе раствора хлорида натрия:
На катоде: 2Н2О + 2 
На аноде: 2Сl ¯ — 2 
2NaCl + 2H2O 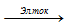
В процессе электролиза в анодное пространство непрерывно поступает раствор NaCl, а из катодного вытекает раствор, содержащий смесь NaCl и NaOH. При выпаривании раствора NaCl выкристаллизовывается, а NaOH остаётся в растворе. NaOH отделяют от NaCl и выпаривают до полного удаления воды. Полученный гидроксид натрия сплавляют и отливают в формы. Побочными продуктами являются водород и хлор.
Если катодом служит ртуть, то у катода разряжаются не ионы водорода, а ионы натрия. Выделяющийся натрий растворяется в ртути, образуя амальгаму натрия. Полученную при электролизе амальгаму разлагают горячей водой, при чём получается гидроксид натрия и выделяется водород и освобождается ртуть. Этим методом можно получить чистый гидроксид натрия, не содержащий в виде примеси хлорид натрия.
Задача 974.
Как путем электролиза раствора хлорида калия получить гидроксид, гипохлорит и хлорат калия? Написать уравнения происходящих реакций.
Решение:
а) Электролиз (Elektrolyse) раствора хлорида калия – соли образованной при взаимодействии активного металла и бескислородной кислоты протекает предсказуемо. В данном случае на электродах выделяется водород (катод) и хлор (анод). А в растворе постепенно накапливается соответственно щелочь (КОН).
Стандартный электродный потенциал системы К + + 1 
Катод: 2Н2О +2 
а ионы К + , приходящие к катоду будут накапливаться в прилегающей к нему части раствора (катодное пространство). На аноде будет происходить электрохимическое окисление ионов хлора Cl ¯ , приводящее к выделению газообразного хлора:
2Сl ¯ + 2 
2Cl 0 = Cl2 0 ↑
Поскольку отвечающей этой системе стандартный электродный потенциал (1,359 В), хотя и больше, чем стандартный электродный потенциал системы: 2Н2О = О2↑+ 4Н + + 4 

По окончании электролиза жидкость у катодного пространства выпаривают. При его выпаривании выкристаллизовываются хлорид калия и остаётся почти чистый гидроксид калия, который выпаривают до полного удаления воды. Затем, гидроксид калия сплавляют в формы. Побочными продуктами электролиза являются газообразные водород и хлор.
б) Получение гипохлорита калия. Для получения гипохлорита калия нужно, выделяющийся при электролизе хлорида калия газообразный хлор, пропустить через раствор гидроксида калия у катодного пространства. При пропускании хлора через исходный раствор едкого калия образуется гипохлорит калия:
в) Для получения хлората калия нужно пропустить хлор в горячий раствор гидроксида калия, получим:
Поскольку хлорат калия малорастворим в холодной воде, то при охлаждении раствора он выпадает в осадок.
🔥 Видео
Как сделать NaOH (гидроксид натрия)?Скачать

🔥 Получил МЕТАЛЛ из СОДЫ. Старинный способ ДОБЫЧИ НАТРИЯ.Скачать

Электролиз раствора гидроксида натрияСкачать

О том, как получить гидроксид натрия в дома.flvСкачать

хлорид алюминия и гидроксид натрияСкачать

Реакция нейтрализации гидроксида натрия соляной (хлороводородной) кислотойСкачать

Реакция сульфата меди II ( медный купорос) с гидроксидом натрия ( щелочами)Скачать

Реакция СЕРЫ и ГИДРОКСИДА НАТРИЯ. S + NaOH. Получение СУЛЬФИДА НАТРИЯ. Опыты по химии. ЭкспериментыСкачать

🔥 ПОЛУЧЕНИЕ КАЛИЯ И НАТРИЯ В ДОМАШНИХ УСЛОВИЯХ своими рукамиСкачать

Взаимодействие хлорида железа (III) с гидроксидом натрия FeCl3 + 3NaOH = Fe(OH)3 + 3NaClСкачать

Натрий получение. Электролиз Гидроксид натрия.Скачать

Получение гидроксида натрия из мела и соды.Скачать
