Хлорид магния MgCl — соль щелочного металла магния и хлороводородной кислоты. Белый, плавится без разложения. Хорошо растворяется в воде (слабый гидролиз по катиону).
Относительная молекулярная масса Mr = 95,21; относительная плотность для тв. и ж. состояния d = 2,32; tпл = 714º C; tкип = 1370º C;
Видео:Получение СОЛЯНОЙ кислотыСкачать

Способ получения
1. Хлорид магния можно получить путем взаимодействия магния и разбавленной хлороводородной кислоты, образуются хлорид магния и газ водород:
Mg + 2HCl = MgCl2 + H2↑
2. При комнатной температуре, в результате взаимодействия магния и влажного хлора, образуется хлорид магния:
3. Разбавленная хлороводородная кислота реагирует с гидроксидом магния . Взаимодействие хлороводородной кислоты с гидроксидом магния приводит к образованию хлорида магния и воды:
4. Карбонат лития взаимодействует с разбавленной соляной кислотой , образуя хлорид магния, углекислый газ и воду:
5. Оксид магния взаимодействует с разбавленной соляной кислотой , образуя хлорид магния и воду:
MgO + 2HCl = MgCl2 + H2O
6. В результате взаимодействия оксида магния , углерода и хлора при 800 — 1000º С образуется хлорид магния и угарный газ:
MgO + C + Cl2 = MgCl2 + CO
Видео:СОЛИ ХИМИЯ 8 КЛАСС: Химические Свойства Солей и Получение // Реакция Солей с Кислотами и МеталламиСкачать

Качественная реакция
Качественная реакция на хлорид магния — взаимодействие его с нитратом серебра, в результате реакции происходит образование белого творожного осадка:
1. При взаимодействии с нитратом серебра , хлорид магния образует нитрат магния и осадок хлорид серебра:
Видео:Реакция МАГНИЯ и СОЛЯНОЙ КИСЛОТЫ. Получение ХЛОРИДА МАГНИЯ MgCI2. Опыты по химии дома. ЭкспериментыСкачать

Химические свойства
1. Хлорид магния вступает в реакцию со многими сложными веществами :
1.1. Хлорид магния вступает в реакции с основаниями :
Хлорид магния взаимодействует с разбавленным раствором гидроксида натрия . При этом образуются гидроксид магния и хлорид натрия:
MgCl2 + 2NaOH = Mg(OH)2↓ + 2NaCl
1.2. Насыщенный хлорид магния реагирует с концентрированным и горячим гидратом аммиака, образуя гидроксид магния и хлорид аммония :
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Please wait.
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

We are checking your browser. gomolog.ru
Видео:Хлороводородная кислота. 9 класс.Скачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 706f7e5658e89788 • Your IP : 85.95.179.80 • Performance & security by Cloudflare
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

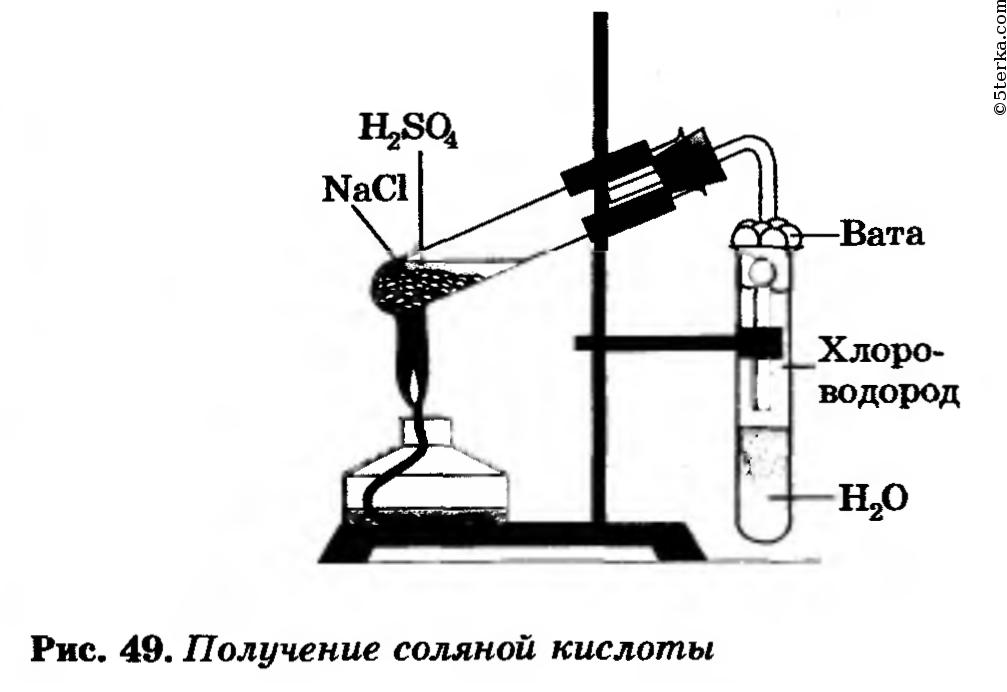
Практическая работа № 5(c). Получение соляной кислоты и изучение ее свойств
Получение соляной кислоты
Соберите прибор, как показано на рисунке 49.
В пробирку насыпьте 2—3 г хлорида натрия и прилейте столько концентрированной серной кислоты (2:1), чтобы она смочила всю соль. Закройте пробирку пробкой с газоотводной трубкой. Конец трубки опустите в другую пробирку с водой так, чтобы он был примерно на расстоянии 0,5—1 см от поверхности воды. Затем смесь в первой пробирке осторожно нагревайте в течение 5—6 мин (следите, чтобы кислоту не перебросило во вторую пробирку с водой!).
1. Напишите уравнения химических реакций, протекающих между концентрированной серной кислотой и хлоридом натрия при обычных условиях и при сильном нагревании.
2. Чем вызвано появление во второй пробирке тонких опускающихся вниз струек?
3. Почему конец газоотводной трубки должен находиться на расстоянии 0,5—1,0 см от поверхности воды?
Изучение свойств соляной кислоты
Полученную соляную кислоту разлейте поровну в шесть пробирок. В первую пробирку опустите лакмусовую бумажку. Во вторую пробирку положите кусочек цинка или магниевые стружки, а в третью — кусочек меди. В четвертую пробирку внесите немного оксида меди(П) и нагрейте раствор. В пятую пробирку поместите немного свежеприготовленного гидроксида меди(П), в шестую — немного мела или другого карбоната.
1. Со всеми ли металлами реагирует соляная кислота? Составьте уравнения реакций, протекающих между соляной кислотой и указанными металлами.
2. Как объяснить образование в четвертой и пятой пробирках растворов синего цвета, а в шестой — выделение газа? Составьте уравнения соответствующих реакций.
3. Проведите реакции по распознаванию соляной кислоты и ее солей. Для этого в одну пробирку налейте 1—2 мл разбавленной соляной кислоты, во вторую — столько же раствора хлорида натрия, а в третью — раствор хлорида кальция. Во все пробирки добавьте по нескольку капель раствора нитрата серебра. Проверьте, растворяется ли выпавший осадок в концентрированной азотной кислоте.
Напишите уравнения проведенных вами реакций и укажите, как можно отличить: а) соляную кислоту от других кислот, б) хлориды от других солей, в) растворы хлоридов от соляной кислоты.
Почему вместо раствора нитрата серебра(1) можно также использовать раствор нитрата свинца(П)?
Видео:МАГНИЕВЫЕ опыты!Скачать

Ответы:
Получение соляной кислоты (HCl):
Изучение свойств соляной кислоты:
Для изучения свойств соляной кислоты проведем несколько характерных для нее реакций.

задача №5
к главе «Практические работы».
Видео:Химия 9 класс (Урок№10 - Галогены. Хлор. Хлороводород. Соляная кислота и её соли.)Скачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. 📸 ВидеоПолучение ПЕРОКСИДА МАГНИЯ. Реакция ХЛОРИДА МАГНИЯ, ГИДРОКСИДА НАТРИЯ и ПЕРЕКИСИ ВОДОРОДА. ОпытыСкачать  Составление уравнений химических реакций. 1 часть. 8 класс.Скачать  Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать  Задание 23. Доказать свойства хлорида магнияСкачать  Получение ХЛОРНОЙ КИСЛОТЫ и не только!Скачать  ХЛОРОВОДОРОД | Соляная кислота | Химия 9 классСкачать  Задачи на примеси. 1 часть. 9 класс.Скачать  ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать  Соляная кислота. Свойства и особенности. То чего вы не знали.Скачать  Химия. 7 класс. Реакции разбавленных кислот с металлами /26.01.2021/Скачать  |