Калий К — это щелочной металл. Серебристо-белый, мягкий, легкоплавкий.
Относительная молекулярная масса Mr = 39,098; относительная плотность для твердого состояния d = 0,8629; относительная плотность для жидкого состояния d = 0,83; tпл = 63, 51º C; tкип = 760º C.
- Способ получения
- Качественная реакция
- Химические свойства
- Получение калия: способы, реакция, формулы, виды калия и его химические свойства
- Общая характеристика
- Применение
- Получение металла
- Получение исходных веществ
- Получение производных
- Нитрат калия
- Сульфат калия
- Карбонат калия
- Перманганат калия
- Гидроксид калия
- Калий
- Содержание
- История и происхождение названия
- Нахождение в природе
- Месторождения
- Получение
- Физические свойства
- Химические свойства
- Взаимодействие с простыми веществами
- Взаимодействие со сложными веществами
- Соединения с кислородом
- Гидроксид
- Применение
- Важные соединения
- Биологическая роль
- Калий в организме человека
- Изотопы
Видео:Получение Гидроксида Калия. Калиевой щелочи KOH (Едкое Кали)Скачать

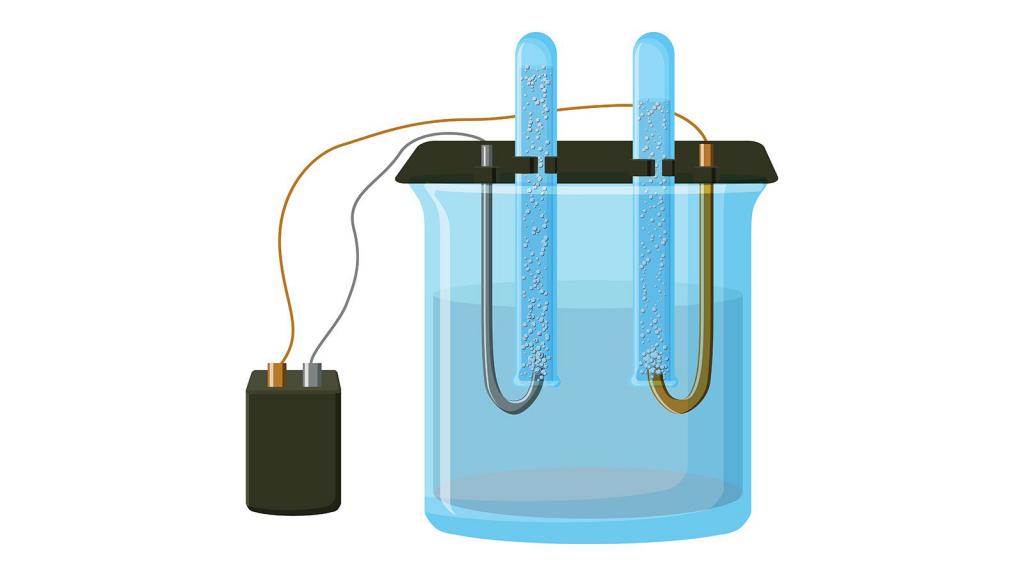
Способ получения
1. Калий получают в промышленности путем разложения гидрида калия при температуре 400º С в вакууме, при этом образуются калий и водород :
2KH = 2K + H2
2. В результате электролиза жидкого гидроксида калия образуются калий, кислород и вода :
4KOH → 4K + O2↑ + 2H2O
Видео:Самый *ПРОСТОЙ* способ ПОЛУЧИТЬ ГИДРОКСИД КАЛИЯСкачать

Качественная реакция
Качественная реакция на калий — окрашивание пламени солями калия в фиолетовый цвет .
Видео:Получение: Гидроксида калия - KOHСкачать

Химические свойства
1. Калий — сильный восстановитель . Поэтому он реагирует почти со всеми неметаллами :
1.1. Калий легко реагирует с водородом при 200–350º C образованием гидрида калия:
2K + H2 = 2KH
1.2. Калий сгорает в кислороде с образованием надпероксида калия:
1.3. Калий активно реагирует при комнатной температуре с фтором, хлором, бромом и йодом . При этом образуются фторид калия, хлорид калия, бромид калия, йодид калия :
2K + F2 = 2KF
2K + Cl2 = 2KCl
2K + Br2 = 2KBr
2K + I2 = 2KI
1.4. С серой, теллуром и селеном реагирует при температуре 100–200º C с образованием сульфида калия, селенида калия и теллурид калия :
2K + S = K2S
2K + Se = K2Se
2K + Te = K2Te
1.5. Калий реагирует с фосфором при 200º C в атмосфере аргона с образованием фосфида калия:
3K + P = K3P
2. Калий активно взаимодействует со сложными веществами:
2.1. Калий реагирует с водой . Взаимодействие натрия с водой приводит к образованию щелочи и газа водорода:
2K 0 + 2 H2 O = 2 K + OH + H2 0
2.2. Калий взаимодействует с кислотами . При этом образуются соль и водород.
2.2.1. Ка лий реагирует с разбавленной соляной кислотой, при этом образуются хлорид калия и водород :
2K + 2HCl = 2KCl + H2 ↑
2.2.2. При взаимодействии с разбавленной с ерной кислотой образуется сульфат калия, сероводород и вода:
2.2.3. Реагируя с азотной кислотой калий образует нитрат калия, можно образовать газ оксид азота (II), газ оксид азота (I), газ азот и воду.
2.2.4. В результате реакции насыщенной сероводородной кислоты и калия в бензоле образуется осадок гидросульфид калия и газ водород:
2K + 2H2S = 2KHS↓ + H2↑
2.3. Калий при температуре 65–105º C может реагировать с аммиаком , при этом образуются амид натрия и водород:
2.4. Калий может взаимодействовать с гидроксидами:
Например , Калий взаимодействует с гидроксидом калия при температуре 450º С, при этом образуется оксид калия и водород:
2K + 2KOH = 2K2O + H2
Видео:Получение гидроксида калия электролизомСкачать

Получение калия: способы, реакция, формулы, виды калия и его химические свойства
Калий (К) – это пятый по распространенности в природе металл. Он расположен в 1 группе периодической системы химических элементов (ПСХЭ), поэтому относится к щелочным металлам и при смешивании с водой образует растворимые гидроксиды. В виде простого вещества элемент имеет серебристо-белый цвет, иногда с фиолетовым оттенком. По характеристикам он мягкий и низкоплавкий. Получение калия возможно из его гидрида, гидроксида, хлорида, хромата или дихромата.
Видео:🔥 ПОЛУЧЕНИЕ КАЛИЯ И НАТРИЯ В ДОМАШНИХ УСЛОВИЯХ своими рукамиСкачать

Общая характеристика
При превращении калия в пар сине-зеленого цвета он разлагается на атомы К, к которым примешивается небольшое количество молекул К2. Растворить металл можно в жидком аммиаке с получением стандартного темно-синего раствора либо в расплаве едкого кали.
Калий имеет высокую реакционную способность, обладает сильными восстановительными свойствами (его внешняя электронная оболочка находится на большом удалении от ядра, а в таблице электроотрицательности он занимает вторую позицию после цезия), реагирует не только с разбавленными кислотами, неметаллами, нитритом водорода и дигидросульфидом, но и с кислородом воздуха и водой. В последнем случае выделяющийся водород быстро воспламеняется.
Со ртутью элемент превращается в сплав – амальгаму. С натрием, таллием, оловом, свинцом и висмутом у калия образуются интерметаллиды, обладающие высокой твердостью и химической стойкостью. Химическое соединение нескольких металлов плавится при более высокой температуре, чем каждый из образующих его компонентов, но имеет меньшую пластичность по сравнению с ними.
Однако есть вещества, с которыми элемент практически не вступает в реакцию, например, к таким относится азот. Это одна из отличительных особенностей калия от других щелочных металлов, в первую очередь, лития и натрия. Кроме того, он не сплавляется с литием, магнием, цинком, кадмием, алюминием и галлием.
Калий хорошо сохраняется под слоем бензина и керосина. Определить его можно по окрашиванию пламени горелки в фиолетовый цвет.
Видео:Гидроксид калия ЭлекиролизСкачать
Применение
Калий играет важную биологическую роль в организме человека и развитии растений. Кроме того, он широко используется в повседневной жизни. Так, в комплексе с азотом и фосфором он является незаменимым удобрением для культурных растений, позволяющим повысить их урожайность, вегетативную массу и устойчивость к вредителям.
Сплав металла с натрием применяется для передачи тепловой энергии в замкнутых системах, а если к этому соединению добавить цезий, получится состав с рекордно низкой температурой плавления (минус 78 градусов Цельсия).
Для того чтобы использовать все эти полезные и важные соединения, нужно знать реакции получения калия из его соединений.
Видео:Поташ (углекислый калий) из золы.Скачать

Получение металла
Неорганическое соединение белого цвета, гидрид калия, образуется из расплавленного металла, но оно нестабильно и при температуре в 400 градусов Цельсия в вакууме распадается на составляющие по следующей реакции:
Гидроксид калия образуется из соответствующего хлорида. Он широко применяется в производстве жидких мыл и для получения калия и его соединений. Для этого нужно провести электролиз, то есть пропустить через раствор ток. В результате на аноде образуется кислород, а на катоде калий:
Из хлорида можно получать не только гидроксид, но и металл в чистом виде. Для этого также потребуется реакция электролиза раствора:
В отличие от предыдущего способа получения калия, в этом можно использовать исходное вещество не только в жидком состоянии, но и в виде расплава, но в этом случае происходят две параллельные реакции:
Катод, на котором будет образовываться калий, должен быть ртутным.
Видео:Получение сильной щёлочи. Едкий кали.Скачать

Получение исходных веществ
Иногда применяются хромат или дихромат калия. Напрямую металл из них не получить, но можно преобразовать их в гидроксиды или хлориды, которые впоследствии подвергнуть электролизу по приведенным выше реакциям. Получение гидроксида калия из хромата происходит так:
- 2K2CrO4 + 2Н2О + 3Н2S = 2Cr(ОН)3 + 3S + 4КОН.
Чтобы процесс прошел успешно, сера и гидроксид хрома выпали в осадок, нужно брать горячую воду. Подобную реакцию можно также провести с помощью дихромата. Она протекает аналогичным образом, различие наблюдается только в значениях стехиометрических коэффициентов:
При нагревании дихромата до 500 градусов Цельсия гидроксид можно получить другим способом:
Есть и другие способы получения гидроксида. Например, с помощью реакции между поташом и насыщенным раствором гашеной извести.
Для получения хлорида калия из хромата реакции проводятся таким образом:
Соляная кислота берется в разбавленном виде. Получение калия хлора сопровождается выделением дихромата и воды.
Превратить дихромат в хлорид немного более сложно, для этого понадобится этиловый спирт и кипячение:
Получение калия хлора также возможно из поташа при взаимодействии с разбавленной соляной кислотой и из сульфата при реакциях с галогенидом бария.
Гидроксид и хлорид легко преобразуются друг в друга с помощью электролиза или при добавлении соответствующего галогенида.
Видео:Цианистый Калий. Самый известный ЯД и как пахнет синильная кислота.Скачать

Получение производных
Получение солей калия играет не менее важную роль, чем образование чистого металла. Несмотря на высокую стоимость, они используются в гальванотехнике, так как обеспечивают интенсивную работу электролитов при повышенной плотности тока. Это достигается за счет высокой растворимости.
Видео:электролит гидроксид калия 100 грамм на литр дисцилированной воды заморожен до -16 градусовСкачать

Нитрат калия
Большое значение имеет получение нитрата калия (KNO3). Эта белая соль, называемая индийской селитрой, практически не токсична для живых организмов. Применяется и в мирных целях в качестве удобрения, и в военных как компонент взрывчатых и горючих веществ. Кроме того, получение нитрата калия нужно для обесцвечивания и улучшения прочностных характеристик хрустальных стекол, что широко используется в вакуумной электропромышленности и оптическом стекловарении. В металлургии полезны ее окислительные свойства в отношении никелевых и иных руд. А в пищевой промышленности соль выступает в качестве консерванта.
Для получения раствора нитрата калия можно воспользоваться следующими веществами:
- надпероксидом металла при добавлении к нему оксида азота (IV) и нагревании до 70 градусов Цельсия;
- гидроксидом и разбавленной азотной кислотой;
- гидроксидом в холодном состоянии и смесью оксидов азота (II) и (IV);
- горячим гидроксидом, оксидом азота (IV) и кислородом;
- горячим разбавленным нитритом калия и кислородом (реакция требует времени);
- нитритом калия и горячей перекисью водорода в разбавленной серной кислоте в качестве катализатора (кислоту можно заменить бромом, но он вступит в реакцию с образованием бромоводорода).
Полученное соединение плавится без разложения, устойчиво на воздухе, растворяется в воде без гидролиза, обладает сильными окислительными свойствами, восстанавливается только атомным водородом.
Видео:Задание №8 в ЕГЭ по химии | Саша Сильвер | ЕГЭ 2024 | SMITUPСкачать

Сульфат калия
Соль, известная еще с XIV века, получила название сульфата калия (K2SO4) лишь в XVII. Она присутствует в водах соленых озер и месторождениях неметаллических минеральных ресурсов, но возможно получение сульфата калия в процессе синтеза следующих веществ:
- надпероксида калия и серы при 130-140 градусах Цельсия (вместо серы можно использовать ее оксид (IV), тогда будет достаточно температуры в 100 градусов);
- гидроксида калия и разбавленной серной кислоты;
- гидросульфата калия (разложением при 240 градусах);
- гидросульфата калия и концентрированного каустического поташа или хлорида этого же металла;
- хлорида калия и концентрированной серной кислоты при кипячении;
- сульфида калия и кислорода при температуре выше 500 градусов;
- разложением дисульфата калия при температуре выше 440 градусов и использовании оксида серы (IV) и кислорода в качестве катализаторов.
Другое название получаемого вещества – арканит. Оно имеет белый цвет, устойчиво к температурному воздействию, но легко растворяется в воде без кристаллогидратов. Для него характерно участие в обменных реакциях, восстановление водородом и углеродом.
На практике оно активно используется в сельском хозяйстве как бесхлорное удобрение для бедных калием почв. Особенно важен арканит для культур, чувствительных к хлору или потребляющих много серы. Урожай, выращенный с его применением, содержит большее количество сахара и витаминов, чем тот, который не удобрялся. Также удобрение используют для цветов, выращиваемых и на открытом воздухе, и в тепличных условиях.
Другое применение арканита – компонент при производстве стекла, квасцов, металлургических плавней. Он выступает и в качестве пищевой добавки, но само по себе вещество сложно назвать безопасным: оно раздражает глаза, кожу, желудочно-кишечный тракт, дыхательные пути и приводит к отравлению при длительном контакте с различными частями тела и организма.
Видео:Как получают едкий калий?Скачать

Карбонат калия
Поташ или углекислый калий (К2СО3) был известен еще в древности и сохранял важное промышленное значение вплоть до ХХ века. Получение карбоната калия происходило путем выщелачивания из растительной золы и последующей очисткой продукта. В основном производство локализовалось в лесистой местности Европы, России и Северной Америки.
Сейчас известно больше реакций, в результате которых получается карбонат. Обычно используются следующие вещества:
- надпероксид калия и графит при небольшом нагревании до 30 градусов (вместо графита может быть использован угарный газ с нагреванием до 50 градусов);
- концентрированный гидроксид калия и углекислый газ;
- разложение гидрокарбоната калия при температуре от 100 до 400 градусов;
- гидрокарбонат и концентрированный гидроксид калия;
- сульфат калия, гидроксид кальция и угарный газ при температуре 200 градусов и под давлением, с последующим синтезом получившегося продукта К(НСОО) с кислородом при 700 градусах.
Получаемое белое вещество плавится без разложения, в воде сильно гидролизуется по аниону, создает сильнощелочную среду, реагирует с кислотами, неметаллами и их оксидами, а также вступает в реакции обмена.
Вещество малотоксичное и используется для производства жидкого мыла, пигментов, стекла, соединений калия. Применяется в крашении, выращивании сельскохозяйственных культур, проявлении фотографий. Кроме того, является популярной добавкой, уменьшающей температуру замерзания бетона, поглотителем сероводорода, обезвоживающим агентом, пищевой добавкой.
Видео:Калий - САМЫЙ ГОРЮЧИЙ МЕТАЛЛ НА ЗЕМЛЕ!Скачать

Перманганат калия
Красно-фиолетовая, почти черная марганцовка известна всем, так как ее можно увидеть практически в каждом доме. Хотя в последнее время существуют небольшие ограничения на покупку вещества из-за того, что его признали прекурсором. Получение перманганата калия (KMnO4) возможно несколькими способами, например, взаимодействием сульфата марганца (II) с водой и кислородом из дитионата калия. По прошествии некоторого времени при наличии нитрата серебра в качестве катализатора из этой смеси получится перманганат и сульфат калия, а также серная кислота.
Еще больше способов предполагает использование манганата калия, к нему можно добавлять следующие вещества:
- воду (реакция требует затрат времени);
- разбавленную соляную кислоту;
- углекислый газ;
- хлор.
Кроме того, манганат можно подвергать электролизу с образованием перманганата на аноде (на катоде будет водород).
Применение у получившегося вещества широкое. Благодаря окисляющей способности оно обеспечивает антисептическое действие. В медицине оно применяется для полоскания горла при воспалительных заболеваниях его слизистой, промывания ран, обработки ожогов и инфицированных ран, лечения язв, а также как рвотное средство при отравлениях алкалоидами.
Противопоказанием является гиперчувствительность, но передозировка может привести к летальному исходу даже у здорового человека, смертельная доза для среднего человека составляет всего 20-30 г.
При использовании перманганата нужно соблюдать меры предосторожности, так, вещество воспламеняется при смешивании с органическими и легковоспламеняющимися соединениями, активными металлами и неметаллами. При дополнительном нагревании возможен взрыв.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Гидроксид калия
Помимо солей, большое значение имеет гидроксид калия. Это вещество относится к щелочам, то есть веществам, растворы и расплавы которых могут проводить электрический ток.
Тривиальное название этого соединения — каустический поташ. Выглядит оно как белое гигроскопичное вещество. К его свойствам относятся плавление и кипение без разложения, хорошая растворимость в воде с образованием сильнощелочной среды, нейтрализация кислотами, реакционная способность в отношении металлов и неметаллов, их оксидов и гидроксидов. Из воздуха гидроксид калия активно поглощает воду и углекислый газ.
Как получение калия возможно из щелочи, так и гидроксид можно получить из металла. Для этого требуется лишь добавить к нему воду в чистом виде или в сочетании с кислородом. Кроме того, можно получать щелочь из карбоната и насыщенного гидроксида кальция либо электролизом хлорида. Последний способ активно используется в промышленном производстве.
Вещество опасно, может прижечь кожу или слизистые, разрушает все материалы органического происхождения. Работать с ним можно, только надежно защитив кожные покровы перчатками, а глаза очками.
Несмотря на опасность, щелочь имеет широкое применение в фотографии, нефтепереработке, пищевом, бумажном и металлургическом производстве, а также как щелочной элемент питания, нейтрализатор кислот, катализатор, газоочиститель, регулятор водородного показателя, электролит, компонент моющих средств, буровых растворов, красителей, удобрений, калийных органических и неорганических веществ, пестицидов, фармацевтических препаратов для лечения бородавок, мыла, синтетического каучука.
Таким образом, получение калия и соединений на его основе, в первую очередь, солей и гидроксида, имеет большое значение для промышленности и широкое применение в быту. Главное, помнить о технике безопасности при работе с этим щелочным металлом и осторожно применять материалы, в которых он используется. Благодаря этому можно будет избежать тех его свойств, которые являются опасными.
Видео:Самый главный продукт – источник калия.Скачать

Калий
| Калий | |
|---|---|
| Серебристо-белый мягкий металл | |
 |
(молярная масса)
(первый электрон)
Калий — элемент первой группы (по старой классификации — главной подгруппы первой группы), четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 19. Обозначается символом K (лат. Kalium ). Простое вещество калий — мягкий щелочной металл серебристо-белого цвета.
В природе калий встречается только в соединениях с другими элементами, например, в морской воде, а также во многих минералах.
Очень быстро окисляется на воздухе и очень легко вступает в химические реакции, особенно с водой, образуя щёлочь.
Во многих свойствах калий очень близок натрию, но с точки зрения биологической функции и использования клетками живых организмов они антагонистичны.
Видео:9.гидроксид калия и др. Свойства основанийСкачать

Содержание
- 1 История и происхождение названия
- 2 Нахождение в природе
- 2.1 Месторождения
- 3 Получение
- 4 Физические свойства
- 5 Химические свойства
- 5.1 Взаимодействие с простыми веществами
- 5.2 Взаимодействие со сложными веществами
- 5.3 Соединения с кислородом
- 5.4 Гидроксид
- 6 Применение
- 6.1 Важные соединения
- 7 Биологическая роль
- 7.1 Калий в организме человека
- 8 Изотопы
Видео:Для чего нужен едкий калий?Скачать

История и происхождение названия
Соединения калия используются с древнейших времён. Так, производство поташа (который применялся как моющее средство) существовало уже в XI веке. Золу, образующуюся при сжигании соломы или древесины, обрабатывали водой, а полученный раствор (щёлок) после фильтрования выпаривали. Сухой остаток, помимо карбоната калия K2CO3, содержал сульфат калия K2SO4, соду и хлорид калия KCl.
19 ноября 1807 года в Бейкеровской лекции английский химик Дэви сообщил о выделении калия электролизом расплава едкого кали (KOH)(в рукописи лекции Дэви указал, что он открыл калий 6 октября 1807 года). Дэви назвал его «потасий» (лат. potasium ; это название (правда, в некоторых языках с двумя буквами s) до сих пор употребительно в английском, французском, испанском, португальском и польском языках. При электролизе влажного едкого кали KOH на ртутном катоде он получил амальгаму калия, а после отгонки ртути — чистый металл. Дэви определил его плотность, изучил химические свойства, в том числе разложение воды и поглощение водорода.
В 1808 году французские химики Гей-Люссак и Л. Тенар выделили калий химическим путём — прокаливанием KOH с углём.
В 1809 году немецкий физик Л. В. Гильберт предложил название «калий» (лат. kalium , от араб. аль-кали — поташ). Это название вошло в немецкий язык, оттуда в большинство языков Северной и Восточной Европы (в том числе русский) и «победило» при выборе символа для этого элемента — K.
Видео:Гидроксид калия. Другие названия продукта :Гидроокись калия, калия гидрат окиси.Скачать

Нахождение в природе
Ввиду высокой химической активности калий в свободном состоянии в природе не встречается. Породообразующий элемент, входит в состав слюд, полевых шпатов и т. д. Также калий входит в состав минералов сильвина KCl, сильвинита KCl·NaCl, карналлита KCl·MgCl2·6H2O, каинита KCl·MgSO4·6H2O, а также присутствует в золе некоторых растений в виде карбоната K2CO3 (поташ). Калий входит в состав всех клеток (см. ниже раздел Биологическая роль). Кларк калия в земной коре составляет 2,4 % (5-й по распространённости металл, 7-й по содержанию в коре элемент). Средняя концентрация в морской воде — 380 мг/л .
Месторождения
Крупнейшие месторождения калия находятся на территории Канады (производитель PotashCorp), России (ПАО «Уралкалий», г. Березники, г. Соликамск, Пермский край, Верхнекамское месторождение калийных руд), Белоруссии (ПО «Беларуськалий», г. Солигорск, Старобинское месторождение калийных руд).
Видео:Алюминий и гидроксид калияСкачать

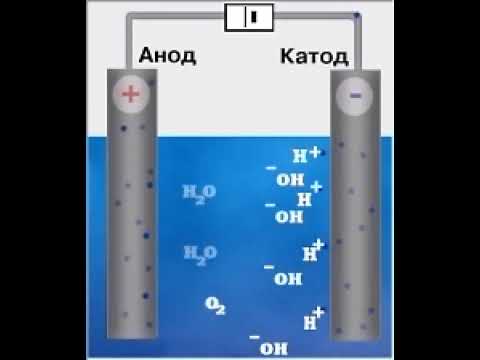
Получение
Калий, как и другие щелочные металлы, получают электролизом расплавленных хлоридов или щелочей. Так как хлориды имеют более высокую температуру плавления (600—650 °C), то чаще проводят электролиз расплавленных щелочей с добавкой к ним соды или поташа (до 12 %). При электролизе расплавленных хлоридов на катоде выделяется расплавленный калий, а на аноде — хлор:
K + + e − → K 2Cl − → Cl2
При электролизе гидроксида калия на катоде также выделяется расплавленный калий, а на аноде — кислород:
Вода из расплава быстро испаряется. Чтобы калий не взаимодействовал с хлором или кислородом, катод изготовляют из меди и над ним помещают медный цилиндр. Образовавшийся калий в расплавленном виде собирается в цилиндре. Анод изготовляют также в виде цилиндра из никеля (при электролизе щелочей) либо из графита (при электролизе хлоридов).
Важное промышленное значение имеют и методы термохимического восстановления:
Na + KOH → N2,380−450oC NaOH + K
и восстановление из расплава хлорида калия карбидом кальция, алюминием или кремнием.
Видео:Химический опыт. Гидроксид Калия+ Сульфат МедиСкачать
Физические свойства
Калий — серебристый металл с характерным блеском на свежеобразованной поверхности. Очень лёгок и легкоплавок. Относительно хорошо растворяется в ртути, образуя амальгамы. Будучи внесённым в пламя горелки, калий (а также его соединения) окрашивает пламя в характерный розово-фиолетовый цвет.
Калий образует кристаллы кубической сингонии, пространственная группа I m3m, параметры ячейки a = 0,5247 нм , Z = 2 .
Химические свойства
Элементарный калий, как и другие щелочные металлы, проявляет типичные металлические свойства и очень химически активен, является сильным восстановителем. На воздухе свежий срез быстро тускнеет из-за образования плёнок соединений (оксиды и карбонат). При длительном контакте с атмосферой способен полностью разрушиться. С водой реагирует со взрывом. Хранить его необходимо под слоем бензина, керосина или силикона, дабы исключить контакт воздуха и воды с его поверхностью. С Na, Tl, Sn, Pb, Bi калий образует интерметаллиды.
Взаимодействие с простыми веществами
Калий при комнатной температуре реагирует с кислородом воздуха, галогенами; практически не реагирует с азотом (в отличие от лития и натрия). При умеренном нагревании реагирует с водородом с образованием гидрида (200—350 °C):
с халькогенами (100—200 °C, E = S, Se, Te):
При сгорании калия на воздухе образуется надпероксид калия KO2 (с примесью K2O2):
В реакции с фосфором в инертной атмосфере образуется фосфид калия зелёного цвета (200 °C):
Взаимодействие со сложными веществами
Калий при комнатной температуре (+20 °C) активно реагирует с водой, кислотами, растворяется в жидком аммиаке (−50 °C) с образованием тёмно-синего раствора аммиаката калия.
Калий глубоко восстанавливает разбавленные серную и азотную кислоты:
При сплавлении металлического калия со щелочами он восстанавливает водород гидроксогруппы:
При умеренном нагревании реагирует с газообразным аммиаком с образованием амида (+65…+105 °C):
Металлический калий реагирует со спиртами с образованием алкоголятов:
Алкоголяты щелочных металлов (в данном случае — этилат калия) широко используются в органическом синтезе.
Соединения с кислородом
При взаимодействии калия с кислородом воздуха образуется не оксид, а пероксид и супероксид:
Оксид калия может быть получен при нагревании металла до температуры не выше 180 °C в среде, содержащей очень мало кислорода, или при нагревании смеси супероксида калия с металлическим калием:
Оксиды калия обладают ярко выраженными осно́вными свойствами, бурно реагируют с водой, кислотами и кислотными оксидами. Практического значения они не имеют. Пероксиды представляют собой желтовато-белые порошки, которые, хорошо растворяясь в воде, образуют щёлочи и пероксид водорода:
Свойство обменивать углекислый газ на кислород используется в изолирующих противогазах и на подводных лодках. В качестве поглотителя используют эквимолярную смесь супероксида калия и пероксида натрия. Если смесь не эквимолярна, то в случае избытка пероксида натрия поглотится больше газа, чем выделится (при поглощении двух объёмов CO2 выделяется один объём O2), и давление в замкнутом пространстве упадёт, а в случае избытка супероксида калия (при поглощении двух объёмов CO2 выделяется три объёма O2) выделяется больше газа, чем поглотится, и давление повысится.
В случае эквимолярной смеси (Na2O2:K2O4 = 1:1) объёмы поглощаемого и выделяемого газов будут равны (при поглощении четырёх объёмов CO2 выделяется четыре объёма O2).
Пероксиды являются сильными окислителями, поэтому их применяют для отбеливания тканей в текстильной промышленности.
Получают пероксиды прокаливанием металлов на воздухе, освобождённом от углекислого газа.
Также известен озонид калия KO3, оранжево-красного цвета. Получить его можно взаимодействием гидроксида калия с озоном при температуре не выше +20 °C:
Озонид калия является очень сильным окислителем, например, окисляет элементарную серу до сульфата и дисульфата уже при +50 °C:
Гидроксид
Гидроксид калия (или едкое кали) представляет собой твёрдые белые непрозрачные, очень гигроскопичные кристаллы, плавящиеся при температуре 360 °C. Гидроксид калия относится к щелочам. Он хорошо растворяется в воде с выделением большого количества тепла. Растворимость едкого кали при +20 °C в 100 г воды составляет 112 г .
Применение
- Жидкий при комнатной температуре сплав калия и натрия используется в качестве теплоносителя в замкнутых системах, например, в атомных силовых установках на быстрых нейтронах. Кроме того, широко применяются его жидкие сплавы с рубидием и цезием. Сплав с составом 12 % натрия, 47 % калия, 41 % цезия обладает рекордно низкой температурой плавления −78 °C.
- Соединения калия — важнейший биогенный элемент и потому применяются в качестве удобрений. Калий является одним из трёх базовых элементов, которые необходимы для роста растений наряду с азотом и фосфором. В отличие от азота и фосфора, калий является основным клеточным катионом. При его недостатке у растения прежде всего нарушается структура мембран хлоропластов — клеточных органелл, в которых проходит фотосинтез. Внешне это проявляется в пожелтении и последующем отмирании листьев. При внесении калийных удобрений у растений увеличивается вегетативная масса, урожайность и устойчивость к вредителям.
- Соли калия широко используются в гальванотехнике, так как, несмотря на относительно высокую стоимость, они часто более растворимы, чем соответствующие соли натрия, и потому обеспечивают интенсивную работу электролитов при повышенной плотности тока.
Важные соединения
- Бромид калия применяется в медицине и как успокаивающее средство для нервной системы.
- Гидроксид калия (едкое кали) применяется в щелочных аккумуляторах и при сушке газов.
- Карбонат калия (поташ) используется как удобрение, при варке стекла, как кормовая добавка для птицы.
- Хлорид калия (сильвин, «калийная соль») используется как удобрение.
- Нитрат калия (калийная селитра) — удобрение, компонент чёрного пороха.
- Перхлорат и хлорат калия (бертолетова соль) используются в производстве спичек, ракетных порохов, осветительных зарядов, взрывчатых веществ, в гальванотехнике.
- Дихромат калия (хромпик) — сильный окислитель, используется для приготовления «хромовой смеси» для мытья химической посуды и при обработке кожи (дубление). Также используется для очистки ацетилена на ацетиленовых заводах от аммиака, сероводорода и фосфина.
- Перманганат калия — сильный окислитель, используется как антисептическое средство в медицине и для лабораторного получения кислорода.
- Тартрат натрия-калия (сегнетова соль) в качестве пьезоэлектрика.
- Дигидрофосфат и дидейтерофосфат калия в виде монокристаллов в лазерной технике.
- Пероксид калия и супероксид калия используются для регенерации воздуха на подводных лодках и в изолирующих противогазах (поглощает углекислый газ с выделением кислорода).
- Фтороборат калия — важный флюс для пайки сталей и цветных металлов.
- Цианид калия применяется в гальванотехнике (серебрение, золочение), при добыче золота и при нитроцементации стали. Чрезвычайно ядовит, один из сильнейших ядов.
- Калий совместно с перекисью калия применяется при термохимическом разложении воды на водород и кислород (калиевый цикл «Газ де Франс», Франция).
- Сульфат калия применяется как удобрение.
Биологическая роль
Калий — важнейший биогенный элемент, особенно в растительном мире. При недостатке калия в почве растения развиваются очень плохо, уменьшается урожай, поэтому около 90 % добываемых солей калия используют в качестве удобрений.
Калий в качестве катиона наряду с катионами натрия является базовым элементом так называемого калиево-натриевого насоса клеточной мембраны, который играет важную роль в проведении нервных импульсов.
Калий в организме человека
Калий содержится большей частью в клетках, до 40 раз больше, чем в межклеточном пространстве. В процессе функционирования клеток избыточный калий покидает цитоплазму, поэтому для сохранения концентрации он должен нагнетаться обратно при помощи натрий-калиевого насоса. Калий и натрий между собой функционально связаны и выполняют следующие функции:
- Создание условий для возникновения мембранного потенциала и мышечных сокращений.
- Поддержание осмотической концентрации крови.
- Поддержание кислотно-щелочного баланса.
- Нормализация водного баланса.
Рекомендуемая суточная доля калия составляет для детей от 600 до 1700 миллиграммов, для взрослых — от 1800 до 5000 миллиграммов. Потребность в калии зависит от массы тела, физической активности, физиологического состояния и климата места проживания. Рвота, продолжительные поносы, обильное потение, использование мочегонных повышают потребность организма в калии.
Основными пищевыми источниками являются бобы (в первую очередь белая фасоль), шпинат и капуста кормовая, финики, картофель, батат, сушёные абрикосы, дыня, киви, авокадо, помело, бананы, брокколи, печень, молоко, ореховое масло, цитрусовые, виноград. Калия достаточно много в рыбе и молочных продуктах.
Практически все сорта рыбы содержат более 200 мг калия на 100 г . Количество калия в разных видах рыбы различается.
Овощи, грибы и травы также содержат много калия, однако в консервированных продуктах его уровень может быть гораздо меньше. Много калия содержится в шоколаде.
Всасывание происходит в тонком кишечнике. Усвоение калия облегчает витамин B6, затрудняет — алкоголь.
При недостатке калия развивается гипокалиемия. Возникают нарушения работы сердечной и скелетной мускулатуры. Продолжительный дефицит калия может быть причиной острой невралгии.
При избытке калия развивается гиперкалиемия, для которой основным симптомом является язва тонкого кишечника. Настоящая гиперкалиемия может вызвать остановку сердца.
Изотопы
Природный калий состоит из трёх изотопов. Два из них стабильны: 39 K (изотопная распространённость 93,258 %) и 41 K (6,730 %). Третий изотоп 40 K (0,0117 %) является бета-активным с периодом полураспада 1,251 миллиарда лет. Сравнительно малый период полураспада и большая распространённость калия по сравнению с ураном и торием означает, что на Земле ещё 2 млрд лет назад и ранее калий-40 вносил главный вклад в естественный радиационный фон. В каждом грамме природного калия в секунду распадается в среднем 31,0±0,3 ядра 40 K, благодаря чему, например, в организме человека массой 70 кг ежесекундно происходит около 4000 радиоактивных распадов. Поэтому легкодоступные в быту соединения калия (поташ, хлорид калия, калийная селитра и т. д.) можно использовать как пробные радиоактивные источники для проверки бытовых дозиметров. 40 K наряду с ураном и торием считается одним из основных источников геотермальной энергии, выделяемой в недрах Земли (полная скорость энерговыделения оценивается в 40—44 ТВт ). В минералах, содержащих калий, постепенно накапливается 40 Ar, один из продуктов распада калия-40, что позволяет измерять возраст горных пород; калий-аргоновый метод является одним из основных методов ядерной геохронологии.
Один из искусственных изотопов — 37 K, — с временем полураспада 1,23651 секунды, применяется в экспериментах по изучению Стандартной модели слабого взаимодействия.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| 8 | Uue | Ubn | Ubu | Ubb | Ubt | Ubq | Ubp | Ubh | Ubs |
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu,
Th, Np, U, Hf, Be, Al, Ti, Zr, Yb, Mn, V, Nb, Pa, Cr, Zn, Ga, Fe, Cd, In, Tl, Co, Ni, Te, Mo, Sn, Pb, H2,
W, Sb, Bi, Ge, Re, Cu, Tc, Te, Rh, Po, Hg, Ag, Pd, Os, Ir, Pt, Au
Литий
Li
Атомный номер: 3
Атомная масса: 6,941
Темп. плавления: 453,85 К
Темп. кипения: 1615 К
Плотность: 0,534 г/см³
Электроотрицательность: 0,98
Натрий
Na
Атомный номер: 11
Атомная масса: 22,98976928
Темп. плавления: 371,15 К
Темп. кипения: 1156 К
Плотность: 0,97 г/см³
Электроотрицательность: 0,96
Калий
K
Атомный номер: 19
Атомная масса: 39,0983
Темп. плавления: 336,58 К
Темп. кипения: 1032 К
Плотность: 0,86 г/см³
Электроотрицательность: 0,82
Рубидий
Rb
Атомный номер: 37
Атомная масса: 85,4678
Темп. плавления: 312,79 К
Темп. кипения: 961 К
Плотность: 1,53 г/см³
Электроотрицательность: 0,82
Цезий
Cs
Атомный номер: 55
Атомная масса: 132,9054519
Темп. плавления: 301,59 К
Темп. кипения: 944 К
Плотность: 1,93 г/см³
Электроотрицательность: 0,79
Франций
Fr
Атомный номер: 87
Атомная масса: (223)
Темп. плавления:
300 К
Темп. кипения:
950 К
Плотность: 1,87 г/см³
Электроотрицательность: 0,7