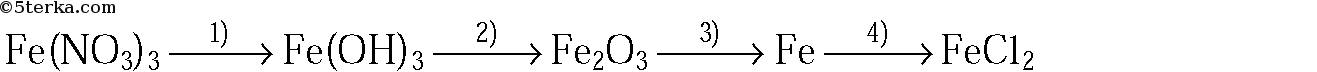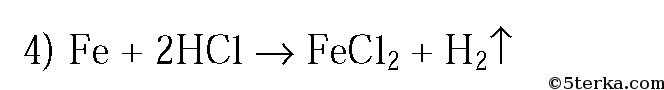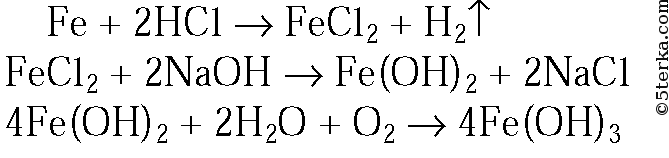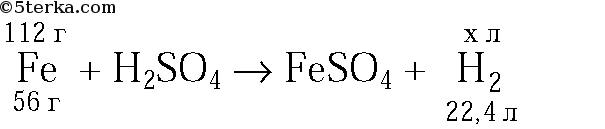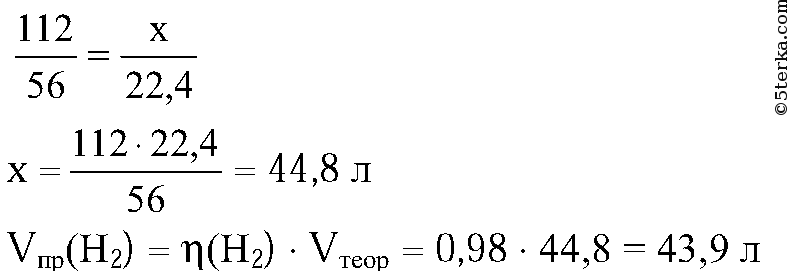Оксид железа (III)
Оксид железа (III) – это твердое, нерастворимое в воде вещество красно-коричневого цвета.
Способы получения
Оксид железа (III) можно получить различными методами :
1. Окисление оксида железа (II) кислородом.
2. Разложение гидроксида железа (III) при нагревании :
Химические свойства
Оксид железа (III) – амфотерный .
1. При взаимодействии оксида железа (III) с кислотными оксидами и кислотами образуются соли.
Например , оксид железа (III) взаимодействует с азотной кислотой:
2. Оксид железа (III) взаимодействует с щелочами и основными оксидами. Реакция протекает в расплаве, при этом образуется соответствующая соль (феррит) .
Например , оксид железа (III) взаимодействует с гидроксидом натрия:
3. Оксид железа (III) не взаимодействует с водой.
4. Оксид железа (III) окисляется сильными окислителями до соединений железа (VI).
Например , хлорат калия в щелочной среде окисляет оксид железа (III) до феррата:
Нитраты и нитриты в щелочной среде также окисляют оксид железа (III):
5. Оксид железа (III) проявляет окислительные свойства . Но есть интересный нюанс — при восстановлении оксида железа (III), как правило, образуется смесь продуктов: это может быть оксид железа (II), просто вещество железо, или железная окалина Fe3O4. Но в реакции мы записываем при этом только один продукт. А вот какой именно это будет продукт, зависит от условий реакции. Как правило, в экзаменах по химии нам даются указания на возможный продукт (цвет образовавшегося вещества или дальнейшие характерные реакции).
Например , оксид железа (III) реагирует с угарным газом при нагревании. При этом возможно восстановление как до простого железа, так и до оксида железа (II) или железной окалины:
При восстановлении оксида железа (III) водородом также возможно образование различных продуктов, например, простого железа:
Железом можно восстановить оксид железа только до оксида железа (II):
Оксид железа (III) реагирует с более активными металлами .
Например , с алюминием (алюмотермия):
Оксид железа (III) реагирует также с некоторыми другими сильными восстановителями.
Например , с гидридом натрия:
Fe2O3 + 3NaH → 3NaOH + 2Fe
6. Оксид железа (III) – твердый, нелетучий и амфотерный. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Например , из карбоната натрия:
Видео:Как получить гидроксиды металла в 2 стадии?Скачать

Написать цепочку реакций, подписать все полученные вещества, расставить коэффициенты и подписать типы реакций FeO —Fe2O3 — Fe(NO3)3
Видео:Решение цепочек превращений по химииСкачать

Ваш ответ
Видео:Получение и превращения гидроксидов железа Fe(OH)2 и Fe(OH)3Скачать

решение вопроса
Видео:Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать

Похожие вопросы
- Все категории
- экономические 43,410
- гуманитарные 33,633
- юридические 17,906
- школьный раздел 608,042
- разное 16,856
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Видео:ПОЛУЧЕНИЕ ОКСОХЛОРИДА ЖЕЛЕЗА - FeOCl. Реакция Оксида Железа - Fe2O3 и Хлорида Железа - FeCl3.Скачать

Вариант 2
Видео:ОГЭ химия задание 21Скачать

Вопросы:
1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
2. Какие свойства — окислительные или восстановительные — проявляют соединения железа со степенью окисления +2? Почему?
3. Как, исходя из металлического железа, можно получить гидроксид железа(II) и гидроксид железа(III)? Приведите уравнения реакций.
4. Смесь железа и железной окалины Fe3O4 массой 32 г обработали избытком соляной кислоты. При этом выделилось
5,6 л водорода (н. у.). Рассчитайте массовую долю железа и железной окалины в смеси. (Ответ: 43,75% Fe и 56,25% Fe3O4.)
Видео:Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать

Ответы и решения:
2. Соединения железа со степенью окисления +2 проявляют восстановительные свойства, при этом окисляясь до степени окисления +3, т.к. их атом при этом переходит в более устойчивую форму. В некоторых случаях эти соединения могут проявлять окислительные свойства, когда из них вытесняется металлическое железо.

задача №2
к главе «Тема VI. Железо. Металлургия. Работа 1. Железо и его соединения».
🔥 Видео
Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Разбор демонстрационного варианта ОГЭ химия 2022 ФИПИСкачать

How to Balance Na2CO3 + Fe(NO3)3 =NaNO3 + Fe2(CO3)3Скачать

Количество вещества. Моль. Число Авогадро. 8 класс.Скачать

Тесты по химии. Схема превращений. В6 РТ 15 16 этап 3Скачать

Цепочки превращений по неорганической химии. Вариант №3.Скачать

Катион железа 3+. Качественная реакция.Скачать

Особый случай: Fe + O2 #easy.chemistry #химия #химияегэ #химияогэ #огэпохимии #егэхимия #огэ #школаСкачать

А18 ЦТ 2019. Железо. Тесты по химииСкачать

Определение массовых долей элементов в соединениях. 8 класс.Скачать

Молярная масса. 8 класс.Скачать

Химия 8 класс (Урок№21 - Соли: состав, классификация, номенклатура, способы получения.)Скачать

Разбор 3 варианта из сборника Добротина | Химия ОГЭ 2023 | УмскулСкачать