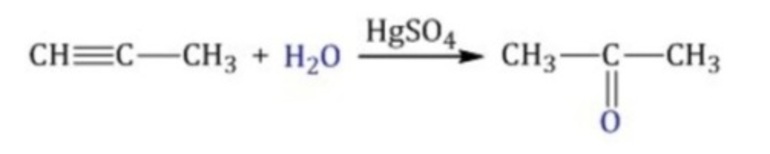
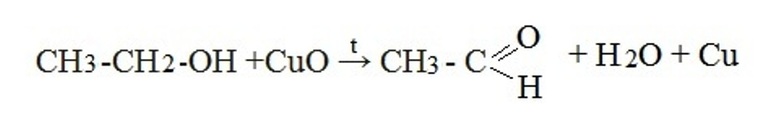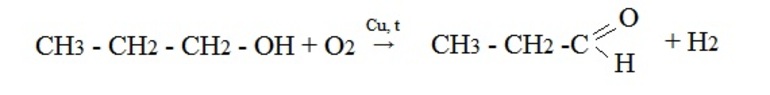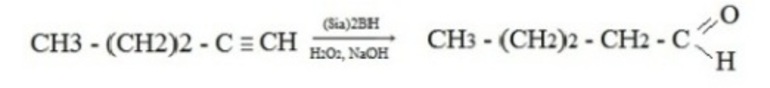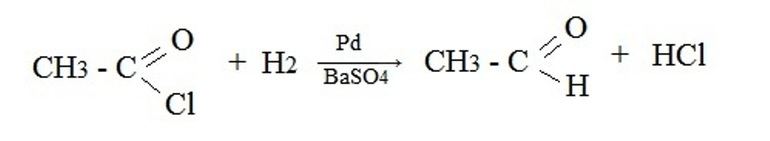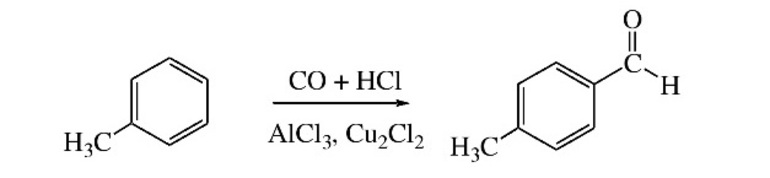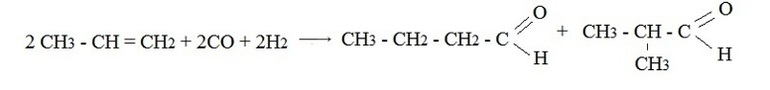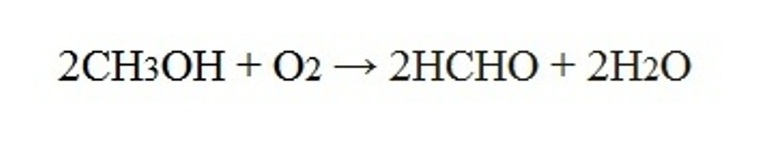В промышленности ацетальдегид получают тремя способами:
1. Гидратация ацетилена (реакция Кучерова)
2. Гидратация этилена до этанола с его последующим дегидрированием
3. Непосредственное окисление этилена кислородом воздуха на PdCl2
наиболее дешевый способ
Окисление идет кислородом в жидкой фазе. При этом к катализатору PdCl2 добавляют сокатализатор СиС12и раствор подкисляют НС1; 100-130 °С, 0,3-1,0 МПа.
В системе протекают окислительно-восстановительные реакции:
Медь выступает в роли переносчика кислорода. Суммарное уравнение окисления:
Можно проводить как в одну стадию в одном реакторе, так и в нескольких реакторах. Чаще проводят в одну стадию.
Технологическая схема одностадийного синтеза ацетальдегида при окислении этилена кислородом
В реактор 1 типа пустотелой барботажной колонны, заполненной катализаторным раствором, подают кислород и этилен (свежий и рециркулирующий). Реактор работает с постоянным уровнем жидкости при 130°С и 0,3 МПа. Избыточный этилен выдувает из раствора образовавшийся ацетальдегид, чем предотвращаются побочные реакции его конденсации. Вместе с ацетальдегидом испаряется часть воды, которую конденсируют в холодильнике 3 и возвращают в реактор.
Газопаровую смесь направляют в абсорбер 4, где ацетальдегид поглощают водой, орошающей насадку абсорбера. Основное количество остаточного газа, содержащего этилен, немного кислорода и инертные примеси, возвращают на окисление, дожимая его циркуляционным компрессором 2. Меньшую часть газа выводят с установки во избежание чрезмерного накопления в нем инертных примесей. Водный раствор ацетальдегида из куба абсорбера 4 поступает в отпарную колонну 5, где отгоняют растворенные газы и летучие примеси. Затем в колонне 6 в виде дистиллята получают ацетальдегид, а большую часть кубовой жидкости, содержащей менее летучие побочные продукты (кротоновый альдегид и др.), возвращают после охлаждения на абсорбцию. Часть этой жидкости выводят в систему очистки сточных вод.
По сравнению с двухстадийным процессом одностадийный синтез ацетальдегида дает экономию в капиталовложениях и расходе энергии, но связан с применением более дорогостоящего окислителя (кислород). Показатели этих методов в общем близки, и оба они успешно эксплуатируются в промышленности.
Окислительное сочетание на PdCl2
Этим способом получают винилацетат, этиленгликольдиацетат. Винилацетат получают вииилированием уксусной кислоты, однако при этом используется дорогое сырье (ацетилен), поэтому большее значение для получения винилацетата имеет окислительное сочетание этилена и уксусной кислоты на PdCl2
Процесс может осуществляться в жидкой фазе, в барботажной колонне, но при этом образуется много побочных продуктов, поэтому чаще этот процесс ведут в газовой фазе на гетерогенном катализаторе PdCl2+CH3-COONa на носителе. Температура 160-170 °С. Давление 1,5 МПа. Реактор трубчатый. Этилен : уксусная кислота : кислород =8:4:1.
Видео:ЭТО ПОМОЖЕТ разобраться в Органической Химии — Алкены, Урок ХимииСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Видео:Опыты по химии. Получение ацетилена и опыты с нимСкачать  Получение альдегидов — уравнения химических реакцийВидео:Опыты по химии. Получение этилена и опыты с нимСкачать  Получение альдегидов в лабораторииВсе свойства химических веществ зависят от электронного строения их молекул. В карбонильной группе атом кислорода, как более электроотрицательный по сравнению с атомом углерода, перетягивает на себя электронную плотность двойной связи. Это ведет к поляризации связи и появлению частичных зарядов — положительного заряда у углерода и отрицательного у кислорода. В карбоксильной группе степень окисления углерода равна +1, это промежуточный заряд, который можно достигнуть с помощью окисления или восстановления различных углеродсодержащих веществ. Ряд кислородсодержащих органических соединений с повышением степени окисления углерода, связанного с функциональной группой, выглядит следующим образом: Спирты → Альдегиды → Карбоновые кислоты. Таким образом, все лабораторные методы получения карбонильных соединений можно условно разделить на 3 группы:
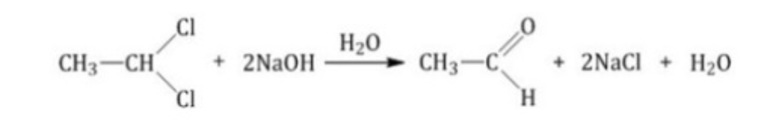
Окислительные методыВ качестве исходных веществ в реакциях окисления используют первичные спирты, дигалогенпроизводные алканов и алкины. При окислении вторичных спиртов получаются кетоны, таким образом, получение альдегидов и кетонов имеет схожий механизм. Рассмотрим примеры химических уравнений.
В результате обратной реакции восстановления карбонильных соединений получаются исходные вещества, которые были взяты для их получения.
Восстановительные методыВ качестве исходных реагентов используют производные карбоновых кислот: хлорангидриды, сложные эфиры, амиды и т.п. Например, восстановление водородом хлорангидрида уксусной кислоты на палладиевом катализаторе: Ароматические альдегидыАроматические альдегиды можно получить в лаборатории теми же способами, что и альдегиды жирного ряда. Это могут быть реакции дегидратации и дегидрирования ароматических спиртов, гидролиз дигалогенпроизводных углеводородов ароматического ряда, восстановление производных карбоновых кислот. Уравнения этих взаимодействий будут аналогичны тем, которые были рассмотрены выше. Специфической реакцией лабораторного синтеза ароматических альдегидов является введение в ароматическое ядро карбоксильной группы – формилирование. Исходные вещества – любой ароматический углеводород, угарный газ плюс хлористый водород, катализатор — смесь хлористого алюминия с монохлоридом меди. Видео:Химия с нуля — АЛКИНЫ, Тройная связь, Типы Гибридизации // Органическая ХимияСкачать  Промышленные способыВ настоящее время известен целый ряд электросинтезов альдегидов, которые перспективны в промышленном производстве лекарственных, парфюмерных, реактивных и других препаратов. Один из наиболее распространенных способов – оксосинтез. Этим способом можно получить карбонильные соединения, содержащие в своем составе три атома углерода и более. В основе реакции лежит гидроформилирование алкенов синтез-газом (смесь угарного газа с водородом).
Дегидрирование первичных спиртов используется в промышленности только для получения уксусного альдегида. В качестве сырья выступает этиловый спирт, важным условием реакции является наличие катализатора (медь, активированная церием) и высоких температур в пределах 270-300˚С. За один цикл в реакцию вступает 25-50% этанола, выход продукта составляет 90-95%. В виде побочных продуктов реакции образуются этилен, этилацетат и высшие спирты. При производстве формальдегида (метаналя) используется процесс окисления муравьиного спирта при температуре 400-450˚С, одно из условий – избыток кислорода. В качестве катализатора выступают оксиды железа и молибдена. Получение ацетальдегида в результате гидратации ацетилена потеряло свое промышленное значение. Причиной является высокая токсичность катализатора реакции – ртути сернокислой. Ацетальдегид и акролеин в промышленности получают в результате окисления алкенов. Реакция проходит в присутствии смеси хлоридов палладия и меди. В качестве сырья для получения уксусного альдегида используют этилен, для получения акролеина – пропилен. Основным сырьем для получения различных ароматических карбонильных соединений является бензальдегид. Промышленное получение бензальдегида основывается на реакции гидролиза бензальхлорида. В качестве гидролизующих агентов используют углекислые соли натрия или кальция, гидроксиды натрия или кальция, а также кислоты с добавлением соответствующих солей металлов.
💥 ВидеоХимия с нуля — Химические свойства АлкеновСкачать  4.2. Алкадиены (диены): Способы получения. ЕГЭ по химииСкачать  Составление уравнений химических реакций. 1 часть. 8 класс.Скачать  7 ВАЖНЕЙШИХ РЕАКЦИЙ, которые тебе нужно знать (Алкины)Скачать  10.2. Альдегиды и кетоны: Способы получения. ЕГЭ по химииСкачать  Способы получения алкадиенов | Химия ЕГЭ для 10 класса | УмскулСкачать  Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать  Получение ацетиленаСкачать  Решение задач на термохимические уравнения. 8 класс.Скачать  10.1. Альдегиды и кетоны: Строение, номенклатура, изомерия. ЕГЭ по химииСкачать  Составление уравнений реакций горения. 11 класс.Скачать  Качественная реакция на альдегиды с гидроксидом медиСкачать  Вся теория по алкинам | Химия ЕГЭ для 10 класса | УмскулСкачать  3.2. Алкины: Способы полученияСкачать  Видео №3. Как составить изомерыСкачать  Задачи по химии. Получение уксусного альдегида. Стехиометрические цепочкиСкачать  |