Этанол C2H5OH или CH3CH2OH, этиловый спирт – это органическое вещество, предельный одноатомный спирт .
Общая формула предельных нециклических одноатомных спиртов: CnH2n+2O.
- Строение этанола
- Водородные связи и физические свойства спиртов
- Изомерия спиртов
- Структурная изомерия
- Химические свойства этанола
- 1.1. Взаимодействие с раствором щелочей
- 1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
- 2. Реакции замещения группы ОН
- 2.1. Взаимодействие с галогеноводородами
- 2.2. Взаимодействие с аммиаком
- 2.3. Этерификация (образование сложных эфиров)
- 2.4. Взаимодействие с кислотами-гидроксидами
- 3. Реакции замещения группы ОН
- 3.1. Внутримолекулярная дегидратация
- 3.2. Межмолекулярная дегидратация
- 4. Окисление этанола
- 4.1. Окисление оксидом меди (II)
- 4.2. Окисление кислородом в присутствии катализатора
- 4.3. Жесткое окисление
- 4.4. Горение спиртов
- 5. Дегидрирование этанола
- Получение этанола
- 1. Щелочной гидролиз галогеналканов
- 2. Гидратация алкенов
- 3. Гидрирование карбонильных соединений
- 4. Получение этанола спиртовым брожением глюкозы
- Окисление этилового спирта до уксусной кислоты
- Как из этилового спирта получить уксусную кислоту уравнение реакции
- 🎬 Видео
Видео:Химический видео Опыт Сода+ Уксус. Уравнение реакций. Простой опыт по ХИМИИ.Скачать

Строение этанола
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
| Атом кислорода в спиртах находится в состоянии sp 3 -гибридизации. |
В образовании химических связей с атомами C и H участвуют две 2sp 3 -гибридные орбитали, а еще две 2sp 3 -гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108 о .
Водородные связи и физические свойства спиртов
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому этанол – жидкость с относительно высокой температурой кипения (температура кипения этанола +78 о С).
Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому спирты очень хорошо растворимы в воде. Молекулы спиртов в воде гидратируются:
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Этанол смешивается с водой в любых соотношениях.
Видео:Опыты по химии. Получение сложного эфираСкачать

Изомерия спиртов
Видео:Опыты по химии. Окисление спирта в альдегидСкачать

Структурная изомерия
Для этанола характерна структурная изомерия – межклассовая изомерия.
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Спирты являются межклассовыми изомерами с простыми эфирами. Общая формула и спиртов, и простых эфиров — CnH2n+2О.
| Например. Межклассовые изомеры с общей формулой С2Н6О этиловый спирт СН3–CH2–OH и диметиловый эфир CH3–O–CH3 |
| Этиловый спирт | Диметиловый эфир |
| СН3–CH2–OH | CH3–O–CH3 |
Видео:Как получить этиловый спирт?Скачать

Химические свойства этанола
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
1. Кислотные свойства
| Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
При взаимодействии этанола с растворами щелочей реакция практически не идет, т. к. образующийся алкоголят почти полностью гидролизуется водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому этанол не взаимодействуют с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Этанол взаимодействует с активными металлами (щелочными и щелочноземельными).
| Например, этанол взаимодействует с калием с образованием этилата калия и водорода . |
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
| Например, этилат калия разлагается водой: |
Видео:7.3. Спирты: Способы получения. ЕГЭ по химииСкачать

2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии спиртов с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
| Например, этанол реагирует с бромоводородом. |
2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
| Например, при взаимодействии этанола с аммиаком образуется этиламин. |
2.3. Этерификация (образование сложных эфиров)
Одноатомные и многоатомные спирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.
| Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты): |
2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
| Например, при взаимодействии этанола с азотной кислотой образуется сложный эфир этилнитрат : |
Видео:РЕАКЦИЯ ЭТЕРИФИКАЦИИСкачать

Видео:Лабораторная работа №16. Свойства уксусной кислоты. 9 класс.Скачать

3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.1. Внутримолекулярная дегидратация
При высокой температуре (больше 140 о С) происходит внутримолекулярная дегидратация и образуется соответствующий алкен.
| Например, из этанола под действием концентрированной серной кислоты при температуре выше 140 градусов образуется этилен: |
Видео:Получение этилена из этилового спиртаСкачать

В качестве катализатора этой реакции также используют оксид алюминия.
3.2. Межмолекулярная дегидратация
При низкой температуре (меньше 140 о С) происходит межмолекулярная дегидратация по механизму нуклеофильного замещения: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
| Например, при дегидратации этанола при температуре до 140 о С образуется диэтиловый эфир: |
Видео:Получение этилового эфира уксусной кислоты.Скачать

4. Окисление этанола
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
| При окислении первичных спиртов они последовательно превращаются сначала в альдегиды, а потом в карбоновые кислоты. Глубина окисления зависит от окислителя. Первичный спирт → альдегид → карбоновая кислота |
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
4.1. Окисление оксидом меди (II)
Cпирты можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества.
| Например, этанол окисляется оксидом меди до уксусного альдегида |
4.2. Окисление кислородом в присутствии катализатора
Cпирты можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.).
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) первичные спирты окисляются до карбоновых кислот.
| Например, при взаимодействии этанола с перманганатом калия в серной кислоте образуется уксусная кислота |
4.4. Горение спиртов
Образуются углекислый газ и вода и выделяется большое количество теплоты.
| Например, уравнение сгорания этанола: |
Видео:Получение ЛЕДЯНОЙ УКСУСНОЙ кислоты!Скачать

5. Дегидрирование этанола
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования.
| Например, при дегидрировании этанола образуется этаналь |
Видео:Несколько лайфхаков со спиртом. Химия – просто.Скачать

Получение этанола
Видео:Опыты ХимияСкачать

1. Щелочной гидролиз галогеналканов
При взаимодействии галогеналканов с водным раствором щелочей образуются спирты. Атом галогена в галогеналкане замещается на гидроксогруппу.
| Например, при нагревании хлорэтана с водным раствором гидроксида натрия образуется этанол |
Видео:Получение КРЕМНИЕВОЙ КИСЛОТЫ. Реакция СИЛИКАТА НАТРИЯ и УКСУСНОЙ КИСЛОТЫ.Опыты по химии.SILICIC ACIDСкачать

2. Гидратация алкенов
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
| Например, при взаимодействии этилена с водой образуется этиловый спирт. |
Видео:Синтез нонилового эфира уксусной кислотыСкачать

3. Гидрирование карбонильных соединений
Присоединение водорода к альдегидам и кетонам протекает при нагревании в присутствии катализатора. При гидрировании альдегидов образуются первичные спирты, при гидрировании кетонов — вторичные спирты, а из формальдегида образуется метанол.
| Например, при гидрировании этаналя образуется этанол |
Видео:Можно ли отличить опасный для здоровья метанол от этилового спиртаСкачать

Видео:Взаимодействие уксусной кислоты с раствором щелочиСкачать

4. Получение этанола спиртовым брожением глюкозы
Для глюкозы характерно ферментативное брожение, то есть распад молекул на части под действием ферментов. Один из вариантов — спиртовое брожение.
Видео:Ледяная уксусная кислотаСкачать

Окисление этилового спирта до уксусной кислоты
Уксусная кислота образуется из этилового спирта в процессе дыхания уксусно-кислых бактерий:
Химизм процесса. Уксусно-кислые бактерии обладают ферментом алкогольдегидрогеназой. Окисление этилового спирта протекает в две стадии: первым промежуточным соединением является уксусный альдегид, который затем окисляется в уксусную кислоту.
106 Глава 3. Биохимические процессы, вызываемые микроорганизмами
Возбудители процесса — ускусно-кпслые бактерии — бесспоровые палочки, грамотрицательные, строгие аэробы. Среди них есть подвижные и неподвижные формы. Они кислотоустойчивы и некоторые могут развиваться при рН среды около 3,0; оптимальное значение рН — 5,4-6,3г
Уксусно-кислые бактерии отнесены к двум родам:
Gluconobacter (Аcetomonas) — палочки с полярными жгутиками, не способные окислять уксусную кислоту, и Acetobacner— перитрихи, способные окислять уксусную кислоту до СО2 и воды.
Уксусно-кислые бактерии различаются размерами клеток, устойчивостью к спирту, способностью накапливать в среде большее или меньшее количество уксусной кислоты и другими признаками. Например, А. acete накапливает в среде до 6% уксусной кислоты, А. acete subsp. orleanensis — до 9,5, А. acete subsp. xylinum — до 4,5%. А. acete выдерживают довольно высокую концентрацию спирта — до 9-11%, А. acete subsp. xylinum — лишь 5-7%.
Растут уксусно-кислые бактерии в интервале температур 5-40°С, оптимум — около 30°С. Некоторые из них способны синтезировать витамины — В 1 В2, В12, однако многие сами нуждаются в витаминах.
Уксусно-кислые бактерии часто встречаются в виде длинных нитей и многие образуют пленки на поверхности субстрата. Например, для A. pasteurianus характерна сухая морщинистая пленка, для А. acete subsp. xylinum — мощная хрящевидная пленка, в состав ее входит клетчатка. Некоторые бактерии образуют лишь островки пленки на поверхности жидкости или кольцо около стенок сосуда.
Уксусно-кислым бактериям свойственна изменчивость формы клеток. Так, в неблагоприятных условиях развития бактерии приобретают необычную форму — толстые длинные нити, иногда раздутые, уродливые клетки (рис. 24).
Уксусне-кислые бактерии широко распространены в природе, они встречаются на поверхности растений, в зрелых плодах, ягодах, в квашеных овощах, вине, пиве, квасе.
Практическое значение процесса. Процесс окисления этилового спирта до уксусной кислоты лежит в основе получения уксуса для пищевых целей.
Рис 24. Пленка уксусно-кислых бактерий
Процесс осуществляют в специальных башневйдных чанах-генераторах, внутри которых неплотно заложены буковые стружки. В верхней части генератора имеются приспособления для равномерного орошения стружек перерабатываемым спиртсодержащим субстратом. Исходным сырьем служит уксусно-спиртовой раствор с питательными (для бактерий) солями или разбавленное подкисленное вино. Под-кисление субстрата необходимо для предотвращения развития вредителей производства — пленчатых дрожжей и слизёобразующих непроизводственных видов уксусно-кис- ‘ лых бактерий, которые могут попасть извне. Производственной культурой чаще всего служит А.асеН. В стенках генератора имеются отверстия для засасывания (или вдувания) воздуха. Чем лучше аэрация, тем активнее протекает процесс. По мере протекания субстрата по стужкам уксусно-кислые бактерии, обильно заселяющие стружки, окисляют спирт в уксусную кислоту, и в нижней части аппарата накапливается готовый уксус, который периодически сливают.
Уксусно-кислые бактерии могут при недостатке спирта окислять уксусную кислоту до СО2 и воды. Этот процесс называется переокислением, он опасен для производства.
В настоящее время процесс производства уксуса ведут «глубинным» способом в герметически закрытых аппаратах, в которых спиртсодержащий субстрат с введенными в него уксусно-кислыми бактериями аэрируется и перемешивается непрерывно подаваемым в аппарат стерильным воздухом. Этот метод имеет ряд преимуществ: требуется меньше производственных площадей, процесс автоматизирован и протекает значительно быстрее, исключено попадание инфекции извне.
Дата добавления: 2014-12-15 ; просмотров: 6018 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Видео:Получение уксусноэтилового эфираСкачать

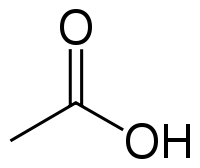
Как из этилового спирта получить уксусную кислоту уравнение реакции
Уксусная кислота (этановая кислота), CH3COOH — слабая, предельная одноосновная карбоновая кислота.
Уксусная кислота представляет собой бесцветную жидкость с характерным резким запахом и кислым вкусом. Гигроскопична. Неограниченно растворима в воде. Смешивается с многими растворителями; в уксусной кислоте хорошо растворимы органические соединения и газы, такие как HF, HCl, HBr, HI и другие. Существует в виде циклических и линейных димеров.
Получение уксусной кислоты
Уксусную кислоту можно получить окислением ацетальдегида кислородом воздуха. Процесс проводят в присутствии катализатора — ацетата марганца (II) Mn(CH3COO)2 при температуре 50–60 °С:
2 CH3CHO + O2 → 2 CH3COOH
В промышленности её получают из метанола и оксида углерода (II) по реакции:
CH3OH + CO → CH3COOH Катализаторами служат соединения Rh (процесс фирмы Monsanto) или Ir (процесс фирмы BP).
По другому методу уксусную кислоту получают при окислении н-бутана при температуре 200 °C и давлении 50 атм в присутствии кобальтового катализатора.
2CH3CH2CH2CH3 + 5O2 → 4CH3COOH + 2H2O
Старые способы — карбонилирование метанола на кобальтовых катализаторах (BASF); парциальное окисление бутана (Celanese) или этилена (Wacker) вытеснены как неконкурентоспособные.
Биохимическое производство уксусной кислоты брожением (уксуснокислое брожение). В качестве сырья используются этанолсодержащие жидкости (вино, забродившие соки), а также кислород. В качестве вспомогательных веществ — ферменты уксуснокислых бактерий или грибков (дрожжи). В этом процессе этанол биокаталитически окисляется до уксусной кислоты:
СН3СН2ОН + О2 → СН3СООН + Н2О
Химические свойства
Уксусная кислота диссоциирует по уравнению CH3COOH → CH3COO− + H+
Уксусная кислота проявляет кислотные свойства. Она взаимодействует с активными металлами,образуя соли — ацетаты:
Mg(тв) + 2CH3COOH → (CH3COO)2Mg + H2
Реакции по α-углеродному атому.
Водородные атомы у α-углерода более подвижны, чем другие атомы водорода в цепи, что приводит к возможности их замещения, например, на атом галогена:
CH3COOH + Cl2 → CH2ClCOOH + HCl
Эта реакция будет протекать до тех пор, пока не получится трихлоруксусный альдегид (CCl3COOH)
Области применения уксусной кислоты
70-80 % водный раствор уксусной кислоты называют уксусной эссенцией, а 3-6 % — уксусом. Водные растворы уксусной кислоты широко используются в пищевой промышленности (пищевая добавка E260) и бытовой кулинарии, а также в консервировании.
Уксусную кислоту применяют для получения лекарственных и душистых веществ, как растворитель (например, в производстве ацетилцеллюлозы, ацетона). Она используется в книгопечатании и крашении.
Уксусная кислота используется как реакционная среда для проведения окисления различных органических веществ. В лабораторных условиях это, например, окисление органических сульфидов пероксидом водорода, в промышленности — окисление пара-ксилола кислородом воздуха в терефталевую кислоту.
Большое количество уксусной кислоты применяется в химической промышленности, для синтеза малеинового ангидрида, хлоруксусной кислоты, а также для производства ацетатов (солей и эфиров уксусной кислоты)
В настоящее время в России уксусная кислота производиться на единственном предприятии ОАО «Невинномысский Азот», который производит нижеследующую кислоту.
Кислота уксусная (синтетическая)
ОСНОВНЫЕ ТЕХНИЧЕСКИЕ ХАРАКТЕРИСТИКИ
Основные показатели
Уксусную кислоту транспортируют в чистых железнодорожных цистернах с внутренней поверхностью из нержавеющей стали с верхним сливом, в бочках из нержавеющей стали вместимостью до 200 дм3, в стеклянных бутылях, вместимостью до 20 дм3, а также в алюминиевых бочках, вместимостью до 275 дм3. Бочки и бутыли с уксусной кислотой транспортируют железнодорожным, автомобильным и водным транспортом, в соответствии с правилами перевозок опасных грузов, действующими на соответствующих видах транспорта. Гарантийный срок хранения — 1 год со дня изготовления продукта.
C анализом рынка уксусной кислоты Вы можете познакомиться в отчете Академии Конъюнктуры Промышленных Рынков «Мировой и российский рынок уксусной кислоты».
🎬 Видео
Получение концентрированной уксусной кислоты.Скачать

Получение уксусной кислоты. БГПУ 5Б/ХСкачать