| Этилацетат | |||
|---|---|---|---|
| |||
| Хим. формула | C4H8O2 | ||
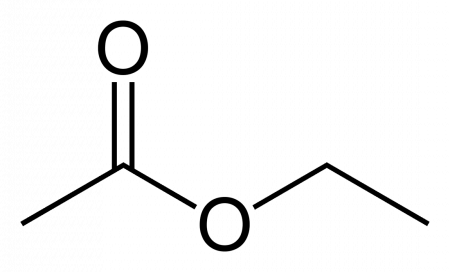
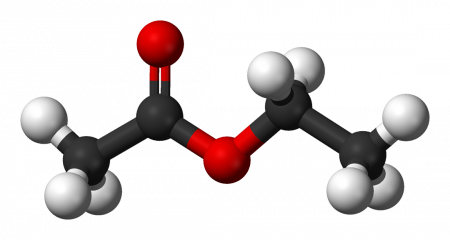
| Рац. формула | CH3-COO-CH2-CH3 | ||
| Молярная масса | 88,11 г/моль | ||
| Плотность | 0,902 г/см³ | ||
| Поверхностное натяжение | 25,13 ± 0,01 мН/м , 23,39 ± 0,01 мН/м , 20,49 ± 0,01 мН/м , 17,58 ± 0,01 мН/м и 14,68 ± 0,01 мН/м | ||
| Динамическая вязкость | 0,578 ± 0,001 мПа·с , 0,423 ± 0,001 мПа·с , 0,325 ± 0,001 мПа·с и 0,259 ± 0,001 мПа·с | ||
| Энергия ионизации | 10,01 ± 0,01 эВ | ||
| Температура | |||
| • плавления | −84 °C | ||
| • кипения | 77 °C | ||
| • вспышки | 24 ± 1 °F и −4 ± 1 °C | ||
| Пределы взрываемости | 2 ± 1 об.% и 2 ± 0,1 об.% | ||
| Давление пара | 73 ± 1 мм рт.ст. , 10 ± 1 кПа , 12,6 ± 0,1 кПа и 100 ± 1 кПа | ||
| Показатель преломления | 1,3720 | ||
| Дипольный момент | 1,78 ± 0,09 Д | ||
| ГОСТ | ГОСТ 8981-78 ГОСТ 22300-76 | ||
| Рег. номер CAS | 141-78-6 | ||
| PubChem | 8857 | ||
| Рег. номер EINECS | 205-500-4 | ||
| SMILES | |||
| Кодекс Алиментариус | E1504 | ||
| RTECS | AH5425000 | ||
| ChEBI | 27750 | ||
| ChemSpider | 8525 | ||
| Токсичность | малотоксично | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Этилацетат (этиловый эфир уксусной кислоты) CH3−COO−CH2−CH3 — бесцветная летучая жидкость с резким запахом.
- Содержание
- Получение
- Физические свойства
- Применение
- Лабораторное применение
- Очистка и сушка
- Охрана труда
- Сложные эфиры: способы получения и свойства
- Классификация сложных эфиров
- По числу карбоксильных групп:
- Номенклатура сложных эфиров
- Химические свойства сложных эфиров
- 2. Переэтерификация
- 3.Восстановление сложных эфиров
- Получение сложных эфиров
- 1. Этерификация карбоновых кислот спиртами
- 2. Соли карбоновых кислот с галогеналканами
- Acetyl
- 🌟 Видео
Видео:УКВХ. Таубаева Э.Ж. Практическая работа. Синтез этилового эфира уксусной кислотыСкачать

Содержание
- 1 Получение
- 2 Физические свойства
- 3 Применение
- 3.1 Лабораторное применение
- 4 Очистка и сушка
- 5 Охрана труда
Видео:Опыты по химии. Получение сложного эфираСкачать

Получение
Этилацетат образуется при прямом взаимодействии этанола с уксусной кислотой (реакция этерификации):
Лабораторный метод получения этилацетата заключается в ацетилировании этилового спирта хлористым ацетилом или уксусным ангидридом:
К промышленным способам синтеза этилацетата относятся:
- Перегонка смеси этилового спирта, уксусной и серной кислот.
- Обработка этилового спирта кетеном.
- Дегидратация этилового спирта при повышенных температурах и давлении.
- Синтез по реакции Тищенко из ацетальдегида при 0-5 °C в присутствии каталитических количеств алкоголята алюминия:
2CH3CHO → CH3COOC2H5
Видео:Получение этилового эфира уксусной кислоты.Скачать

Физические свойства
Бесцветная подвижная жидкость с резким запахом эфира. Молярная масса 88,11 г/моль, температура плавления −83,6 °C, температура кипения 77,1 °C, плотность 0,9001 г/см³, n 20 4 1,3724. Растворяется в воде 12 % (по массе), в этаноле, диэтиловом эфире, бензоле, хлороформе; образует двойные азеотропные смеси с водой (т. кип. 70,4 °C, содержание воды 8,2 % по массе), этанолом (71,8; 30,8), метанолом (62,25; 44,0), изопропанолом (75,3; 21,0), CCl4 (74,7; 57), циклогексаном (72,8; 54,0) и тройную азеотропную смесь Э.: вода: этанол (т. кип. 70,3 °C, содержание соотв. 83,2, 7,8 и 9 % по массе).
Видео:Любой Уксуса из Уксусной кислоты ЛЕГКО!Скачать

Применение
Этилацетат широко используется как растворитель, из-за низкой стоимости и малой токсичности, а также приемлемого запаха. В частности, как растворитель полиуретана, нитроцеллюлозы, ацетилцеллюлозы, жиров, восков, для чистки печатных плат, в смеси со спиртом — растворитель в производстве искусственной кожи. Годовое мировое производство в 1986 году составляло 450—500 тысяч тонн, в 2014 год — около 3,5 млн тонн в год.
Один из самых популярных ядов, применяемых в энтомологических морилках для умерщвления насекомых. Насекомые после умертвления в его парах гораздо мягче и податливее в препарировании, чем после умерщвления в парах хлороформа.
Обладая фруктовым запахом применяется как компонент фруктовых эссенций. Зарегистрирован в качестве пищевой добавки E1504 (ароматизатор). Добавляется в состав водок (либо образуется при реакции содержащегося в них этилового спирта с добавляемыми уксусной кислотой или уксуснокислыми солями) для смягчения запаха и вкуса спирта.
Лабораторное применение
Этилацетат часто используется для экстракции, а также для колоночной и тонкослойной хроматографии. Редко в качестве растворителя для проведения реакций из-за склонности к гидролизу и переэтерефикации.
Используется для получения ацетоуксусного эфира:
Видео:Как из 70 уксусной кислоты сделать уксусную эссенцию любого процентаСкачать

Очистка и сушка
Продажный этилацетат обычно содержит воду, спирт и уксусную кислоту. Для удаления этих примесей его промывают равным объёмом 5 % карбоната натрия, сушат хлоридом кальция и перегоняют. При более высоких требованиях к содержанию воды несколько раз (порциями) добавляют фосфорный ангидрид, фильтруют и перегоняют, защищая от влаги. С помощью молекулярного сита 4А содержание воды в этилацетате можно снизить до 0,003 %.
Видео:Лабораторная работа №16. Свойства уксусной кислоты. 9 класс.Скачать

Охрана труда
Предельно-допустимая концентрация этилацетата в воздухе рабочей зоны составляет 50 мг/м 3 (среднесменная, за 8 часов) и 200 мг/м 3 (максимально-разовая). Но по данным порог восприятия запаха в группе людей (среднее значение) может достигать, например, 1120 мг/м³. А у отдельных людей он может быть значительно больше среднего значения. По этой причине можно ожидать, что использование широко распространённых фильтрующих СИЗОД в сочетании с «заменой фильтров по появлении запаха под маской» (как это почти всегда рекомендуется в РФ поставщиками) приведёт к чрезмерному воздействию паров этилацетата на, по крайней мере, часть работников — из-за запоздалой замены противогазных фильтров. Для защиты от этилацетата следует использовать более эффективные изменение технологии и средства коллективной защиты.
ЛД50 для крыс составляет 11,6 г/кг, показывая низкую токсичность. Пары этилацетата раздражают слизистые оболочки глаз и дыхательных путей, при действии на кожу вызывают дерматиты и экземы. ПДК в воздухе рабочей зоны 200 мг/м³. ПДК в атмосферном воздухе населенных мест 0,1 мг/м³.
Температура вспышки — 2 °C, температура самовоспламенения — 400 °C, концентрационные пределы взрыва паров в воздухе 2,1—16,8 % (по объёму).
Безопасность при транспортировке: в соответствии с ДОПОГ (ADR) класс опасности 3, код по реестру ООН 1173.
Видео:Получение уксусной кислоты из ацетата натрия (Synthesis of acetic acid from sodium acetate)Скачать

Сложные эфиры: способы получения и свойства
Сложные эфиры: способы получения, химические и физические свойства, строение.
| Сложные эфиры – это органические вещества, в молекулах которых углеводородные радикалы соединены через карбоксильную группу -СОО-, а именно R1-COOH-R2. |
Общая формула предельных сложных эфиров: СnH2nO2
Видео:Взаимодействие уксусной кислоты с металламиСкачать

Классификация сложных эфиров
Видео:Химия, 12-й класс, Практическая работа № 1 Химические свойства уксусной кислотыСкачать

По числу карбоксильных групп:
- сложные эфиры одноосновных карбоновых кислот — содержат одну карбоксильную группу -СОО-. Общая формула CnH2nO2.
| Например, метилформиат |
- сложные эфиры многоатомных спиртов — содержат две и более карбоксильные группы -СОО-.
| Например, тристеарат глицерина |
- Сложные эфиры многоосновных органических кислот.
Например, общая формула сложных эфиров двухосновных карбоновых кислот CnH2n-2O4
Видео:Качественная Реакция На Салициловую И Уксусную КислотуСкачать

Номенклатура сложных эфиров
В названии сложного эфира сначала указывают алкильную группу, связанную с кислородом, затем кислоту, заменяя суффикс в названии кислоты (-овая кислота) на суффикс -оат.
| Название сложного эфира | Тривиальное название | Формула эфира |
| Метилметаноат | Метилформиат | HCOOCH3 |
| Этилметаноат | Этилформиат | HCOOC2H5 |
| Метилэтаноат | Метилацетат | CH3COOCH3 |
| Этилэтаноат | Этилацетат | CH3COOC2H5 |
| Пропилэтаноат | Пропилацетат | CH3COOCH2CH2CH3 |
Видео:Получение ЛЕДЯНОЙ УКСУСНОЙ кислоты!Скачать

Химические свойства сложных эфиров
| Сложные эфиры устойчивы в нейтральной среде, но легко разлагаются при нагревании в присутствии кислот или в присутствии щелочей. |
В присутствии кислот гидролиз сложных эфиров протекает как реакция, обратная этерификации. при гидролизе сложных эфиров образуются спирты и карбоновые кислоты.
R-COO-R’ + H2O = R-COOH + R’-OH
Например , при гидролизе метилацетата образуются уксусная кислота и метанол.
При щелочном гидролизе сложных эфиров образуются соли карбоновых кислот и спирты.
Например , при щелочном гидролизе этилформиата образуются этанол и формиат натрия:
При щелочном гидролизе этилацетата образуются ацетат и этанол:
Щелочной гидролиз сложных эфиров — реакция, имеющая промышленное значение. Гидролиз жиров в присутствии оснований — древнейший способ получения мыла. Первые способы получения мыла связаны со смешиванием жира с золой. Один из основных компонентов животного жира — тристеарат глицерина. В щелочной среде тристеарат глицерина разлагается на глицерин и соль стеариновой кислоты:
Видео:Сложные эфиры и мыла. 2 часть. 11 класс.Скачать

2. Переэтерификация
Переэтерификация — это реакция превращения одного сложного эфира в другой под действием соответствующих спиртов в присутствии катализатора (кислоты или основания)
R-COO-CH3 + R’-OH = R-COOR’ + CH3-OH
Видео:Практическая работа.Получение и свойства уксусной кислоты.Скачать

3.Восстановление сложных эфиров
Сложные эфиры восстанавливаются с разрывом связи С-О карбоксильной группы. При этом образуется смесь спиртов.
| Например, этилбензоат восстанавливается литийалюминийгидридом до бензилового спирта и этанола |
Видео:Как Сделать 6 и 9 уксус из 70 Уксу�Скачать

Получение сложных эфиров
Видео:Химический видео Опыт Сода+ Уксус. Уравнение реакций. Простой опыт по ХИМИИ.Скачать

1. Этерификация карбоновых кислот спиртами
Карбоновые кислоты вступают в реакции с одноатомными и многоатомными спиртами с образованием сложных эфиров.
| Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты): |
Видео:Ледяная уксусная кислотаСкачать

2. Соли карбоновых кислот с галогеналканами
При взаимодействии солей карбоновых кислот с галогеналканами образуются сложные эфиры.
Видео:Как развести 70 процентный уксус до 9 процентов таблицаСкачать

Acetyl
Меня часто просят добавить на сайт ту или иную реакцию.
Но в одиночестве написать тысячи реакций тяжело.
Теперь вы сами можете поучаствовать в улучшении этого сайта!
Все пользовательские реакции проходят через модерацию.
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. 🌟 ВидеоПолучение концентрированной уксусной кислоты.Скачать  Получение уксусной кислоты (реакция ацетата натрия и серной кислоты)Скачать  Химия 41. Состав уксуса. Уксусная кислота — Академия занимательных наукСкачать  |