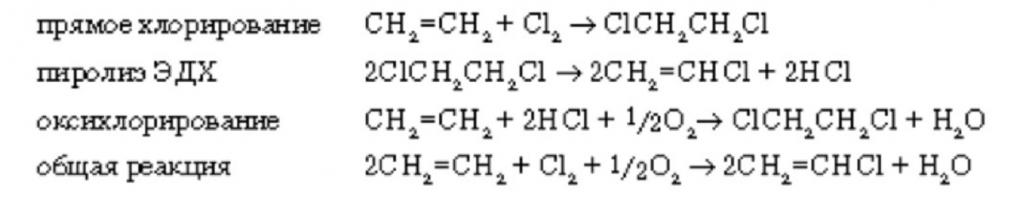Процесс получения винилхлорида сбалансированным методом из этилена состоит из шести стадий:
1. синтез 1,2-дихлорэтана прямым жидкофазным хлорированием этилена,
2. синтез 1,2-дихлорэтана окислительным каталитическим хлорированием этилена,
3. промывка, осушка, ректификация 1,2-дихлорэтана,
4. термическое обьемное дегидрохлорирование 1,2-дихлорэтана,
5. разделение продуктов дегидрохлорирования 1,2-дихлорэтана,
6. ректификация винилхлорида.
2.1. Теоретические основы процесса
Сбалансированный по хлору способ получения винилхлорида из этилена базируется на трех основных реакциях:
Следовательно, он является комбинацией трех процессов: прямого аддитивного хлорирования этилена в 1,2 –дихлорэтан, термического дегидрохлорирования 1,2- дихлорэтана в винилхлорид и окислительного хлорирования этилена в 1,2 –дихлорэтан с помощью хлороводорода, образовавшегося при дегидрохлориировании.[6]
Оксихлорирование протекает с выделением значительного количества тепла, тогда как пиролиз протекает с поглощением значительного количества тепла, а HCl, получаемый при пиролизе, используется в процессе оксихлорирования. Следовательно, необходимо подобрать условия для проведения этих реакций в одном аппарате, что позволит приблизить процесс к адиабатическому и обеспечит протекание процесса пиролиза, т.е. реализовать совмещенно- комбинированный процесс получения 1,2-дихлорэтана и винилхлорида. Этот процесс требует больших затрат энергии. К тому же он имеет низкую селективность. Зависимость изменения энергии Гиббса этой реакции дегидрохлорирования представлена на рис.1 как видно из рис. 1, изменение знака энергии происходит для этой реакции при =500 К, а выше этой температуры преимущественно протекает отщепление НС1. Реакция 2 протекает медленно по молекулярному механизму.
Рис. 1. Зависимость изменения энергии Гиббса от температуры для реакции дегидрохлорирования 1,1 -дихлорэтана
Интерес к термическому дегидрохлорированию был вызван возможностью замены прежнего метода отщепления НС1 под действием щелочи. Этот способ используется также для получения винилиденхлорида и других продуктов. Но в этом процессе образуется много сточных вод (щелочных), а также отходов соли (он требует большого расхода щелочи).
Термическое дегидрохлорирование позволило устранить эти недостатки: реакция протекает при температуре 500°С только под воздействием температуры или в присутствии небольшого количества хлора (в качестве инициатора) и гетерогенных контактов. Поскольку процесс эндотермический, его, как правило, осуществляют в трубчатых реакторах, обогреваемых топочными газами. Такой способ производства винилхлорида оказался более экономичным (на 30 %) по сравнению с щелочным дегидрохлорированием 1,2-дихлорэтана и на 14 % — по сравнению с гидрохлорированием ацетилена.
В этом совмещенном процессе из этилена, хлора и кислорода получается винилхлорид в отсутствие НС1. При этом и себестоимость получаемого мономера снижается на 25—30 % по сравнению с методом, основанным на гидрохлорировании ацетилена.
В этом совмещенном процессе из этилена, хлора и кислорода получается винилхлорид в присутствии HCl. При этом и себестоимость получаемого мономера снижается на 25-30% по сравнению с методом, основанным на гидрохлорировании ацетилена.
2.2.Технологическое оформление процесса получения винилхлорида сбалансированным по хлору методом
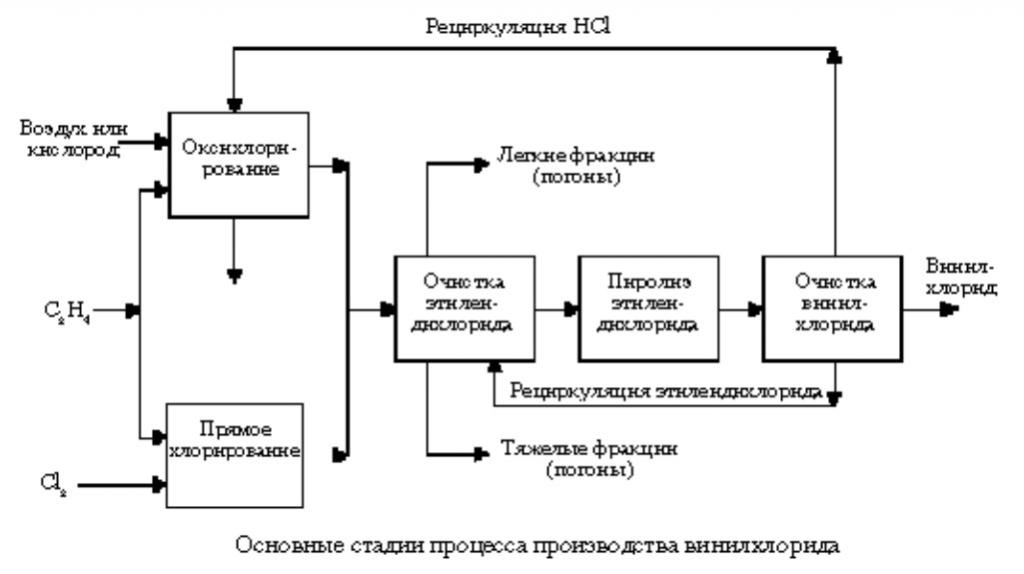
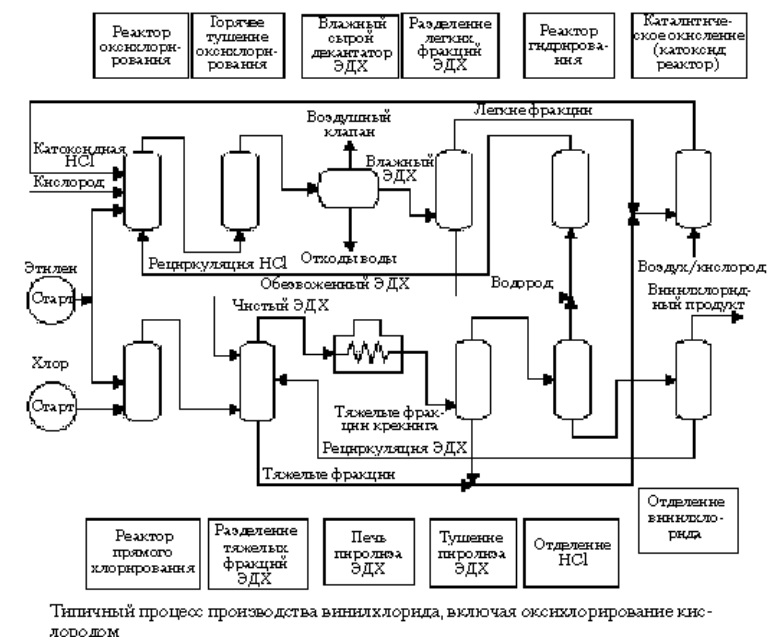
Технологическое оформление процесса получения винилхлорида по комбинированному методу представлена на рис.
Первой стадией этого комбинированного процесса является прямое хлорирование этилена до 1,2-дихлорэтана, которая осуществляется в колонном аппарате 1. Хлор и этилен подаются в нижнюю часть хлоратора через соответствующие барботеры.
Хлоратор до определенного уровня заполняют катализаторным раствором(FeCl3 в 1,2-дихлорэтане). Теплота реакции в нем отводится за счет испарения 1,2-дихлорэтана. Пары 1,2-дихлорэтана конденсируются в холодильнике-конденсаторе 2 и конденсат собирается в сборнике 3. Далее часть конденсата в виде рецикла возвращается в хлоратор 1 для отвода тепла и поддержания определенного уровня. В данном случае наблюдается типичный жидкофазный процесс, в котором теплота реакции отводится за счет испарения продукта. Но это тепло не используется. Более того, образуется большое количество нагретой воды. Следовательно, необходимо вводить систему использования теплоты реакции. Остальная часть конденсата направляется на ректификацию в колонну 16. Кроме того, в сборнике 3 отделяются растворенные газы, которые во избежание потерь 1,2-дихлорэтана дополнительно охлаждают рассолом в холодильнике 2, а затем очищают и выводят из системы.
Процесс оксихлорирования осуществляется в реакторе 5 под давлением 0,5 МПа и при температуре 200—280°С. Катализатор в нем находится в псевдоожиженном слое. Чистый этилен, рециркулирующий газ, воздух и хлорид водорода смешиваются предварительно в смесителе 4. Способ смешения и соотношение компонентов должны быть таковыми, чтобы не образовывались взрывоопасные смеси.
В реакторе 5 тепло отводится за счет встроенного змеевика, в котором испаряется водный конденсат. В результате образуется технический пар, который используется в этом же производстве, например при ректификации.
Полученная реакционная парогазовая смесь, содержащая непрореагировавшие этилен, кислород, хлорид водорода, 1,2-дихлорэтан и инертные газы, поступает в нижнюю часть холодильника- смешения 7. Последний орошается водной смесью 1,2-дихлорэтана, циркулирующей через теплообменник 8насосом 9. Часть раствора хлороводородной кислоты непрерывно отводится из системы. Естественно, эта кислота загрязнена 1,2-дихлорэтаном и поэтому может быть использована при его производстве или должна быть очищена от него для последующего использования.
Охлажденную парогазовую смесь направляют в скруббер 10 для нейтрализации оставшегося НС1. Скруббер орошается раствором NaOH, который подается насосом 9. Часть щелочного раствора непрерывно выводится из системы (этот раствор содержит щелочь, соль и растворенный 1,2-дихлорэтан). Поэтому необходимо разработать способы очистки и утилизации всех продуктов из этого раствора.
В скруббере 10 парогазовая смесь очищается от НС1 и С02 и окончательно охлаждается в холодильнике-конденсаторе 2. Конденсат отделяется от газов в сепараторе 11 поступает во флорентийский сосуд 12, в котором более тяжелый 1,2-дихлорэтан отделяется от воды. Эта вода используется для разбавления щелочи.
Циркулирующий газ (смесь этилена, кислорода и инертных веществ) компрессором 13возвращается в смеситель 4. Чтобы избежать накопления инертов в системе, часть газа выводится из системы для очистки от унесенного 1,2-дихлорэтана. Так как 1,2-дихлорэтан, выходящий из флорентийского сосуда 12, содержит воду(по растворимости), то он направляется в колонну 14 для гетеро- азеотропной осушки. Верхний водный слой флорентийского сосуда также может быть использован для приготовления щелочи или должен быть очищен от 1,2-дихлорэтана гетероазеотропной ректификацией. При этом 1,2-дихлорэтан будет отделен от воды в виде гетероазеотропа.
Таким образом, в ректификационную колонну 16 направляют 1,2-дихлорэтан, полученный как хлорированием, так и оксихлорированием этилена. В этой колонне 1,2-дихлорэтан отделяется от высших хлоридов, которые могут применяться в качестве растворителя. Очищенный же 1,2-дихлорэтан может использоваться в качестве полупродукта при производстве винилхлорида. В этом случае он собирается в емкости 17, а из нее компрессором 13направляется в печь 18, в которой при давлении 1,5—2,0 МПа и температуре 500 °С он пиролизуется до винилхлорида и НС1.[7]
После пиролиза реакционная парогазовая смесь проходит холодильник-смешения 19. Этот холодильник орошается захоложенным в холодильнике 8 1,2-дихлорэтаном. Парогазовая смесь далее охлаждается в холодильнике-конденсаторе 2 и направляется в ректификационную колонну 20. Эта колонна, работающая под давлением, предназначена для отделения НС1. При этом давлении НС1 конденсируется и может возвращаться в виде флегмы, а несконденсированные газы после сепаратора (главным образом НС1) воз вращаются в смеситель 4 для проведения оксихлорирования. Кубовый продукт колонны 20(главным образом винилхлорид и 1,2-дихлорэтан) направляется в ректификационную колонну 21через дроссельный вентиль 6. В этой колонне в качестве дистиллята выделяется мономерный винилхлорид (99,9 %-ной чистоты). Кубовый продукт, главным образом 1,2-дихлорэтан, возвращается в колонну 16.
2.3. Принципы в технологии получения винилхлорида
сбалансированным по хлору методом
Технология получения винилхлорида сбалансированным по хлору методом (комбинация хлорирования и оксихлорирования этилена с термическим дегидрохлорированием 1,2-дихлорэтана) выступает одним из наиболее интересных примеров реализации принципов создания технологий 00 и НХС. Технология является непрерывной. По химической составляющей ее, несмотря на наличие трех отдельных реакторных подсистем, можно отнести к двух- стадийной. Это вызвано тем, что каждая из цепей химических превращений, ведущих к винилхлориду, состоит из двух стадий: оксихлорирование + термический пиролиз и хлорирование + термический пиролиз.
Эти два параллельных процесса связаны, во-первых, рециркуляционнымпотоком по хлороводороду, что позволяет почти полностью его утилизировать, а во-вторых, общей стадией термического пиролиза, использующей как дихлорэтан оксихлорирования, так и дихлорэтан хлорирования этилена. Суммарные потери хлора составляют всего 11—12 кг, а этилена 23—36 кг на тонну товарного винилхлорида. Большая доля потерь этилена связана с процессом его полного окисления на стадии оксихлорирования (около 19 кг на тонну винилхлорида), а хлора на стадии очистки сточных вод и оксихлорирования (4—6 и 3,4—3,7 кг на тонну винилхлорида соответственно). Таким образом, комбинирование двух процессов в одной технологии позволяет с использованием рециркуляции по образующемуся хлороводороду свести потери сырья к минимуму и одновременно обеспечить эффективную защиту окружающей среды от хлора и хлороводорода. В данном случае реализуется принцип организации рециркуляционных потоков по компонентам. Другой иллюстрацией данного принципа служит рецикл по 1,2-дихлорэтану, охватывающий аппараты 16-21 технологической схемы. Этот поток обеспечивает полную конверсию 1,2-дихлорэтана на стадии термического пиролиза и используется из-за того, что конверсия за один проход на этой стадии не превышает 48—50 %.
Технология базируется на использовании дешевого и доступного этилена и хлора. Обладает высокой эффективностью в целом, хотя отдельные ее составляющие различаются по этому показателю. Например, хлорирование этилена обладает более высокой селективностью по сравнению с оксихлорированием и тем более с термическим пиролизом. Стадии оксихлорирования и хлорирования имеют высокие конверсии за один проход. Рециркуляция части реакционных газов на стадии оксихлорирования связана в основном с необходимостью обеспечения газодинамического и концентрационного режимов аппарата с кипящим слоем. Более того, в настоящее время доказано, что введение в исходные реагенты продуктов полного окисления дает возможность повысить селективность оксихлорирования.
Эффективное использование тепла (принципы разработки процессов с низким энергопотреблением полноты использования энергии системы) в данной технологии достигается не только за счет ее утилизации в подсистеме ректификационного разделения, но и за счет обеспечения теплообмена между экзотермичными (хлорирование, оксих- — лорирование) и эндотермичными (пиролиз) стадиями процесса.
Принцип полноты выделения продуктов из реакционной смеси используется достаточно полно, поскольку как целевой продукт, так и 1,2-дихлорэтан, направляемый на пиролиз, должны иметь высокую чистоту.
В рассматриваемой технологии используется принцип минимального расходования воды, так как в ней практически отсутствуют промывные скрубберы, а хлороводород выделяют в ректификационной колонне при повышенном давлении. Использование для хлорирования этилена совмещенного процессапозволяет по сравнению с традиционными реакторами наиболее интенсивно применять низкопотенциальное тепло хлорирования для предварительного фракционирования продуктов реакции (снижение энергозатрат на выделение 1,2-дихлорэтана на 50-70 %). Кроме того, снижается почти в три раза выход высококипящих полихлоридов.
Важной составляющей технологии является реализация принципа полноты использования газовых потоков и очистки газовых выбросов.Это связано с высокой токсичностью хлора и его соединений. В первую очередь технология обеспечивает утилизацию хлороводорода за счет реакции оксихлорирования этилена. Реакционные аппараты снабжены не только водяными, но и рассольными конденсаторами, которые дают возможность снизить выбросы хлорорганических продуктов в атмосферу за счет более высокой степени их конденсации при пониженных температурах. Выделение хлороводорода из реакционной массы пиролиза проводится ректификацией, что дает возможность непосредственно организовать его рецикл на стадию оксихлорирования, избежать процессов абсорбции его водой и, соответственно, кислотных и солевых стоков. Наконец, технология позволяет создавать линии большой единичной мощности. Реакционные подсистемы оксихлорирования и пиролиза и используемые в них реакционные аппараты дают возможность их проектирования на любую требуемую производительность. Реализация этого принципа для стадии хлорирования может быть осуществлена за счет применения параллельно работающих жидкофазных хлораторов, так чтобы вся технологическая цепочка представляла собой линию большой единичной мощности.[8]
Теоретический расход основного сырья, кг на 1т готового продукта:
Побочные продукты и методы их утилизации
Кубовые остатки после ректификации 1,2-дихлорэтана и винилхлорида представляют собой в основном смесь полихлоридов этана и этилена и смолистые вещества. На 1т винилхлорида в процессе гидрохлорирования ацетилена получается 20 кг побочных продуктов, в комбинированном процессе из ацетилена и этилена- 80кг, в сбалансированном процессе 50-110кг.
Побочные продукты после осветления можно использовать частично для переработки в три- и перхлорэтилен, частично в четыреххлористый углерод. Вторичные кубовые остатки(10-20 %) сжигаются, при этом получается хлористый водород, который можно использовать для оксихлорирования этилена или гидрохлорирования ацетилена.
Примеси в техническом продукте
Ацетилен, ацетальдегид, 1,1-дихлорэтан,1,2- дихлорэтан, бутадиен-1,3.
Методы анализа технического продукта
В качестве основного метода анализа используется газожидкостная хромотография. Анализ ведется с использованием двух колонок, вторая колонка служит для определения 1,2- дихлорэтана и хлоропрена.
Транспортирование и хранение
Винилхлорид транспортируют и хранят в сжиженном состоянии под давлением собственных паров. Для длительного транспортирования и хранения винилхлорид стабилизируют добавкой фенола или гидрохинона.
Заливают винилхлорид в специально оборудованные стальные железнодорожные цистерны, специальные стальные контейнеры емкостью 400 и 800л и стальные автоцистерны. Железнодорожные цистерны, автоцистерны и контейнеры должны быть рассчитаны на рабочее давление не менее 0,91 МПа.[6]
Винилхлорид хранят в специальных стальных емкостях, а специальные контейнеры с винилхлоридом в крытых складских неотапливаемых помещениях. Условия хранения винилхлорида должны отвечать требованиям по хранению сжиженных горючих газов.
- Хлористый винил (винилхлорид): свойства, формула, промышленное производство в России
- Общее описание
- Химические свойства винилхлорида
- Реакция полимеризации
- Физические характеристики
- Получение
- Производство в России
- Применение
- Другие сферы использования
- Токсичность
- Способ конверсии этилена в винилхлорид и новые каталитические композиции, полезные для указанного способа
- 💥 Видео
Видео:Опыты по химии. Получение этилена и опыты с нимСкачать

Хлористый винил (винилхлорид): свойства, формула, промышленное производство в России
Хлористый винил является одним из простейших производных ацетилена, получаемого присоединением хлороводорода. Основным видом химических реакций, в которых участвует это вещество, служит процесс полимеризации. Конечный продукт – ПВХ – находит широкое применение во всех сферах человеческой деятельности. Процесс изготовления соединения и его производных сопровождается выделением летучих веществ, которые оказывают сильное токсическое действие на организм человека.
Видео:Как написать уравнения реакции полимеризации?Скачать

Общее описание
Хлористый винил (винилхлорид) – одно из самых широко используемых химических соединений, так как оно является сырьем для производства ПВХ. Впервые это вещество было получено Либихом в 1830 г. в Германии из дихлорэтана и спиртового углекислого калия. Через 42 года другой немецкий химик, Ойген Бауманн, обратил внимание на то, что при хранении на свету из хлористого винила начинают осаждаться хлопья. Этого ученого считают первооткрывателем поливинилхлорида.
Первое время данное соединение не вызывало никакого интереса в среде коммерсантов и производителей химической продукции. Его производство в промышленных масштабах началось в 30-е гг. XX в.
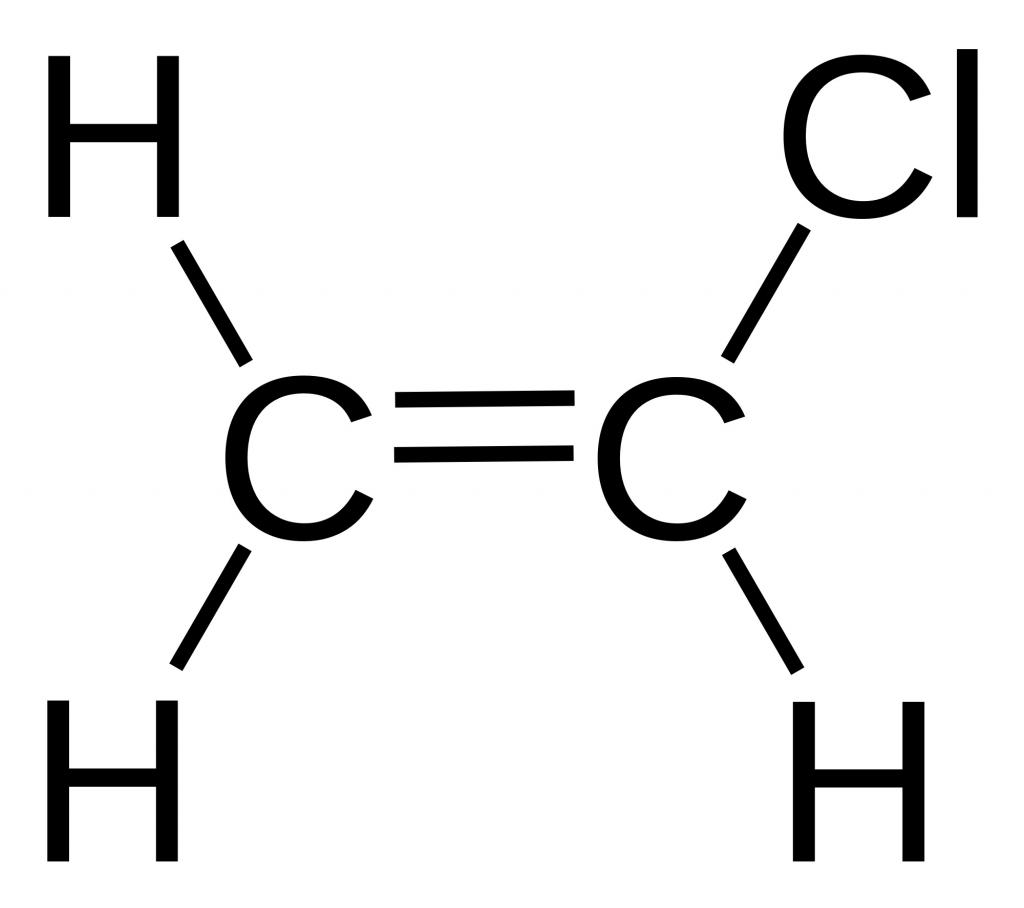
Эмпирическая формула хлористого винила имеет вид: C2H3Cl. Структурная формула представлена на рисунке ниже.
При нормальных условиях винилхлорид является бесцветным газом, но так как температура его кипения составляет -13 °С, то с ним обычно работают в жидком состоянии.
Видео:Полимеры. Ч.3-3. Полимеризация этилена (элементарно о реакции)Скачать

Химические свойства винилхлорида
Основными реакциями, присущими данному веществу, являются:
- Полимеризация.
- Замещение по связи углерод-хлор. Этот процесс позволяет получить алкоголяты и эфиры винила. Атом хлора замещается в присутствии катализаторов: галогенидов, палладия и солей других металлов. Если в качестве растворителей используется спирт, то синтезируются сложные эфиры.
- Окисление кислородом в газовой фазе. Продуктами этой реакции являются формилхлорид, угарный газ, соляная и муравьиная кислота. Полное окисление наблюдается при участии катализатора хромита кобальта или в водном растворе с использованием перманганата калия. Реакция с озоном в жидком и газообразном состоянии винилхлорида приводит к образованию формилхлорида и муравьиной кислоты. При самовозгорании выделяются угарный газ, соляная кислота и токсичный фосген (в небольшом количестве).
- Реакции присоединения. Для получения трихлорэтана, использующегося в качестве растворителя, проводят реакцию присоединения хлора: по ионному механизму (в жидкой фазе, при отсутствии света, с использованием катализатора на основе переходных металлов) или по радикальной реакции (при повышенной температуре). Полезные продукты винилхлорида синтезируют также при кислотном катализе и гидрогенизации.
- Фотодиссоциация. Под действием света с длиной волны 193 нм из молекулы хлористого винила происходит отщепление группы HCl и Cl.
- Пиролиз. Винилхлорид является более устойчивым соединением при термическом разложении, чем другие галогеналканы такого типа. Пиролиз начинается при температуре 550 °С. При 680 °С выход ацетилена, соляной кислоты, хлоропрена и винилацетилена составляет порядка 35%. В присутствии воды хлористый винил разъедает железо, сталь и алюминий из-за выделения HCl.
Видео:78. Что такое реакции полимеризацииСкачать

Реакция полимеризации
Монономер винилхлорида может существовать длительное время при обычных условиях. Появление радикалов в результате фото- или термохимических реакций приводит к активизации полимеризации.
Этот процесс протекает в 3 этапа и представлен на рисунке ниже.
Видео:Реакция полимеризации. 1 часть. 11 класс.Скачать

Физические характеристики
Основными физическими свойствами соединения при нормальных условиях являются следующие:
- молекулярная масса – 62,499;
- температура плавления – 119 К;
- температура кипения – 259 К;
- теплоемкость в жидком состоянии – 84 Дж/(моль∙К);
- давление паров при 0 °С – 175 кПа;
- вязкость при -20 °С – 0,272 мПа∙с;
- нижний предел взрываемости – 8,6 % (по объему);
- температура самовоспламенения – 745 К.
Вещество обладает хорошей растворимостью в углеводородах, нефти, спиртах, органических жидкостях; практически не смешивается с водой.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Получение
Существует несколько промышленных способов, как получить винилхлорид:
- в результате реагирования соляной кислоты с ацетиленом;
- из этилена и хлора (прямое хлорирование этилена, получение этилендихлорида, его пиролиз до винилхлорида);
- оксихлорированием этилена;
- комбинированным способом (прямое хлорирование, пиролиз этилендихлорида, оксихлорирование) – равновесным процессом из этилена и хлора без образования или потребления соляной кислоты.
В настоящее время последний вариант является наиболее распространенным и экономически рентабельным. Количество хлорида винила, полученного по данной технологии, составляет более 95% всего мирового производства. Химизм реакций представлен на рисунке ниже.
Весь объем кислоты, который получают при пиролизе этилендихлорида, применяется в качестве сырья на следующем этапе производства (оксихлорирование). Полученный продукт очищают перегонкой, побочные вещества используют при производстве растворителей или реутилизируют.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Производство в России
В России производство хлорида винила из ацетилена производится на следующих предприятиях:
- АК «Азот», (Новомосковск, Тульская область).
- ОАО «Пласткард» (Волгоград).
- ОАО «Химпром» (Волгоград).
- ОАО «Усольехимпром», (Усолье-Сибирское, Иркутская область).
На основе этилена синтез вещества осуществляется в таких организациях, как:
- ОАО «Саянскхимпласт» (Саянск).
- ОАО «Сибур-Нефтехим» («Капролактам», Дзержинск).
- ЗАО «Каустик» (Стерлитамак).
Синтез из ацетилена считается устаревшей технологией. Использование этилена в качестве исходного материала обладает следующими преимуществами:
- более дешевое и доступное сырье;
- высокая степень выхода готового продукта;
- малое энерго- и водопотребление;
- возможность строительства производственных линий высокой мощности.
Этот способ применяется ведущими мировыми производителями уже в течение 40 лет. Основными перспективными направлениями развития промышленного производства винилхлорида в России являются введение новых мощностей, переход на этановое сырье, распространение технологии оксихлорирования с использованием кислорода и развитие смежных отраслей для сбыта каустической соды, образующейся в качестве побочного продукта.
Видео:8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Применение
Подавляющее количество производимого хлорида винила используется для изготовления поливинилхлорида (ПВХ). По данным статистики более 50% производства этого полимера находится в Азии.
Поливинилхлорид является самым разноплановым материалом из всех полимеров. Из него могут изготавливаться как жесткие строительные конструкции (трубы, внешние стеновые обшивки, профили), так и эластичная продукция (провода, кабеля, кровельные материалы). В отличие от других полимерных материалов, у поливинилхлорида под воздействием ультрафиолетовых лучей, окисления и жидких углеводородов происходит не только распад, но и частичная сшивка полимерных цепей. Это свойство связано с наличием в структуре соединения атомов хлора. Высокая конкурентоспособность поливинилхлорида объясняется также его низкой ценой.
ПВХ применяется для изготовления следующих видов продукции (в порядке убывания по объему производства):
- трубы и их соединительные части;
- сайдинг;
- окна, двери;
- профили (в том числе заборы и настилы);
- напольные покрытия;
- кровельные материалы;
- потребительская продукция;
- упаковка;
- кабели и провода (оболочка, изоляция);
- медицинские принадлежности;
- покрытия, клеи.
Видео:Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Другие сферы использования
Небольшая доля хлорида винила (порядка 1%) используется для производства сополимеров, из которых практическое значение имеют комбинации с винилацетатом, винилиденхлоридом, мономерами акрилового ряда и альфа-олефинами. Первый вид сополимеров получил наибольшее распространение. Эти материалы носят следующие торговые названия:
Они применяются для изготовления такой продукции, как:
- линолеум и другие покрытия для полов;
- оконные рамы;
- облицовочные плитки;
- искусственная кожа;
- пленка;
- лаки;
- нетканые материалы.
Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Токсичность
Хлорид винила относится к высоко опасным соединениям, которые приводят к серьезным ухудшениям в организме человека. Вещество является летучим и основной путь проникновения – ингаляционный. Источником является производство винилхлорида, ПВХ и изделий из него.
Хлорид винила вызывает нарушения в следующих органах и системах:
- угнетение ЦНС (головокружение, потеря ориентации, токсическая кома);
- поражение соединительной ткани и кровеносных сосудов;
- ухудшение репродуктивной функции;
- канцерогенное действие (наиболее часто выявляется ангиосаркома печени, развиваются опухоли и других локализаций);
- система органов пищеварения – гепатит, холецистит, холангит, гастрит, язвенная болезнь;
- система кровообращения и кроветворения – гипертония, ишемическая болезнь сердца, эозинофилия, тромбоцитопения;
- нарушение холестеринового и общего обмена веществ;
- мутагенный эффект, формирование хромосомных аберраций;
- угнетение антимикробной защиты, снижение иммунных сил.
При длительном воздействии (от полугода до 3 лет) токсических доз этого вещества возникает «винилхлоридная болезнь». Ее развитие проходит через 3 стадии, для которых характерны следующие признаки:
- Слабость, мигрень, тошнота, анемия, болезненность ногтевых фаланг конечностей, а также разрушение их костей. При прекращении вредного влияния изменения являются обратимыми.
- Воспаление периферических нервов, выражающееся в потере чувствительности; аритмия, боль в области сердца, нарушение терморегуляции.
- Ухудшение памяти, галлюцинации, непроизвольные колебания глаз, раздвоение изображения, нарушение сна, снижение работоспособности, боль в области желудка, тошнота, рвота, нарастание костных патологий.
Видео:Практическая работа "Получение этилена и опыты с ним" 10 классСкачать

Способ конверсии этилена в винилхлорид и новые каталитические композиции, полезные для указанного способа
Владельцы патента RU 2265006:
Изобретение относится к получению мономера винилхлорида и катализатору для каталитического получения мономера винилхлорида из потоков, содержащих этилен. Способ получения винилхлорида из этилена осуществляют путем оксидегидрохлорирования. Объединяют реагенты, включая этилен, источник кислорода и хлора, в реакторе, содержащем катализатор, при температуре 350-500°С и давлении от атмосферного до 3,5 МПа, т.е. в условиях, достаточных для получения потока продукта, включающего винилхлорид и этилен. Причем катализатор включает один или несколько редкоземельных материалов, при условии, что атомное соотношение между редкоземельным металлом и окислительно-восстановительным металлом (железо и медь) в катализаторе составляет более 10, и при следующем условии, что когда присутствует церий, катализатор дополнительно включает, по меньшей мере, еще один редкоземельный элемент, отличный от церия. Рециркулируют этилен из потока продукта обратно, для использования на стадии объединения реагентов. Предложен вариант способа получения винилхлорида. Также предложены варианты способа каталитического дегидрохлорирования сырья, содержащего один или несколько компонентов, выбранных из этилхлорида, 1,2-дихлорэтана и 1,1,2-трихлорэтана в присутствии каталитизатора. Катализатор представляет собой композицию формулы MOCl или MCl3, где М представляет редкоземельный элемент или смесь редкоземельных элементов, выбранных из лантана, церия, неодима, празеодима, диспрозия, самария, иттрия, гадолиния, эрбия, иттербия, гольмия, тербия, европия, тулия и лютеция. Каталитическая композиция имеет площадь поверхности BET от 12 м 2 /г до 200 м 2 /г. Технический результат — упрощение технологии способа, повышение селективности. 6 н. и 55 з.п. ф-лы, 8 табл.
Мономер винилхлорида (МВХ) все более используют в качестве мономера при получении больших объемов поливинилхлоридных (ПВХ) смол, пластических материалов разностороннего использования. Предлагаемое здесь изобретение относится к способу и катализатору для каталитического получения МВХ из потоков, содержащих этилен. В способе используют новый катализатор, позволяющий осуществить прямое получение МВХ в одной реакционной системе. В качестве дополнительного преимущества в качестве сырья в данную реакционную систему можно также вводить этан.
В настоящее время МВХ чаще всего получают из этилена и хлора сначала хлорированием этилена с получением 1,2-дихлорэтана. 1,2-Дихлорэтан затем термически дегидрохлорируют, получая при этом МВХ и хлорид водорода (HCl) в качестве побочного продукта. HCl, образованный в реакторе дегидрохлорирования, обычно улавливают и подают в реактор оксихлорирования. Процесс оксихлорирования каталитически превращает этилен, HCl и кислород в 1,2-дихлорэтан, который также дегидрохлорируют с получением МВХ. Следовательно, вышеуказанный способ обычно включает три отдельные секции реактора — секцию прямого хлорирования, секцию оксихлорирования и секцию дегидрохлорирования. В установки, функционирующие таким образом, вводят этилен, хлор и кислород и выводят образованные по существу МВХ и воду. Сложность трех секций реактора привела к поиску способов получения МВХ непосредственно из углеводородного сырья в одной секции реактора.
Кроме того, получение этилена требует больших капиталовложений и себестоимость этилена обычно является значительным фактором в общей стоимости получения МВХ в соответствии с вышеописанным способом. Именно вследствие последнего описанного недостатка общепринятой сбалансированной технологии уже давно предпринимались попытки сделать прибыльным способ получения МВХ из этана в качестве исходного материала.
Следующий недостаток известных прямых получений МВХ способами как на основе этана, так и этилена, относится к меньшей, чем требуемая, селективности образования МВХ (часто меньше 30 процентов). Указанную меньшую, чем требуемую, селективность в отношении МВХ в значительной степени можно приписать образованию побочных продуктов в процессе реакции оксихлорирования. Большинство побочных продуктов либо образованы из продуктов сгорания, которые генерируются в результате окисления углеводородов, таких как этан, с образованием в основном СО и CO2 (комбинация которых будет называться COх), либо побочные продукты являются различными хлорированными производными углеводородов (обычно, этилхлорид, 1,1-дихлорэтан, 1,2-дихлорэтан, 1,1,2-трихлорэтан, 1,1-дихлорэтилен, цис-1,2-дихлорэтилен, транс-1,2-дихлорэтилен, трихлорэтилен и перхлорэтилен). Образование три-, тетра-, пента- и гексахлорированных соединений особенно нежелательно вследствие их токсичности и физических свойств. Ранее было предложено обрабатывать эти побочные продукты главным образом при помощи либо вентилирования и удаления, либо селективным разделением и рециклизацией некоторых из хлорированных побочных продуктов обратно в реактор оксихлорирования. Обычно для рециклизации требуются многочисленные стадии очистки и превращения перед утилизацией рециклизованных продуктов в реактор оксихлорирования. Например, ненасыщенные хлорированные углеводороды обычно превращают в насыщенные формы на стадии гидрирования.
Настоящее изобретение лишено недостатков, существующих в известных способах получения МВХ, как описано выше. В первом аспекте по настоящему изобретению предложен способ получения МВХ, упрощенный по сравнению со «сбалансированным способом МВХ», в котором МВХ можно получить из этилена, из этана и этилена или по существу из этана с рециркуляцией этилена из потока продукта. Способ получения винилхлорида в соответствии с указанным первым аспектом включает основные стадии: (а) смешивание реагентов, включающих этилен, источник кислорода и источник хлора, в реакторе, содержащем катализатор, в условиях, достаточных для образования потока продукта, включающего винилхлорид, этилен и хлорид водорода; и (b) рециклизацию этилена в поток продукта обратно для использования на стадии (а). Этилен, нужный для стадии (а), можно дополнить этаном в качестве дополнительного углеводородного исходного материала, и он может состоять только из этилена, рециклизованного из потока продукта, так что этан в действительности является единственным используемым на протяжении процесса необходимым C2-углеводородным сырьем. Катализатор, используемый для данного способа в предпочтительных осуществлениях, может характеризоваться как пористый материал, содержащий редкоземельный элемент («редкоземельный материал»), при условии для данного конкретного осуществления, что катализатор по существу не содержит железо и медь, при следующем условии, что когда присутствует церий, катализатор дополнительно включает, по меньшей мере, один редкоземельный металл помимо церия.
Во втором родственном аспекте по настоящему изобретению предложена композиция, которая может быть использована в качестве катализатора в вышеуказанном способе. Композиция имеет формулу MOCl, где М представляет, по меньшей мере, один редкоземельный элемент, выбранный из лантана, церия, неодима, празеодима, диспрозия, самария, иттрия, гадолиния, эрбия, иттербия, гольмия, тербия, европия, тулия, лютеция или их смесей, при условии, что когда присутствует церий, присутствует также, по меньшей мере, еще один редкоземельный элемент, помимо церия. Способ получения данной композиции включает следующие стадии: (а) получение раствора хлоридной соли редкоземельного элемента или элементов в растворителе, представляющем собой либо воду, спирт, либо их смеси; (b) добавление азотсодержащего основания, чтобы вызвать образование осадка, и (с) сбор, сушку и прокаливание осадка для получения композиции MOCl.
В третьем родственном аспекте по настоящему изобретению предложена дополнительная композиция, которую можно использовать в качестве катализатора в вышеуказанном способе. Композиция имеет формулу MCl3, где М представляет, по меньшей мере, один редкоземельный элемент из лантана, церия, неодима, празеодима, диспрозия, самария, иттрия, гадолиния, эрбия, иттербия, гольмия, тербия, европия, тулия, лютеция или их смесей, при условии, что когда присутствует церий, присутствует также, по меньшей мере, еще один редкоземельный элемент, помимо церия. Способ получения данной композиции включает следующие стадии: (а) получение раствора хлоридной соли редкоземельного элемента или элементов в растворителе, представляющем собой либо воду, спирт, либо их смеси; (b) добавление азотсодержащего основания, чтобы вызвать образование осадка, (с) сбор, сушку и прокаливание осадка и (d) контактирование прокаленного осадка с источником хлора.
Как указано, ключевой отличительный признак способа по настоящему изобретению заключается в рециклизации этилена из потока продукта обратно в реактор для осуществления первой стадии. После сушки в соответствии со способами, известными в данной области, хлорид водорода, образованный в потоке продукта, предпочтительно, также рециклизуют обратно для использования в первой стадии. Монооксид углерода, присутствующий в потоке продукта, можно также рециклизовывать обратно в первую стадию способа.
В отличие от известных способов высокую селективность образования МВХ можно достичь способом по настоящему изобретению из сырья, содержащего этилен, посредством использования катализаторов описанного здесь характера. Обычно селективность образования МВХ по данному способу выше 50 процентов в пересчете на конвертированный С2. С2 относится к этиленовому сырью, подаваемому в систему реакторов в качестве единственного углеводородного источника или в сочетании с этаном. Селективность образования МВХ, предпочтительно, выше 60 процентов в пересчете на конвертированный С2. Более предпочтительно, селективность образования МВХ выше 65 процентов в пересчете на конвертированный С2, и весьма предпочтительно, селективность образования МВХ выше 70 процентов в пересчете на конвертированный C2. Одна причина более высоких селективностей образования МВХ обусловлена тем фактом, что при типичных температурах процесса по данному способу (которые обычно ниже, чем описанные в сравнительных известных способах для получения МВХ) катализаторы, описанные здесь, способны значительно снизить уровни нежелательных более высоко хлорированных соединений, таких как три-, тетра-, пента- и гексахлорированные соединения.
Дополнительное преимущество данного способа состоит в том, что можно использовать этан с этиленом в качестве углеводородного источника. В реакторе, предпочтительно, значительное количество этана подвергается окислительному дегидрированию в этилен. Катализатор и способ по настоящему изобретению позволяют рециклизовывать часть или все количество этилена из потока продукта обратно в поток реагентов. Любой непрореагировавший этан, присутствующий в потоке продукта, можно преимущественно также рециклизовывать обратно в первую стадию способа. Другие легкие газы, такие как продукты сгорания, необязательно, могут содержаться в рециклизованном потоке. При использовании совместно подаваемого потока этана способ, предпочтительно, проводят с таким балансом этилена, чтобы общее число молей в минуту (т.е. «поток») этилена в потоке продукта было по существу равно общему числу молей в минуту этилена, входящего в реактор. В действительности, этилен, видимо, непрерывно рециклизуется без истощения, тогда как этан существенно расходуется в реакторе. Предпочтительным способом осуществления изобретения, таким образом, является такой, чтобы поток рецикла представлял бы единственный источник этилена на первой стадии, и этан обеспечивал источник нового С2-углеводорода в процессе.
Предпочтительными источниками хлора и кислорода являются газы. Наиболее предпочтительным источником кислорода является газообразный кислород. Желательные источники хлора представляют собой хлорид водорода, хлор, хлорированные углеводороды, содержащие лабильные хлоры, и их смеси. Предпочтительные источники хлора, которые считаются «хлорированными углеводородами, содержащими лабильные хлоры», включают тетрахлорид углерода, 1,2-дихлорэтан, этилхлорид и их смеси. Наиболее предпочтительно, чтобы в потоке реагентов непрерывно присутствовало, по меньшей мере, некоторое количество газообразного хлора (Cl2). Было обнаружено в этом отношении, что когда Cl2 используют в потоке реагентов в качестве источника хлора, для любого данного набора условий количество продуктов сгорания (COх) может быть пониженным по сравнению со случаем, когда Cl2 не используют. В альтернативном случае предполагается, что если другой источник хлора, например хлорид водорода (включая хлорид водорода, выделенный из потока продукта и рециклизованный), используют в качестве единственного источника хлора при нормальных операциях, тогда Cl2 следует подавать на катализатор как в начале, так и приостановкой процесса перед приведением процесса полностью в оперативное состояние реального времени, при дополнительном обнаружении, что после обработки (или предварительной обработки) Cl2 тенденция катализатора образовывать эти продукты сгорания может значительно снижаться по сравнению со случаем, в котором Cl2 не был использован для обработки или кондиционирования катализатора.
В свете изложенного здесь, специалисты в данной области способны изменять условия в реакторе, чтобы условия были достаточными для получения потока продукта, включающего винилхлорид, этилен и хлорид водорода. Условия, которые обычно варьируются специалистами в данной области, включают: молярные отношения реагентов в подаваемом сырье; температуру; давление и время контактирования реагентов с катализатором. Реактор, предпочтительно, выдерживают между температурой выше 350°С, более предпочтительно, выше 375°С и температурой меньше 500°С, более предпочтительно, меньше 450°С. Обычно реактор выдерживают при давлении между давлением окружающей среды и избыточным давлением 3,5 мегапаскалей (МПа) (500 фунтов на квадратный дюйм (фунт/кв. дюйм, избыт.)). Операция под давлением позволяет значительно приспособить ее для проведения операций обработки по ходу потока, поскольку более высокое давление обеспечивает движущую силу для движения материала в установку для разделения или через такую установку. Давление в процессе, предпочтительно, находится между давлением окружающей среды и избыточным давлением 2,1 МПа (300 фунт/кв. дюйм) и, наиболее предпочтительно, между давлением окружающей среды и избыточным давлением 1,1 МПа (150 фунт/кв. дюйм). Процесс можно проводить либо по способу с неподвижным слоем, либо с псевдоожиженным слоем, хотя способ с псевдоожиженным слоем является предпочтительным.
Другой аспект касается катализатора, используемого в способе по данному изобретению. Хотя по вышеуказанному способу главным моментом является катализатор, описанный здесь, катализатор имеет дополнительное применение, например, в качестве предшественника катализатора, в качестве регенерируемого абсорбента, в качестве подложки для катализатора и катализатора для других способов. В качестве иллюстрации, оксихлориды редкоземельных элементов можно использовать в качестве регенерируемых основ путем воздействия на них HCl, в результате чего они преобразуются в соответствующие хлориды редкоземельных металлов, высвобождая воду. Воздействие на хлориды редкоземельных элементов водой приводит к преобразованию их обратно в оксихлориды редкоземельных элементов с выделением HCl. Следует отметить, что частицы и гранулы оксихлоридов редкоземельных элементов не претерпевают больших изменений в форме или размере при хлорировании. Напротив, чистые оксиды редкоземельных элементов могут претерпевать большие изменения при хлорировании, которые вызывают сильные разрушения полученных частиц. Хлориды редкоземельных элементов могут взаимодействовать также с метанолом, образуя при этом метилхлорид. Следовательно, катализатор можно использовать в каталитических процессах для получения метилхлорида, не содержащих HCl.
Катализатор можно также использовать для дегидрирования этана, поскольку контактирование потока этана, кислорода и источника хлора, такого как HCl, с катализатором приводит к получению потока, включающего преимущественно этилен и HCl. Кроме того, контактирование катализатора с потоком, содержащим один или несколько продуктов, выбранных из этилхлорида, 1,2-дихлорэтана и 1,1,2-трихлорэтана, приводит к дегидрохлорированию этих продуктов с получением HCl и соответствующего ненасыщенного углеводорода или хлоруглеводорода. Кроме того, когда соли меди контактируют с катализатором (либо при присутствии их в растворе в процессе осаждения, либо введением содержащих медь растворов в кальцинированный катализатор), обработка катализатора HCl дает катализатор, который можно использовать для оксихлорирования этилена в 1,2-дихлорэтан. Данные катализаторы особенно желательны вследствие их способности действовать при более высоких температурах без повышенного образования СОх.
Как описано выше, катализатор по данному изобретению включает, по меньшей мере, один редкоземельный материал. Редкоземельные элементы являются группой из 17 элементов, включающей скандий (порядковый номер 21), иттрий (порядковый номер 39) и лантаниды (порядковые номера 57-71) [James В. Hedrick, U.S. Geological Survey — Minerals Information -1997, «Rare-Earth Metals»]. Катализатор может быть представлен либо в виде пористого, сыпучего материала, либо он может быть нанесен на подходящий носитель. Предпочтительными редкоземельными материалам являются продукты на основе лантана, церия, неодима, празеодима, диспрозия, самария, иттрия, гадолиния, эрбия, иттербия, гольмия, тербия, европия, тулия и лютеция. Наиболее предпочтительные редкоземельные вещества для использования в вышеуказанном способе получения МВХ основаны на тех редкоземельных элементах, которые обычно рассматриваются в качестве одновалентных веществ. Оказывается, что каталитическая эффективность веществ с несколькими валентностями является менее желательной, чем веществ, которые имеют одну валентность. Например, известно, что церий является катализатором окисления-восстановления, обладающим способностью достигать стабильных состояний окисления как 3 + , так и 4 + . Это является одной причиной того, почему, если редкоземельный материал основан на церии, катализатор по настоящему изобретению дополнительно включает, по меньшей мере, еще один редкоземельный элемент помимо церия. Если один из редкоземельных элементов, используемых в катализаторе, представляет собой церий, предпочтительно, церий представлен в молярном отношении, которое меньше, чем общее количество других редкоземельных элементов, присутствующих в катализаторе. Более предпочтительно, однако, когда церий по существу не присутствует в катализаторе. Выражение «по существу не содержит церий» означает, что любой церий присутствует в количестве, меньшем, чем 33 атомных процента редкоземельных компонентов, предпочтительно, меньше, чем 20 атомных процентов и, наиболее предпочтительно, меньше, чем 10 атомных процентов.
Редкоземельный материал для катализатора данного изобретения, более предпочтительно, основан на лантане, неодиме, празеодиме или их смеси. Наиболее предпочтительно, когда, по меньшей мере, один из редкоземельных металлов, используемых в катализаторе, является лантаном. Кроме того, для содержащего этилен сырья для способа получения МВХ по настоящему изобретению катализатор по существу не содержит железо и медь. Обычно, присутствие материалов, которые способы к окислению-восстановлению (редокс-система), является нежелательным для катализатора. Для катализатора предпочтительно также, чтобы он по существу не содержал другие переходные металлы, которые имеют более одной стабильной степени окисления. Например, марганец является другим переходным металлом, присутствие которого, предпочтительно, исключается из состава катализатора. Выражение «по существу не содержит» означает, что атомное отношение редкоземельного элемента к редокс-металлу в катализаторе составляет больше, чем 1, предпочтительно, больше, чем 10, более предпочтительно, больше, чем 15, и наиболее предпочтительно, больше, чем 50.
Как указано выше, катализатор может быть также нанесен на инертный носитель. Предпочтительные инертные носители включают оксид алюминия, силикагель, диоксид кремния-оксид алюминия, диоксид кремния-оксид магния, боксит, оксид магния, карбид кремния, оксид титана, оксид циркония, силикат циркония и их комбинации. Однако, в наиболее предпочтительном осуществлении носитель не является цеолитом. Когда используют инертный носитель, материал редкоземельного компонента катализатора обычно составляет от 3 массовых процентов (масс. процентов) до 85 масс. процентов общей массы катализатора и носителя. Катализатор можно наносить на носитель с использованием способов, уже известных в данной области.
Может быть также полезно включать другие элементы в катализатор в виде как пористого, сыпучего материала, так и на носителе. Например, предпочтительные элементные добавки включают щелочноземельные металлы, бор, фосфор, серу, кремний, германий, титан, цирконий, гафний, алюминий и их комбинации. Указанные элементы могут присутствовать для изменения каталитической эффективности композиции или улучшения механических свойств (например, устойчивости к истиранию) материала.
Перед смешиванием этиленсодержащего сырья, источника кислорода и источника хлора в реакторе для осуществления способа получения МВХ данного изобретения, предпочтительно, чтобы каталитическая композиция включала соль, по меньшей мере, одного редкоземельного металла при условии, что катализатор по существу не содержит железо и медь, и при следующем условии, что когда используют церий, катализатор дополнительно включает, по меньшей мере, еще один редкоземельный элемент помимо церия. Соль, по меньшей мере, одного редкоземельного элемента, предпочтительно, выбрана из оксихлоридов редкоземельных элементов, хлоридов редкоземельных элементов, оксидов редкоземельных элементов и их комбинаций при условии, что катализатор по существу не содержит железо и медь, и при следующем условии, что когда используют церий, катализатор дополнительно включает, по меньшей мере, один редкоземельный элемент помимо церия. Более предпочтительно, соль включает оксихлорид редкоземельного элемента формулы MOCl, где М представляет, по меньшей мере, один редкоземельный элемент, выбранный из лантана, церия, неодима, празеодима, диспрозия, самария, иттрия, гадолиния, эрбия, иттербия, гольмия, тербия, европия, тулия и лютеция или их смесей, при условии, что когда присутствует церий, присутствует также, по меньшей мере, еще один редкоземельный элемент помимо церия. Наиболее предпочтительно, соль представляет собой пористый, сыпучий материал оксихлорида лантана (LaOCl). Как было указано, данный материал благотворно не претерпевает больших изменений (например, разрушения) при хлорировании in suti по данному способу и обеспечивает дополнительное полезное свойство растворимости в воде в контексте данного способа после использования (LaOCl сначала является водонерастворимым), так что, если отработанный катализатор необходимо удалить из реактора с псевдоожиженным слоем, неподвижным слоем или другого оборудования или сосудов способа, это можно сделать без гидропродувания или общепринятых интенсивных по усилию механических способов простым вымыванием отработанного рассматриваемого катализатора из реактора водой.
Обычно, когда соль является оксихлоридом редкоземельного элемента (MOCl), она имеет площадь поверхности BET, по меньшей мере, 12 м 2 /г, предпочтительно, по меньшей мере, 15 м 2 /г, более предпочтительно, по меньшей мере, 20 м 2 /г, и наиболее предпочтительно, по меньшей мере, 30 м 2 /г. Обычно площадь поверхности BET составляет меньше, чем 200 м 2 /г. Для данных вышеуказанных измерений изотерму адсорбции азота измеряют при 77К, и площадь поверхности вычисляют из данных изотермы с использованием способа BET (Brunauer, S., Emett, P.H. and Teller, E., J. Am. Chem. Soc., 60, 309 (1938)). Кроме того, отмечается, что фазы MOCl имеют картины характеристических порошковых дифракций рентгеновских лучей (XRD), которые отличаются от фаз MCl3.
Можно также, как указано в нескольких примерах ранее, применять смеси редкоземельных элементов («М») в композиции MOCl. Например, М может быть смесью, по меньшей мере, двух редкоземельных элементов, выбранных из лантана, церия, неодима, празеодима, диспрозия, самария, иттрия, гадолиния, эрбия, иттербия, гольмия, тербия, европия, тулия и лютеция. Аналогично этому, можно также применять смеси различных композиций MOCl, где М является разным для каждой композиции MOCl в смеси.
После смешивания этиленсодержащего сырья, источника кислорода и источника хлора в реакторе катализатор образуют in situ из соли, по меньшей мере, одного редкоземельного элемента. Хотя данная характеристика не должна ограничивать композицию или способ данного изобретения никоим образом, считается, что in situ образованный катализатор включает хлорид редкоземельного компонента. Примером такого хлорида является MCl3, где М представляет редкоземельный компонент, выбранный из лантана, церия, неодима, празеодима, диспрозия, самария, иттрия, гадолиния, эрбия, иттербия, гольмия, тербия, европия, тулия, лютеция и их смесей, при условии, что когда используют церий, катализатор дополнительно включает, по меньшей мере, один редкоземельный элемент помимо церия. Обычно, когда солью является хлорид редкоземельного элемента (MCl3), он имеет площадь поверхности BET, по меньшей мере, 5 м 2 /г, предпочтительно, по меньшей мере, 10 м 2 /г, более предпочтительно, по меньшей мере, 15 м 2 /г, еще более предпочтительно, по меньшей мере, 20 м 2 /г, и наиболее предпочтительно, по меньшей мере, 30 м 2 /г.
Оксихлорирование обычно обозначают как окислительное присоединение двух атомов хлора к этилену от HCl или другого восстановленного источника хлора. Катализаторы, способные осуществлять данное химическое преобразование, были классифицированы как модифицированные катализаторы Deacon [Olah, G.A., Molnar, A., Hydrocarbon Chemistry, John Wiley and Sons (New York, 1995), pg 226]. Химия Deacon относится к реакции Deacon, окислению HCl с получением элементного хлора и воды.
Без ограничения по настоящему изобретению, как заявлено ниже, в противоположность оксихлорированию, предпочтительный способ и катализатор, описанные выше, считают как использующие оксидегидрохлорирование при преобразовании этансодержащего и этиленсодержащего потоков в МВХ с высокой селективностью. Оксидегидрохлорирование является преобразованием углеводорода (с использованием источника кислорода и хлора) в хлорированный углеводород, где углероды сохраняют либо их начальную валентность, либо имеют их восстановленную валентность (например, sp 3 -углероды сохраняют sp 3 или превращаются в sp 2 , и sp 2 -углероды сохраняются или превращаются в sp). Это отличается от общепринятого определения оксихлорирования, посредством которого этилен преобразуется в 1,2-дихлорэтан с повышением валентности углерода (т.е. sp 2 -углероды превращаются в sp 3 -углероды).
В свете описанного здесь, специалисты в данной области могут, без сомнения, разработать альтернативные способы получения композиций данного изобретения. Однако, в настоящее время считается предпочтительным способ получения композиции, включающей оксихлорид редкоземельного металла (MOCl), который включает следующие стадии: (а) получение раствора хлоридной соли редкоземельного элемента или элементов в растворителе, включающем либо воду, спирт или их смеси, (b) добавление азотсодержащего основания для индуцирования образования осадка и (с) сбор, сушку и прокаливание осадка для образования материала MOCl. Обычно азотсодержащее основание выбрано из гидроксида аммония, алкиламина, ариламина, арилалкиламина, гидроксида алкиламмония, гидроксида ариламмония, гидроксида арилалкиламмония и их смесей. Азотсодержащее основание можно также представить в виде смеси азотсодержащего основания с другими основаниями, которые не содержат азот. Предпочтительно, азотсодержащим основанием является гидроксид тетраалкиламмония. Растворителем стадии (а), предпочтительно, является вода. Сушку каталитически полезной композиции можно осуществить любым способом, включая сушку распылением, сушку в продуваемом сушильном шкафу и другие известные способы. Для предпочтительного в настоящее время способа операции с псевдоожиженным слоем предпочтительным является катализатор, высушенный распылением.
Способ, в настоящее время считающийся предпочтительным для получения композиции катализатора, включающей хлорид редкоземельного металла (MCl3), включает следующие стадии: (а) получение раствора хлоридной соли редкоземельного элемента или элементов в растворителе, включающем либо воду, спирт либо их смеси; (b) добавление азотсодержащего основания для индуцирования образования осадка; (с) сбор, сушку и прокаливание осадка и (d) контактирование прокаленного осадка с источником хлора. Например, одним применением данного способа (с использованием La для иллюстрации) может быть осаждение LaCl3 из раствора азотсодержащим основанием, сушку его, добавление его в реактор, нагревание его до 400°С в реакторе для проведения прокаливания и затем контактирование прокаленного осадка с источником хлора с образованием композиции катализатора in situ в реакторе.
Изобретение будет далее проиллюстрировано следующими примерами, которые предназначены исключительно для иллюстративных целей.
Для демонстрации получения винилхлорида из потока, включающего этилен, получают пористую, огнеупорную композицию, включающую лантан. Раствор LaCl3 в воде получают растворением одной части коммерчески доступного гидратированного хлорида лантана (получен от J.T. Baker Chemical Company) в 8 частях деионизированной воды. Добавление по каплям с перемешиванием гидроксида аммония (получен от Fisher Scientific, certified ACS specification) до нейтрального значения рН (универсальная индикаторная бумага) вызывает образование геля. Смесь центрифугируют и раствор декантируют от твердой части. Добавляют приблизительно 150 мл деионизированной воды и гель энергично перемешивают для диспергирования твердой части. Образовавшийся раствор центрифугируют и раствор декантируют. Данную стадию промывания повторяют еще два раза. Собранный, промытый гель сушат в течение двух часов при 120°С и затем прокаливают при 550°С в течение четырех часов на воздухе. Образовавшееся твердое вещество размалывают и просеивают, получая при этом частицы, подходящие для следующего испытания. Данная процедура дает твердое вещество, соответствующее порошковой дифракционной рентгенограмме LaOCl.
Частицы помещают в чистый никелевый (сплав 200) реактор. Реактор имеет такую конфигурацию, чтобы в реактор можно было подавать этилен, этан, HCl, кислород и инертный газ (смесь Не и Ar). Функцией аргона является внутренний стандарт для анализа сырья и выходящего потока газовой хроматографией. Время контактирования потока с катализатором вычисляют как объем катализатора, поделенный на скорость потока при стандартных условиях. Отношение компонентов сырья приводится в молярных отношениях. В реакционную систему сразу подают этансодержащий поток при стехиометрическом отношении этана, HCl и кислорода. Это обеспечивает сбалансированную стехиометрию для получения МВХ из этилена.
В таблице 1, ниже, приводятся результаты испытания реактора с использованием данной композиции.
Колонка 1 таблицы 1 показывает высокую селективность образования винилхлорида, когда в каталитическую систему вводят этилен в условиях окисления в присутствии HCl. Композиция содержит гелий для имитации реактора, действующего с подачей воздуха в качестве газа-окислителя.
Колонка 2 таблицы 1 показывает высокую селективность образования винилхлорида, когда в каталитическую систему вводят этилен в условиях окисления в присутствии HCl. Композиция теперь является обогащенной топливом, чтобы избежать ограничений, вызываемых воспламеняемостью, и не содержит гелий.
Колонка 3 таблицы 1 показывает высокую селективность образования винилхлорида и этилена, когда в каталитическую систему вводят этан в условиях окисления в присутствии HCl. Композиция имитирует реактор, действующий с подачей воздуха в качестве газа-окислителя. Этилена в сырье не имеется. Этилен, присутствующий в реакторе, является продуктом частичного окисления этана.
Колонка 4 таблицы 1 показывает результаты, когда подают как этан, так и этилен. Реактор функционирует таким путем, чтобы гарантировать, что количества этилена, входящего в реактор и выходящего из реактора, были равны. При операции данным способом этилен демонстрирует видимость инертного разбавителя, причем превращается только этан. Результаты показывают высокий выход винилхлорида и 1,2-дихлорэтана. Аргон используют в качестве внутреннего стандарта, чтобы гарантировать, что поток этилена, входящий в реактор, и поток этилена, выходящий из реактора, равны. Отношение этилена к аргону интегрированного хроматографического пика идентично для сырья для реактора и потока продукта. Таким путем рецикл этилена воспроизводится в реакторном устройстве.
| Таблица 1 | ||||
| Молярные отношения компонентов сырья | ||||
| С2Н4 | 2 | 3,7 | 0 | 3 |
| C2H6 | 0 | 0 | 1 | 2 |
| HCl | 2 | 2 | 1 | 2,5 |
| O2 | 1 | 1 | 1 | 1 |
| Инертные газы | 6,8 | 0 | 4 | 0 |
| Т (градусы С) | 401 | 400 | 401 | 419 |
| Время контактирования потока с катализатором (с) | 12,3 | 5,0 | 21,8 | 12,4 |
| Превращение О2 (процент) | 47,3 | 53,7 | 54,8 | 93,9 |
| Селективность (проценты) | ||||
| С2Н4 | — | — | 44,7 | — |
| C2H4Cl2 | 10,7 | 14,0 | 0,1 | 12,8 |
| MBX | 76,6 | 78,1 | 34,5 | 68,5 |
Для дальнейшей демонстрации полезности композиции этилен подвергают окислительной конверсии в винилхлорид с использованием различных источников хлора. Раствор LaCl3 в воде получают растворением одной части коммерчески доступного гидратированного хлорида лантана (от фирмы Avocado Research Chemicals Ltd.) в 6,6 частях деионизированной воды. Быстрое добавление при перемешивании 6 М гидроксида аммония в воде (разбавленный, сертифицированный реагент ACS от фирмы Fisher Scientific) вызывает образование геля. Смесь фильтруют для сбора твердого вещества. Собранный гель сушат при 120°С перед прокаливанием при 550°С в течение четырех часов на воздухе. Образовавшееся твердое вещество размалывают и просеивают. Просеянные частицы помещают в чистый никелевый реактор (сплав 200). Реактор имеет такую конфигурацию, чтобы этилен, HCl, кислород, 1,2-дихлорэтан, тетрахлорид углерода и гелий можно было вводить в реактор. Время контактирования потока с катализатором вычисляют как объем катализатора, деленный на скорость потока при стандартной температуре и давлении. Скорости потоков являются молярными отношениями. Композицию нагревают до 400°С и обрабатывают смесью 1:1:3 HCl:O2:Не в течение 2 часов перед началом операции.
Полученную композицию подвергают воздействию для получения винилхлорида подачей этилена, источника хлора и кислорода при 400°С. В следующей таблице показаны данные, полученные между 82 и 163 часами с потоком, в котором используют различные источники хлора. Хлор подают в виде HCl, тетрахлорида углерода и 1,2-дихлорэтана. МВХ означает винилхлорид. Время контактирования потока с катализатором вычисляют как объем катализатора, деленный на скорость потока при стандартной температуре и давлении. Реакторы эксплуатируют с выходным отверстием реактора при давлении окружающей среды. Как этилен, так и 1,2-дихлорэтан, называют С2-соединениями.
| Таблица 2 | ||||
| Молярные отношения компонентов сырья | ||||
| С2Н4 | 2,0 | 2,0 | 2,0 | 2,0 |
| C2H6 | 0,0 | 0,0 | 0,0 | 0,0 |
| CCl4 | 0,5 | 0,5 | 0,0 | 0,0 |
| С2Н4Cl2 | 0,0 | 0,0 | 1,8 | 0,0 |
| HCl | 0,0 | 0,0 | 0,0 | 1,9 |
| O2 | 1,0 | 1,0 | 1,0 | 1,0 |
| Не+Ar | 8,9 | 9,0 | 8,9 | 6,7 |
| Т (°С) | 400 | 399 | 401 | 400 |
| Время контактирования потока с катализатором (с) | 8,0 | 4,0 | 8,6 | 4,9 |
| Фракционные превращения (проценты) | ||||
| С2Н4 | 40,4 | 27,0 | 18,7 | 20,1 |
| С2Н6 | 0,0 | 0,0 | 0,0 | 0,0 |
| CCl4 | 94,8 | 78,4 | 0,0 | 0,0 |
| С2Н4Cl2 | 0,0 | 0,0 | 98,3 | 0,0 |
| HCl | 0,0 | 0,0 | 0,0 | 44,7 |
| O2 | 68,8 | 42,0 | 55,2 | 37,8 |
| Селективности в расчете на моли превращенных С2 | ||||
| МВХ | 59,6 | 56,4 | 86,0 | 78,5 |
| С2Н4Cl2 | 14,8 | 30,7 | 0,0 | 2,2 |
| С2Н5Cl | 0,6 | 0,4 | 0,2 | 1,6 |
Эти данные показывают, что при окислительном получении винилхлорида можно использовать различные источники хлора. При использовании всех из источников, тетрахлорида углерода, 1,2-дихлорэтана и HCl, винилхлорид образуется в качестве доминантного продукта.
Раствор LaCl3 в воде получают растворением одной части коммерчески доступного гидратированного хлорида лантана (от фирмы Avocado Research Chemicals Ltd.) в 6,67 частях деионизированной воды. Быстрое добавление при перемешивании 6М гидроксида аммония в воде (разбавленный, сертифицированный реагент ACS, полученный от фирмы Fisher Scientific) вызывает образование геля и дает конечное значение рН 8,85. Смесь фильтруют для сбора твердого вещества. Собранный материал кальцинируют на воздухе при 550°С в течение четырех часов. Образовавшееся твердое вещество размалывают и просеивают. Просеянные частицы помещают в чистый никелевый реактор (сплав 200). Реактор имеет такую конфигурацию, чтобы этилен, HCl, кислород, и инертный газ (смесь гелия и аргона) можно было вводить в реактор.
В таблице 3 приводятся данные, где сырье реактора регулируют так, чтобы поток этилена (моли/минута), входящий в реактор, и поток этилена, выходящий из реактора, были по существу равными. Сырье реактора аналогично регулируют так, чтобы потоки HCl, входящие и выходящие из реактора, были по существу равны. Превращение кислорода устанавливают немного меньше, чем полное превращение, что позволяет проводить мониторинг активности катализатора. При проведении операции указанным способом расходованными компонентами сырья являются этан, кислород и хлор. Создается впечатление, что как этилен, так и газообразный HCl не образуются и не расходуются. Время контактирования потока с катализатором вычисляют как объем катализатора, деленный на скорость потока при стандартной температуре и давлении. Пример далее иллюстрирует использование газообразного хлора в качестве источника хлора при получении винилхлорида.
| Таблица 3 | |
| Молярные отношения компонентов сырья | |
| С2Н4 | 2,1 |
| С2Н6 | 4,5 |
| Cl2 | 0,5 |
| HCl | 2,4 |
| O2 | 1,0 |
| Не+Ar | 7,4 |
| Т (°С) | 400 |
| Время контактирования потока с катализатором (с) | 9,4 |
| Фракционные превращения (проценты) | |
| С2Н4 | 1,8 |
| С2Н6 | 27,3 |
| Cl2 | 99,8 |
| HCl | -1,4 |
| O2 | 96,4 |
| Селективность (проценты) | |
| МВХ | 79,0 |
| C2H4Cl2 | 7,2 |
| C2H5Cl | 1,7 |
| СОх | 5,1 |
| С2Н4 | 0,5 |
Для всех примеров здесь МВХ означает винилхлорид, C2H4Cl2 является только 1,2-дихлорэтаном. СОх представляет собой комбинацию СО и СО2.
Композицию катализатора, полученную в примере 1, использовали, чтобы показать влияние температуры на каталитическую эффективность. Результаты показаны в таблице 4.
| Таблица 4 | |||
| Влияние температуры на композицию лантана | |||
| Молярные отношения компонентов сырья | |||
| С2Н4 | 1,9 | 1,9 | 1,9 |
| С2Н6 | 0,0 | 0,0 | 0,0 |
| Cl2 | 0,0 | 0,0 | 0,0 |
| HCl | 1,9 | 1,9 | 1,5 |
| O2 | 1,0 | 1,0 | 1,0 |
| Не+Ar | 6,6 | 6,6 | 7,1 |
| Т (°С) | 349 | 399 | 450 |
| Время контактирования потока с катализатором (с) | 4,9 | 9,7 | 9,6 |
| Фракционные превращения (проценты) | |||
| С2Н4 | 8,2 | 33,0 | 35,2 |
| С2Н6 | 0,0 | 0,0 | 0,0 |
| Cl2 | |||
| HCl | 7,5 | 36,0 | 46,5 |
| O2 | 8,8 | 49,2 | 57,1 |
| Селективности (проценты) | |||
| МВХ | 67,7 | 87,4 | 79,8 |
| C2H4Cl2 | 2,5 | 0,2 | 0,8 |
| C2H5Cl | 28,1 | 1,3 | 0,4 |
| СОх | 1,6 | 0,9 | 8,9 |
Приведенные данные показывают, что способность композиции образовывать винилхлорид немного изменяется при изменении температуры. Более низкие температуры снижают скорости, но селективность изменяется только незначительно.
Примеры от 5 до 12
Примеры от 5 до 12 иллюстрируют получение многочисленных композиций редкоземельных элементов, причем каждая содержит только один редкоземельный материал. Данные, иллюстрирующие эффективность указанных композиций, приводятся в таблице 5.
Раствор LaCl3 в воде получают растворением одной части коммерчески доступного гидратированного хлорида лантана (от фирмы Aldrich Chemical Company) в 6,67 частях деионизированной воды. Быстрое добавление при перемешивании 6М гидроксида аммония в воде (разбавленный, сертифицированный реагент ACS, полученный от фирмы Fisher Scientific) вызывает образование геля. Смесь центрифугируют для сбора твердого вещества. Раствор декантируют от геля и выгружают. Гель снова суспендируют в 6,66 частях деионизированной воды. Центрифугирование позволяет собрать гель. Собранный гель сушат при 120°С перед прокаливанием при 550°С в течение четырех часов на воздухе. Образовавшееся твердое вещество размалывают и просеивают. Просеянные частицы помещают в чистый никелевый реактор (сплав 200). Реактор имеет такую конфигурацию, чтобы этилен, этан, HCl, кислород и инертный газ (смесь гелия и аргона) можно было вводить в реактор. Порошковая дифракция рентгеновских лучей показывает, что материал является LaOCl. Измеренная площадь поверхности BET составляет 42,06 м 2 /г. Конкретные данные эффективности для данного примера приводятся ниже, в таблице 5.
Раствор NdCl3 в воде получают растворением одной части коммерчески доступного гидратированного хлорида неодима (Alfa Aesar) в 6,67 частях деионизированной воды. Быстрое добавление при перемешивании 6 М гидроксида аммония в воде (разбавленный, сертифицированный реагент ACS, полученный от фирмы Fisher Scientific) вызывает образование геля. Смесь фильтруют для сбора твердого вещества. Собранный гель сушат при 120°С перед прокаливанием на воздухе при 550°С в течение четырех часов. Образовавшееся твердое вещество размалывают и просеивают. Просеянные частицы помещают в чистый никелевый реактор (сплав 200). Реактор имеет такую конфигурацию, чтобы этилен, этан, HCl, кислород и инертный газ (смесь гелия и аргона) можно было вводить в реактор. Порошковая дифракция рентгеновских лучей показывает, что материал является NdOCl. Измеренная площадь поверхности BET составляет 22,71 м 2 /г. Конкретные данные эффективности для данного примера приводятся ниже, в таблице 5.
Раствор PrCl3 в воде получают растворением одной части коммерчески доступного гидратированного хлорида празеодима (Alfa Aesar) в 6,67 частях деионизированной воды. Быстрое добавление при перемешивании 6 М гидроксида аммония в воде (разбавленный, сертифицированный реагент ACS, полученный от фирмы Fisher Scientific) вызывает образование геля. Смесь фильтруют для сбора твердого вещества. Собранный гель сушат при 120°С перед прокаливанием на воздухе при 550°С в течение четырех часов. Образовавшееся твердое вещество размалывают и просеивают. Просеянные частицы помещают в чистый никелевый реактор (сплав 200). Реактор имеет такую конфигурацию, чтобы этилен, этан, HCl, кислород и инертный газ (смесь гелия и аргона) можно было вводить в реактор. Порошковая дифракция рентгеновских лучей показывает, что материал является PrOCl. Измеренная площадь поверхности BET составляет 21,37 м 2 /г. Конкретные данные эффективности для данного примера приводятся ниже, в таблице 5.
Раствор SmCl3 в воде получают растворением одной части коммерчески доступного гидратированного хлорида самария (Alfa Aesar) в 6,67 частях деионизированной воды. Быстрое добавление при перемешивании 6 М гидроксида аммония в воде (разбавленный, сертифицированный реагент ACS, полученный от фирмы Fisher Scientific) вызывает образование геля. Смесь фильтруют для сбора твердого вещества. Собранный гель сушат при 120°С перед прокаливанием при 550°С в течение четырех часов. Образовавшееся твердое вещество размалывают и просеивают. Просеянные частицы помещают в чистый никелевый реактор (сплав 200). Реактор имеет такую конфигурацию, чтобы этилен, этан, HCl, кислород и инертный газ (смесь гелия и аргона) можно было вводить в реактор. Порошковая дифракция рентгеновских лучей показывает, что материал является SmOCl.
Измеренная площадь поверхности BET составляет 30,09 м 2 /г. Конкретные данные эффективности для данного примера приводятся ниже, в таблице 5.
Раствор HoCl3 в воде получают растворением одной части коммерчески доступного гидратированного хлорида гольмия (Alfa Aesar) в 6,67 частях деионизированной воды. Быстрое добавление при перемешивании 6 М гидроксида аммония в воде (разбавленный, сертифицированный реагент ACS, полученный от фирмы Fisher Scientific) вызывает образование геля. Смесь фильтруют для сбора твердого вещества. Собранный гель сушат при 120°С перед прокаливанием при 500°С в течение четырех часов. Образовавшееся твердое вещество размалывают и просеивают. Просеянные частицы помещают в чистый никелевый реактор (сплав 200). Реактор имеет такую конфигурацию, чтобы этилен, этан, HCl, кислород и инертный газ (смесь гелия и аргона) можно было вводить в реактор. Измеренная площадь поверхности BET составляет 20,92 м 2 /г. Конкретные данные эффективности для данного примера приводятся ниже, в таблице 5.
Раствор ErCl3 в воде получают растворением одной части коммерчески доступного гидратированного хлорида эрбия (Alfa Aesar) в 6,67 частях деионизированной воды. Быстрое добавление при перемешивании 6 М гидроксида аммония в воде (разбавленный, сертифицированный реагент ACS, полученный от фирмы Fisher Scientific) вызывает образование геля. Смесь фильтруют для сбора твердого вещества. Собранный гель сушат при 120°С перед прокаливанием при 500°С в течение четырех часов. Образовавшееся твердое вещество размалывают и просеивают. Просеянные частицы помещают в чистый никелевый реактор (сплав 200). Реактор имеет такую конфигурацию, чтобы этилен, этан, HCl, кислород и инертный газ (смесь гелия и аргона) можно было вводить в реактор. Измеренная площадь поверхности ВЕТ составляет 19,80 м 2 /г. Конкретные данные эффективности для данного примера приводятся ниже, в таблице 5.
Раствор YbCl3 в воде получают растворением одной части коммерчески доступного гидратированного хлорида иттербия (Alfa Aesar) в 6,67 частях деионизированной воды. Быстрое добавление при перемешивании 6 М гидроксида аммония в воде (разбавленный, сертифицированный реагент ACS, полученный от фирмы Fisher Scientific) вызывает образование геля. Смесь фильтруют для сбора твердого вещества. Собранный гель сушат при 120°С перед прокаливанием при 500°С в течение четырех часов. Образовавшееся твердое вещество размалывают и просеивают. Просеянные частицы помещают в чистый никелевый реактор (сплав 200). Реактор имеет такую конфигурацию, чтобы этилен, этан, HCl, кислород и инертный газ (смесь гелия и аргона) можно было вводить в реактор. Измеренная площадь поверхности ВЕТ составляет 2,23 м 2 /г. Конкретные данные эффективности для данного примера приводятся ниже, в таблице 5.
Раствор YCl3 в воде получают растворением одной части коммерчески доступного гидратированного хлорида иттрия (Alfa Aesar) в 6,67 частях деионизированной воды. Быстрое добавление при перемешивании 6 М гидроксида аммония в воде (разбавленный, сертифицированный реагент ACS, полученный от фирмы Fisher Scientific) вызывает образование геля. Смесь фильтруют для сбора твердого вещества. Собранный гель сушат при 120°С перед прокаливанием при 550°С в течение четырех часов. Образовавшееся твердое вещество размалывают и просеивают. Просеянные частицы помещают в чистый никелевый реактор (сплав 200). Реактор имеет такую конфигурацию, чтобы этилен, этан, HCl, кислород и инертный газ (смесь гелия и аргона) можно было вводить в реактор. Измеренная площадь поверхности BET составляет 29,72 м 2 /г. Конкретные данные эффективности для данного примера приводятся ниже, в таблице 5.
| Таблица 5 | ||||||||
| Композиции оксихлоридов редкоземельных элементов, используемые для получения винилхлорида | ||||||||
| Пример | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| Молярные отношения компонентов сырья | ||||||||
| С2Н4 | 3,6 | 4,2 | 3,7 | 3,6 | 3,6 | 3,6 | 4,2 | 3,6 |
| HCl | 2,0 | 2,3 | 2,0 | 2,0 | 2,0 | 2,0 | 2,3 | 2,0 |
| O2 | 1,0 | 1,0 | 1,0 | 1,0 | 1,0 | 1,0 | 1,0 | 1,0 |
| Не+Ar | 0,2 | 0,2 | 0,2 | 0,2 | 0,2 | 0,2 | 0,2 | 0,2 |
| Т (°С) | 399 | 403 | 401 | 400 | 400 | 400 | 400 | 399 |
| Время контактирования потока с катализатором (с) | 8,7 | 21,3 | 11,4 | 17,6 | 17,7 | 22,8 | 23,1 | 21,3 |
| Фракционные превращения (проценты) | ||||||||
| C2H4 | 23,7 | 13,2 | 22,8 | 14,7 | 12,7 | 15,4 | 3,3 | 13,8 |
| HCl | 47,6 | 24,9 | 40,9 | 20,8 | 15,9 | 22,4 | 5,0 | 19,8 |
| O2 | 58,8 | 59,4 | 55,0 | 53,4 | 48,1 | 48,8 | 21,2 | 47,8 |
| Селективности (проценты) | ||||||||
| МВХ | 75,3 | 74,4 | 74,2 | 61,0 | 33,3 | 44,0 | 6,1 | 35,0 |
| C2H4Cl2 | 11,3 | 2,9 | 6,1 | 2,9 | 14,5 | 17,5 | 8,8 | 18,8 |
| С2Н5Cl | 3,5 | 6,9 | 4,4 | 10,6 | 16,8 | 12,8 | 37,0 | 16,5 |
| СОх | 4,8 | 11,8 | 9,7 | 22,4 | 33,8 | 23,1 | 26,4 | 27,5 |
Приведенные данные показывают полезность сыпучих, содержащих редкоземельные элементы композиций для превращения этиленсодержащих потоков в винилхлорид.
Примеры от 13 до 17
Примеры от 13 до 17 иллюстрируют получение многочисленных композиций редкоземельных металлов, причем каждая содержит смесь редкоземельных материалов. Данные, иллюстрирующие эффективность этих данных, приводятся в таблице 6.
Раствор LaCl3 и NdCl3 в воде получают растворением одной части коммерчески доступного гидратированного хлорида лантана (от фирмы Spectrum Quality Products) и 0,67 частей коммерчески доступного гидратированного хлорида неодима (Alfa Aesar) в 13,33 частях деионизированной воды. Быстрое добавление при перемешивании 6 М гидроксида аммония в воде (разбавленный, сертифицированный реагент ACS, полученный от фирмы Fisher Scientific) вызывает образование геля. Измеренное конечное значение рН составляет 8,96. Смесь центрифугируют для сбора твердого вещества. Раствор декантируют от геля и выгружают. Собранный гель сушат при 80°С перед прокаливанием при 550°С в течение четырех часов. Образовавшееся твердое вещество размалывают и просеивают. Просеянные частицы помещают в чистый никелевый реактор (сплав 200). Реактор имеет такую конфигурацию, чтобы этилен, этан, HCl, кислород и инертный газ (смесь гелия и аргона) можно было вводить в реактор. Измеренная площадь поверхности ВЕТ составляет 21,40 м 2 /г. Конкретные данные эффективности для данного примера приводятся ниже, в таблице 6.
Раствор LaCl3 и SmCl3 в воде получают растворением одной части коммерчески доступного гидратированного хлорида лантана (от фирмы Spectrum Quality Products) и 0,67 частей коммерчески доступного гидратированного хлорида самария (Alfa Aesar) в 13,33 частях деионизированной воды. Быстрое добавление при перемешивании 6 М гидроксида аммония в воде (разбавленный, сертифицированный реагент ACS, полученный от фирмы Fisher Scientific) вызывает образование геля. Измеренное конечное значение рН составляет 8,96. Смесь центрифугируют для сбора твердого вещества. Раствор декантируют от геля и выгружают. Собранный гель сушат при 80°С перед прокаливанием при 550°С в течение четырех часов. Образовавшееся твердое вещество размалывают и просеивают. Просеянные частицы помещают в чистый никелевый реактор (сплав 200). Реактор имеет такую конфигурацию, чтобы этилен, этан, HCl, кислород и инертный газ (смесь гелия и аргона) можно было вводить в реактор. Измеренная площадь поверхности BET составляет 21,01 м 2 /г. Конкретные данные эффективности для данного примера приводятся ниже, в таблице 6.
Раствор LaCl3 и YCl3 в воде получают растворением одной части коммерчески доступного гидратированного хлорида лантана (от фирмы Spectrum Quality Products) и 0,52 части коммерчески доступного гидратированного хлорида иттрия (Alfa Aesar) в 13,33 частях деионизированной воды. Быстрое добавление при перемешивании 6 М гидроксида аммония в воде (разбавленный, сертифицированный реагент ACS, полученный от фирмы Fisher Scientific) вызывает образование геля. Измеренное конечное значение рН составляет 8,96. Смесь центрифугируют для сбора твердого вещества. Раствор декантируют от геля и выгружают. Собранный гель сушат при 80°С перед прокаливанием при 550°С в течение четырех часов. Образовавшееся твердое вещество размалывают и просеивают. Просеянные частицы помещают в чистый никелевый реактор (сплав 200). Реактор имеет такую конфигурацию, чтобы этилен, этан, HCl, кислород и инертный газ (смесь гелия и аргона) можно было вводить в реактор. Измеренная площадь поверхности BET составляет 20,98 м 2 /г. Конкретные данные эффективности для данного примера приводятся ниже, в таблице 6.
Раствор LaCl3 и HoCl3 в воде получают растворением одной части коммерчески доступного гидратированного хлорида лантана (от фирмы Spectrum Quality Products) и одной части коммерчески доступного гидратированного хлорида гольмия (Alfa Aesar) в 13,33 частях деионизированной воды. Быстрое добавление при перемешивании 6 М гидроксида аммония в воде (разбавленный, сертифицированный реагент ACS, полученный от фирмы Fisher Scientific) вызывает образование геля. Измеренное конечное значение рН составляет 8,64. Смесь центрифугируют для сбора твердого вещества. Раствор декантируют от геля и выгружают. Собранный гель сушат при 80°С перед прокаливанием при 550°С в течение четырех часов. Образовавшееся твердое вещество размалывают и просеивают. Просеянные частицы помещают в чистый никелевый реактор (сплав 200). Реактор имеет такую конфигурацию, чтобы этилен, этан, HCl, кислород и инертный газ (смесь гелия и аргона) можно было вводить в реактор. Измеренная площадь поверхности BET составляет 19,68 м 2 /г. Конкретные данные эффективности для данного примера приводятся ниже, в таблице 6.
Раствор LaCl3 и HoCl3 в воде получают растворением одной части коммерчески доступного гидратированного хлорида лантана (от фирмы Spectrum Quality Products) и 0,75 части коммерчески доступного гидратированного хлорида иттербия (Alfa Aesar) в 13,33 частях деионизированной воды. Быстрое добавление при перемешивании 6 М гидроксида аммония в воде (разбавленный, сертифицированный реагент ACS, полученный от фирмы Fisher Scientific) вызывает образование геля. Измеренное конечное значение рН составляет 9,10. Смесь центрифугируют для сбора твердого вещества. Раствор декантируют от геля и выгружают. Собранный гель сушат при 80°С перед прокаливанием при 550°С в течение четырех часов. Образовавшееся твердое вещество размалывают и просеивают. Просеянные частицы помещают в чистый никелевый реактор (сплав 200). Реактор имеет такую конфигурацию, чтобы этилен, этан, HCl, кислород и инертный газ (смесь гелия и аргона) можно было вводить в реактор. Измеренная площадь поверхности BET составляет 20,98 м 2 /г. Конкретные данные эффективности для данного примера приводятся ниже, в таблице 6.
| Таблица 6 | |||||
| Эффективность композиций, содержащих два редкоземельных материала | |||||
| Пример | 13 | 14 | 15 | 16 | 17 |
| Молярное отношение компонентов сырья | |||||
| C2H4 | 3,7 | 3,6 | 3,6 | 3,6 | 3,6 |
| HCl | 2,0 | 2,0 | 2,0 | 2,0 | 2,0 |
| O2 | 1,0 | 1,0 | 1,0 | 1,0 | 1,0 |
| Не+Ar | 0,2 | 0,2 | 0,2 | 0,2 | 0,2 |
| Т (°С) | 401 | 401 | 400 | 399 | 400 |
| Время контактирования потока с катализатором (с) | 3,7 | 15,7 | 13,7 | 16,9 | 20,6 |
| Фракционное превращение (проценты) | |||||
| С2Н4 | 16,8 | 11,3 | 12,5 | 12,4 | 9,2 |
| HCl | 36,0 | 13,1 | 18,1 | 11,9 | 15,9 |
| О2 | 45,9 | 47,2 | 52,2 | 47,1 | 38,7 |
| Селективность (проценты) | |||||
| МВХ | 75,8 | 51,0 | 51,4 | 28,9 | 11,1 |
| C2H4Cl2 | 9,7 | 7,5 | 12,4 | 14,5 | 20,6 |
| С2Н5Cl | 4,1 | 11,8 | 8,9 | 17,0 | 23,8 |
| СОх | 6,9 | 27,5 | 25,8 | 38,9 | 43,8 |
Приведенные данные далее показывают полезность сыпучих композиций редкоземельных элементов, содержащих смеси редкоземельных материалов, для превращения этиленсодержащих потоков в винилхлорид.
Примеры от 18 до 25
Примеры от 18 до 25 являются композициями, содержащими редкоземельные материалы с другими присутствующими добавками.
Раствор LaCl3 в воде получают растворением одной части коммерчески доступного гидратированного хлорида лантана (от фирмы Aldrich Chemical Company) в 6,67 частях деионизированной воды. К 0,35 части коммерчески полученного порошка CeO2 (Rhone-Poulenc) добавляют 0,48 части гидроксида аммония (Fisher Scientific). Содержащие лантан и церий смеси добавляют вместе при перемешивании с образованием геля. Образовавшуюся смесь, содержащую гель, фильтруют и собранное твердое вещество кальцинируют на воздухе при 550°С в течение 4 часов. Образовавшееся твердое вещество размалывают и просеивают. Просеянные частицы помещают в чистый никелевый реактор (сплав 200). Реактор имеет такую конфигурацию, чтобы этилен, этан, HCl, кислород и инертный газ (смесь гелия и аргона) можно было вводить в реактор. Конкретные данные эффективности для данного примера приводятся ниже, в таблице 7.
Лантансодержащую композицию, полученную с использованием способа примера 5, размалывают с использованием ступки и пестика с образованием тонкоизмельченного порошка. Одну часть размолотого порошка смешивают с 0,43 части порошка BaCl2 и далее измельчают с использованием ступки и пестика с образованием тесной смеси. Содержащую лантан и барий смесь прессуют с образованием комков. Комки кальцинируют при 800°С на воздухе в течение 4 часов. Образовавшийся материал помещают в чистый никелевый реактор (сплав 200). Реактор имеет такую конфигурацию, чтобы этилен, этан, HCl, кислород и инертный газ (смесь гелия и аргона) можно было вводить в реактор. Конкретные данные эффективности для данного примера приводятся ниже, в таблице 7.
Высушенный диоксид кремния Grace Davison Grade 57 сушат при 120°С в течение 2 часов. Насыщенный раствор LaCl3 в воде получают с использованием коммерчески доступного гидратированного хлорида лантана. Высушенный диоксид кремния пропитывают до точки начального смачивания раствором LaCl3. Пропитанному диоксиду кремния дают возможность сушиться на воздухе в течение 2 дней при температуре окружающей среды. Его далее сушат при 120°С в течение 1 часа. Образовавшийся материал помещают в чистый никелевый реактор (сплав 200). Реактор имеет такую конфигурацию, чтобы этилен, этан, HCl, кислород и инертный газ (смесь гелия и аргона) можно было вводить в реактор. Конкретные данные эффективности для данного примера приводятся ниже, в таблице 7.
Раствор LaCl3 в воде получают растворением одной части коммерчески доступного гидратированного хлорида лантана (от фирмы Spectrum Quality Products) в 6,67 частях деионизированной воды. Быстрое добавление при перемешивании 6 М гидроксида аммония в воде (разбавленный, сертифицированный реагент ACS, полученный от фирмы Fisher Scientific) вызывает образование геля. Смесь центрифугируют для сбора твердого вещества. Раствор декантируют от геля и выгружают. Гель снова суспендируют в 12,5 частях ацетона (Fisher Scientific), центрифугируют и жидкость декантируют и выгружают. Стадию промывания ацетоном повторяют 4 дополнительных раза с использованием 8,3 части ацетона. Гель снова суспендируют в 12,5 частях ацетона и добавляют 1,15 частей гексаметилдисилазана (от фирмы Aldrich Chemical Company) и раствор перемешивают в течение одного часа. Смесь центрифугируют для сбора геля. Собранному гелю дают возможность сушиться на воздухе при температуре окружающей среды перед прокаливанием на воздухе при 550°С в течение четырех часов. Образовавшееся твердое вещество размалывают и просеивают. Просеянные частицы помещают в чистый никелевый реактор (сплав 200). Реактор имеет такую конфигурацию, чтобы этилен, этан, HCl, кислород и инертный газ (смесь гелия и аргона) можно было вводить в реактор. Измеренная площадь поверхности BET составляет 58,82 м 2 /г. Конкретные данные эффективности для данного примера приводятся ниже, в таблице 7.
Раствор LaCl3 в воде получают растворением одной части коммерчески доступного гидратированного хлорида лантана (Alfa Aesar) и 0,043 частей коммерчески доступного HfCl4 (от фирмы Acros Organics) в 10 частях деионизированной воды. Быстрое добавление при перемешивании 6 М гидроксида аммония в воде (разбавленный, сертифицированный реагент ACS, полученный от фирмы Fisher Scientific) вызывает образование геля. Смесь центрифугируют для сбора твердого вещества. Раствор декантируют от геля и выгружают. Собранный гель сушат при 80°С перед прокаливанием при 550°С в течение 4 часов. Конкретные данные эффективности для данного примера приводятся ниже, в таблице 7.
Раствор LaCl3 в воде получают растворением одной части коммерчески доступного гидратированного хлорида лантана (Alfa Aesar) и 0,086 частей коммерчески доступного HfCl4 (от фирмы Acros Organics) в 10 частях деионизированной воды. Быстрое добавление при перемешивании 6 М гидроксида аммония в воде (разбавленный, сертифицированный реагент ACS, полученный от фирмы Fisher Scientific) вызывает образование геля. Смесь центрифугируют для сбора твердого вещества. Раствор декантируют от геля и выгружают. Собранный гель сушат при 80°С перед прокаливанием при 550°С в течение 4 часов. Конкретные данные эффективности для данного примера приводятся ниже, в таблице 7.
Раствор LaCl3 в воде получают растворением одной части коммерчески доступного гидратированного хлорида лантана (Alfa Aesar) и 0,043 частей коммерчески доступного ZrOCl2 (от фирмы Acros Organics) в 10 частях деионизированной воды. Быстрое добавление при перемешивании 6 М гидроксида аммония в воде (разбавленный, сертифицированный реагент ACS, полученный от фирмы Fisher Scientific) вызывает образование геля. Смесь центрифугируют для сбора твердого вещества. Раствор декантируют от геля и выгружают. Гель снова суспендируют в 6,67 частях деионизированной воды и затем центрифугируют. Раствор декантируют и выгружают. Собранный гель кальцинируют при 550°С в течение 4 часов. Конкретные данные эффективности для данного примера приводятся ниже, в таблице 7.
Раствор LaCl3 в воде получают растворением коммерчески доступного гидратированного хлорида лантана в деионизированной воде с получением 2,16 М раствора. Коммерчески полученный оксид циркония (получен от Enhelhard) сушат при 350°С в течение ночи. Одну часть оксида циркония пропитывают 0,4 части раствора LaCl3. Образец сушат на воздухе при комнатной температуре и затем кальцинируют на воздухе при 550°С в течение 4 часов. Образовавшееся твердое вещество размалывают и просеивают. Просеянные частицы помещают в чистый никелевый реактор (сплав 200). Реактор имеет такую конфигурацию, чтобы этилен, этан, HCl, кислород и инертный газ (смесь гелия и аргона) можно было вводить в реактор. Конкретные данные эффективности для данного примера приводятся ниже, в таблице 7.
| Таблица 7 | ||||||||
| Композиции редкоземельных элементов с дополнительными компонентами | ||||||||
| Пример | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 |
| Молярные отношения компонентов сырья | ||||||||
| C2H4 | 3,7 | 3,6 | 3,7 | 3,7 | 3,7 | 3,7 | 3,6 | 3,7 |
| HCl | 2,0 | 2,0 | 2,0 | 2,0 | 2,0 | 2,0 | 2,0 | 2,0 |
| O2 | 1,0 | 1,0 | 1,0 | 1,0 | 1,0 | 1,0 | 1,0 | 1,0 |
| Не+Ar | 0,2 | 0,2 | 0,2 | 0,2 | 0,2 | 0,2 | 0,2 | 0,2 |
| Т (°С) | 400 | 401 | 400 | 399 | 401 | 400 | 400 | 401 |
| Время контактирования потока с катализатором (с) | 4,8 | 20,3 | 6,7 | 3,6 | 7,9 | 7,8 | 12,8 | 16,7 |
| Фракционные превращения (проценты) | ||||||||
| С2Н4 | 18,2 | 11,7 | 14,1 | 24,6 | 18,5 | 16,5 | 18,7 | 15,2 |
| HCl | 34,6 | 22,1 | 24,4 | 57,1 | 40,9 | 38,2 | 35,2 | 21,1 |
| О2 | 55,6 | 33,2 | 48,0 | 52,0 | 50,3 | 47,4 | 50,9 | 56,4 |
| Селективности (проценты) | ||||||||
| МВХ | 64,5 | 54,6 | 53,6 | 56,0 | 76,4 | 71,8 | 73,2 | 55,1 |
| C2H4Cl2 | 11,5 | 15,2 | 10,0 | 31,4 | 9,6 | 12,7 | 5,2 | 7,3 |
| С2Н5Cl | 5,0 | 10,0 | 7,4 | 2,9 | 4,0 | 4,9 | 4,9 | 12,4 |
| COx | 10,8 | 18,6 | 26,6 | 6,0 | 7,6 | 8,8 | 13,6 | 24,1 |
Приведенные данные показывают получение винилхлорида из этиленсодержащих потоков с использованием катализаторов на основе лантана, которые содержат другие элементы или нанесены на носитель.
Примеры от 26 до 31
В примерах от 26 до 31 показаны некоторые модификации, возможные для изменения получения полезных композиций редкоземельных элементов.
Раствор LaCl3 в воде получают растворением одной части коммерчески доступного гидратированного хлорида лантана (от фирмы Spectrum Quality Products) в 10 частях деионизированной воды. Быстрое добавление при перемешивании 6 М гидроксида аммония в воде (разбавленный, сертифицированный реагент ACS, полученный от фирмы Fisher Scientific) вызывает образование геля. Смесь центрифугируют для сбора твердого вещества. Раствор декантируют от геля и выгружают. Получают насыщенный раствор 0,61 частей хлорида бензилтриэтиламмония (от фирмы Aldrich Chemical Company) в деионизированной воде. Раствор добавляют к гелю и перемешивают. Собранный гель кальцинируют при 550°С в течение 4 часов. Конкретные данные эффективности для данного примера приводятся ниже, в таблице 8. Данный пример иллюстрирует использование добавленных солей аммония для изменения получения композиций редкоземельных элементов.
Раствор LaCl3 в воде получают растворением одной части коммерчески доступного гидратированного хлорида лантана (от фирмы Spectrum Quality Products) в 10 частях деионизированной воды. Быстрое добавление при перемешивании 6 М гидроксида аммония в воде (разбавленный, сертифицированный реагент ACS, полученный от фирмы Fisher Scientific) вызывает образование геля. Смесь центрифугируют для сбора твердого вещества. Одну часть ледяной уксусной кислоты добавляют к гелю и гель снова растворяется. Добавление раствора к 26 частям ацетона вызывает образование осадка. Раствор декантируют и твердое вещество кальцинируют при 550°С в течение 4 часов. Конкретные данные эффективности для данного примера приводятся ниже, в таблице 8. Данный пример иллюстрирует получение полезных композиций лантана разложением аддуктов карбоновой кислоты и хлора, содержащих соединения редкоземельных элементов.
Раствор LaCl3 в воде получают растворением одной части коммерчески доступного гидратированного хлорида лантана (от фирмы Spectrum Quality Products) в 10 частях деионизированной воды. Быстрое добавление при перемешивании 6 М гидроксида аммония в воде (разбавленный, сертифицированный реагент ACS, полученный от фирмы Fisher Scientific), вызывает образование геля. Смесь центрифугируют для сбора твердого вещества. Собранный гель снова суспендируют в 3,33 частях деионизированной воды. Последующее добавление 0,0311 частей реагента, фосфорной кислоты (от фирмы Fisher Scientific) не вызывает видимые изменения в суспендированном геле. Смесь снова центрифугируют и раствор декантируют от фосфорсодержащего геля. Собранный гель кальцинируют при 550°С в течение 4 часов. Прокаленное твердое вещество имеет площадь поверхности BET 33,05 м 2 /г. Конкретные данные эффективности для данного примера приводятся ниже, в таблице 8. Данный пример иллюстрирует получение композиции редкоземельного элемента, содержащего также фосфор в виде фосфата.
Раствор LaCl3 в воде получают растворением одной части коммерчески доступного гидратированного хлорида лантана (от фирмы Acros Organics) в 6,6 частях деионизированной воды. Раствор получают смешиванием 0,95 частей коммерчески доступного DABCO, или 1,4-диазабицикло[2.2.2]октана (от фирмы INC Pharmaceuticals), в 2,6 частях деионизированной воды. Быстрое смешивание с перемешиванием двух растворов вызывает образование геля. Смесь центрифугируют для сбора твердого вещества. Собранный гель снова суспендируют в 6,67 частях деионизированной воды. Смесь снова центрифугируют и раствор декантируют от геля. Собранный гель кальцинируют в течение 4 часов при 550°С. Прокаленное твердое вещество имеет площадь поверхности BET 38,77 м 2 /г. Конкретные данные эффективности для данного примера приводятся ниже, в таблице 8. Данный пример иллюстрирует пригодность алкиламина при получении полезной композиции редкоземельного элемента.
Раствор LaCl3 в воде получают растворением одной части коммерчески доступного гидратированного хлорида лантана (от фирмы Acros Organics) в 10 частях деионизированной воды. К этому раствору быстро добавляют с перемешиванием 2,9 частей коммерчески доступного гидроксида тетраметиламмония (куплен к Aldrich Chemical Company), тем самым вызывая образование геля. Смесь центрифугируют и раствор декантируют. Собранный гель снова суспендируют в 6,67 частях деионизированной воды. Смесь снова центрифугируют и раствор декантируют от геля. Собранный гель кальцинируют в течение 4 часов при 550°С. Прокаленное твердое вещество имеет площадь поверхности BET 80,35 м 2 /г. Конкретные данные эффективности для данного примера приводятся ниже, в таблице 8. Данный пример иллюстрирует пригодность гидроксида алкиламмония для образования полезной композиции редкоземельного элемента.
Раствор LaCl3 в воде получают растворением одной части коммерчески доступного гидратированного хлорида лантана (от фирмы Avocado Research Chemicals Ltd.) в 6,67 частях деионизированной воды. К этому раствору быстро добавляют с перемешиванием 1,63 частей коммерчески доступного 5 н раствора NaOH (Fisher Scientific)), тем самым вызывая образование геля. Смесь центрифугируют и раствор декантируют. Собранный гель кальцинируют в течение 4 часов при 550°С. Прокаленное твердое вещество имеет площадь поверхности BET 16,23 м 2 /г. Конкретные данные эффективности для данного примера приводятся ниже, в таблице 8. Данный пример показывает пригодность не содержащих азот оснований для образования каталитически интересных материалов. Хотя возможно, что функционально данные испытанные материалы уступают материалам, полученным с использованием азотсодержащих оснований.
| Таблица 8 | ||||||
| Дополнительные способы получения лантансодержащих композиции | ||||||
| Пример | 26 | 27 | 28 | 29 | 30 | 31 |
| Молярные отношения компонентов сырья | ||||||
| C2H4 | 3,6 | 3,7 | 3,6 | 3,7 | 3,7 | 3,7 |
| HCl | 2,0 | 2,0 | 2,0 | 2,0 | 2,0 | 2,0 |
| O2 | 1,0 | 1,0 | 1,0 | 1,0 | 1,0 | 1,0 |
| Не+Ar | 0,2 | 0,2 | 0,2 | 0,2 | 0,2 | 0,2 |
| Т (°С) | 401 | 400 | 400 | 399 | 400 | 401 |
| Время контактирования потока с катализатором (с) | 8,6 | 20,8 | 4,7 | 8,7 | 6,2 | 20,0 |
| Фракционные превращения (проценты) | ||||||
| С2Н4 | 18,8 | 8,7 | 15,6 | 17,4 | 21,0 | 9,3 |
| HCl | 35,8 | 7,7 | 20,0 | 41,5 | 48,4 | 22,3 |
| О2 | 53,0 | 32,6 | 48,8 | 50,6 | 56,8 | 17,9 |
| Селективности (проценты) | ||||||
| МВХ | 73,4 | 26,0 | 72,1 | 76,8 | 77,6 | 17,5 |
| C2H4Cl2 | 8,7 | 11,9 | 7,1 | 7,3 | 7,8 | 46,2 |
| С2Н5Cl | 3,5 | 22,7 | 5,6 | 4,2 | 2,9 | 25,6 |
| COx | 9,8 | 38,6 | 12,7 | 7,6 | 6,3 | 9,1 |
Для дальнейшей демонстрации пригодности композиции 1,2-дихлорэтан дегидрохлорируют для получения винилхлорида при использовании композиции в качестве катализатора. Раствор LaCl3 получают растворением одной части коммерчески доступного гидратированного хлорида лантана (от фирмы Avocado Research Chemicals Ltd.) в 6,67 частях деионизированной воды. Быстрое добавление с перемешиванием 6 М гидроксида аммония в воду (разбавленный, сертифицированный реагент ACS, полученный от фирмы Fisher Scientific) вызывает образование геля. Смесь центрифугируют для сбора твердого вещества. Собранный гель сушат при 120°С перед прокаливанием на воздухе при 550°С в течение четырех часов. Образовавшееся твердое вещество размалывают и просеивают. Просеянные частицы помещают в чистый никелевый реактор (сплав 200). Реактор имеет такую конфигурацию, чтобы 1,2-дихлорэтан и гелий можно было вводить в реактор. Время контактирования потока с катализатором вычисляют как объем катализатора, деленный на скорость потока. Скорости потоков приводятся в молярных отношениях. Композицию нагревают до 400°С и обрабатывают 1:1:3 смесью HCl:O2:Не в течение 2 часов до начала операции. Реакторная система действует с подачей сырья, содержащего этан и этилен, для получения винилхлорида в течение 134 часов при температуре 400°С. В это время состав сырья изменяют, чтобы оно содержало только Не и 1,2-дихлорэтан в отношении 5:1 при температуре 400°С. Скорость потока регулируют так, чтобы получить время контактирования с катализатором 16,0 секунд. Анализ продукта показывает более чем 99,98 процентное превращение 1,2-дихлорэтана с молярной селективностью образования винилхлорида больше, чем 99,11 процента. Спустя 4,6 часа по потоку эксперимент заканчивают. Анализ потока продукта в указанное время показывает, что превращение 1,2-дихлорэтана составляет 99,29 процента с молярной селективностью превращения в винилхлорид выше, чем 99,45 процента.
Другие осуществления изобретения будут очевидны специалистам в данной области в результате обсуждения данного описания или применения на практике описанного здесь изобретения. Следует учесть, что описание и примеры должны рассматриваться только в качестве иллюстративных, причем истинный объем и сущность изобретения определяется следующей формулой изобретения.
1. Способ получения винилхлорида из этилена путем оксидегидрохлорирования, включающий:
(a) объединение реагентов, включая этилен, источник кислорода и источник хлора, в реакторе, содержащем катализатор, при температуре 350-500°С и давлении от атмосферного до 3,5 МПа, т.е. в условиях, достаточных для получения потока продукта, включающего винилхлорид и этилен;
причем катализатор включает один или несколько редкоземельных материалов при условии, что атомное соотношение между редкоземельным металлом и окислительно-восстановительным металлом (железо и медь) в катализаторе составляет более 10, и при следующем условии, что, когда присутствует церий, катализатор дополнительно включает, по меньшей мере, еще один редкоземельный элемент, отличный от церия, и
(b) рециклизацию этилена из потока продукта обратно для использования на стадии (а).
2. Способ по п.1, где катализатор представляет собой композицию формулы MOCl или MCl3, где М представляет редкоземельный элемент или смесь редкоземельных элементов, выбранных из лантана, церия, неодима, празеодима, диспрозия, самария, иттрия, гадолиния, эрбия, иттербия, гольмия, тербия, европия, тулия и лютеция.
3. Способ по п.2, где катализатор является композицией формулы MOCl.
4. Способ по п.3, где композиция катализатора имеет площадь поверхности BET от 12 до 200 м 2 /г.
5. Способ по п.4, где композиция катализатора имеет площадь поверхности BET от 30 до 200 м 2 /г.
6. Способ по любому из пп.2-5, где композицию катализатора получают способом, включающим следующие стадии:
(a) получение раствора хлоридной соли редкоземельного элемента или элементов в растворителе, представляющем собой либо воду, спирт, либо их смеси;
(b) добавление азотсодержащего основания, чтобы вызвать образование осадка, и
(c) сбор, сушку и прокаливание осадка для образования композиции MOCl.
7. Способ по п.2, где катализатор представляет собой композицию формулы MCl2.
8. Способ по п.7, где композиция катализатора формулы MCl3 имеет площадь поверхности BET от 5 до 200 м 2 /г.
9. Способ по п.8, где композиция катализатора имеет площадь поверхности BET от 30 до 200 м 2 /г.
10. Способ по любому из пп.7-9, где катализатор получают способом, включающим следующие стадии:
(а) получение раствора хлоридной соли редкоземельного элемента или элементов в растворителе, представляющем собой либо воду, спирт, либо их смеси;
(b) добавление азотсодержащего основания, чтобы вызвать образование осадка;
(c) сбор, сушку и прокалиние осадка, и
(d) контактирование прокаленного осадка с источником хлора.
11. Способ по любому из пп.1-10, где источник хлора является газообразным и представляет собой, по меньшей мере, один из следующих: хлорид водорода, хлор, хлорированный углеводород, содержащий подвижный хлор, и их смеси.
12. Способ по любому из пп.1-11, где этан также смешивают с этиленом, источником кислорода и источником хлора в реакторе.
13. Способ по п.12, где общее число молей в минуту этилена, входящего в реактор, по существу равно общему числу молей в минуту этилена, покидающего реактор в потоке продукта, и, далее, где по существу весь этилен, покидающий реактор, рециклизуют.
14. Способ по п.12 или 13, где этан, присутствующий в потоке продукта, также рециклизуют обратно для использования на стадии (а) способа.
15. Способ по любому из пп.1-14, где на стадии (b) хлорид водорода из потока продукта также рециклизуют обратно для использования на стадии (а) способа.
16. Способ по любому из пп.1-15, где поток продукта содержит монооксид углерода, и монооксид углерода рециклизуют из потока продукта обратно для использования на стадии (а) способа.
17. Способ по любому из пп.1-16, где церий, который присутствует в катализаторе, представлен в количестве менее чем 33 ат.% относительно редкоземельных компонентов.
18. Способ по любому из пп.1-17, где компонент катализатора, являющийся редкоземельным материалом, основан на лантане, неодиме, празеодиме или смесях одного или нескольких указанных элементов.
19. Способ по п.18, где компонент катализатора, являющийся редкоземельным материалом, основан на лантане.
20. Способ по любому из пп.1-19, где катализатор представляет собой пористый, сыпучий катализатор.
21. Способ по любому из пп.1-20, где катализатор дополнительно включает элементы, выбранные из щелочноземельных металлов, бора, фосфора, титана, циркония, гафния и их комбинаций.
22. Способ по п.20, где катализатор загружают в реактор в виде сыпучей соли MOCl, где М представляет редкоземельный элемент или смесь редкоземельных элементов, выбранных из лантана, церия, неодима, празеодима, диспрозия, самария, иттрия, гадолиния, эрбия, иттербия, гольмия, тербия, европия, тулия и лютеция.
23. Способ по п.22, где катализатор, загружаемый в реактор, представляет собой сыпучий катализатор LaOCl.
24. Каталитическая композиция формулы MOCl для получения винилхлорида, где М представляет, по меньшей мере, один редкоземельный элемент, выбранный из лантана, церия, неодима, празеодима, диспрозия, самария, иттрия, гадолиния, эрбия, иттербия, гольмия, тербия, европия, тулия и лютеция, при условии, что, когда присутствует церий, присутствует также, по меньшей мере, один редкоземельный элемент, отличный от церия, причем катализатор, кроме того, характеризуется как имеющий площадь поверхности BET от 12 до 200 м 2 /г, и где атомное соотношение между редкоземельным металлом и окислительно-восстановительным металлом (железо и медь) в катализаторе составляет более 10.
25. Композиция по п.24, где М представляет смесь, по меньшей мере, двух редкоземельных элементов из лантана, церия, неодима, празеодима, диспрозия, самария, иттрия, гадолиния, эрбия, иттербия, гольмия, тербия, европия, тулия и лютеция.
26. Композиция по любому из пп.24 и 25, где композиция нанесена на инертный носитель.
27. Композиция по любому из пп.24-26, где композиция представляет собой пористый, сыпучий материал.
28. Композиция по любому из пп.24-27, где площадь поверхности BET композиции составляет от 30 до 200 м 2 /г.
29. Композиция по любому из пп.24-28, где композиция катализатора включает LaOCl.
30. Композиция по любому из пп.24-29, полученная способом, включающим следующие стадии:
(a) получение раствора хлоридной соли редкоземельного элемента или элементов в растворителе, представляющем собой либо воду, спирт, либо их смеси;
(b) добавление азотсодержащего основания, чтобы вызвать образование осадка, и
(c) сбор, сушку и прокаливание осадка с образованием композиции MOCl.
31. Каталитическая композиция формулы MCl3, для получения винилхлорида, где М представляет, по меньшей мере, один редкоземельный элемент, выбранный из лантана, церия, неодима, празеодима, диспрозия, самария, иттрия, гадолиния, эрбия, иттербия, гольмия, тербия, европия, тулия и лютеция, при условии, что, когда присутствует церий, то присутствует также, по меньшей мере, один редкоземельный элемент, отличный от церия, причем катализатор, кроме того, характеризуется как имеющий площадь поверхности BET от 5 до 200 м 2 /г, и где атомное соотношение между редкоземельным металлом и окислительно-восстановительным металлом (железо и медь) в катализаторе составляет более 10.
32. Композиция по п.31, где М представляет смесь, по меньшей мере, двух редкоземельных элементов из лантана, церия, неодима, празеодима, диспрозия, самария, иттрия, гадолиния, эрбия, иттербия, гольмия, тербия, европия, тулия и лютеция.
33. Композиция по любому из пп.31-32, где площадь поверхности BET композиции составляет от 30 до 200 м 2 /г.
34. Композиция по любому из пп.31-33, где катализатор включает LaCl3.
35. Композиция по любому из пп.31-34, где композицию получают способом, включающим следующие стадии:
(a) получение раствора хлоридной соли редкоземельного элемента или элементов в растворителе, представляющем собой либо воду, спирт, либо их смеси;
(b) добавление азотсодержащего основания, чтобы вызвать образование осадка;
(c) сбор, сушку и прокаливание осадка и
(d) контактирование прокаленного осадка с источником хлора.
36. Композиция по п.35, где источник хлора является газообразным и выбран из HCl, Cl2 и их смесей.
37. Способ каталитического дегидрохлорирования сырья, содержащего один или несколько компонентов, выбранных из этилхлорида, 1,2-дихлорэтана и 1,1,2-трихлорэтана, с использованием композиции формулы MOCl, где М представляет, по меньшей мере, один редкоземельный элемент, выбранный из лантана, церия, неодима, празеодима, диспрозия, самария, иттрия, гадолиния, эрбия, иттербия, гольмия, тербия, европия, тулия и лютеция, при условии, что, когда присутствует церий, присутствует также, по меньшей мере, один редкоземельный элемент, отличный от церия, причем катализатор, кроме того, характеризуется как имеющий площадь поверхности BET от 12 до 200 м 2 /г, и где атомное соотношение между редкоземельным металлом и окислительно-восстановительным металлом (железо и медь) в катализаторе составляет более 10.
38. Способ по п.37, где в формуле, описывающей композицию, М представляет смесь, по меньшей мере, двух редкоземельных элементов из лантана, церия, неодима, празеодима, диспрозия, самария, иттрия, гадолиния, эрбия, иттербия, гольмия, тербия, европия, тулия и лютеция.
39. Способ по любому из пп.37-38, где композиция нанесена на инертный носитель.
40. Способ по любому из пп.37-39, где композиция представляет собой пористый, сыпучий материал.
41. Способ по любому из пп.37-40, где площадь поверхности BET композиции составляет от 30 до 200 м 2 /г.
42. Способ по любому из пп.37-41, где композиция катализатора включает LaOCl.
43. Способ по любому из пп.37-42, где композиция получена способом, включающим следующие стадии:
(a) получение раствора хлоридной соли редкоземельного элемента или элементов в растворителе, представляющем собой либо воду, спирт, либо их смеси;
(b) добавление азотсодержащего основания, чтобы вызвать образование осадка, и
(c) сбор, сушку и прокаливание осадка с образованием композиции MOCl.
44. Способ каталитического дегидрохлорирования сырья, содержащего один или несколько компонентов, выбранных из этилхлорида, 1,2-дихлорэтана и 1,1,2-трихлорэтана с использованием каталитической композиции формулы MCl3, где М представляет, по меньшей мере, один редкоземельный элемент, выбранный из лантана, церия, неодима, празеодима, диспрозия, самария, иттрия, гадолиния, эрбия, иттербия, гольмия, тербия, европия, тулия и лютеция, при условии, что, когда присутствует церий, то присутствует также, по меньшей мере, один редкоземельный элемент, отличный от церия, причем катализатор, кроме того, характеризуется как имеющий площадь поверхности BET от 5 до 200 м 2 /г, и где атомное соотношение между редкоземельным металлом и окислительно-восстановительным металлом (железо и медь) в катализаторе составляет более 10.
45. Способ по п.44, где в формуле, описывающей композицию, М представляет смесь, по меньшей мере, двух редкоземельных элементов из лантана, церия, неодима, празеодима, диспрозия, самария, иттрия, гадолиния, эрбия, иттербия, гольмия, тербия, европия, тулия и лютеция.
46. Способ по любому из пп.44-45, где площадь поверхности BET композиции составляет от 30 до 200 м 2 /г.
47. Способ по любому из пп.44-46, где катализатор включает LaCl3.
48. Способ по любому из пп.44-47, где композицию получают способом, включающим следующие стадии:
(a) получение раствора хлоридной соли редкоземельного элемента или элементов в растворителе, представляющем собой либо воду, спирт, либо их смеси;
(b) добавление азотсодержащего основания, чтобы вызвать образование осадка;
(c) сбор, сушку и прокаливание осадка, и
(d) контактирование прокаленного осадка с источником хлора.
49. Способ по п.48, где источник хлора является газообразным и выбран из HCl, Cl2 и их смесей.
50. Способ по п.1, где используемый катализатор отличается тем, что является водорастворимым после периода использования в способе.
51. Способ получения винилхлорида из этилена путем оксидегидрохлорирования, включающий:
объединение реагентов, включающих этилен, источник кислорода и источник хлора, в реакторе, содержащем катализатор, при температуре 350-500°С и давлении от атмосферного до 3,5 МПа, т.е. в условиях, достаточных для получения потока продукта, включающего винилхлорид и этилен;
причем катализатор включает один или несколько редкоземельных материалов при условии, что атомное соотношение между редкоземельным металлом и окислительно-восстановительным металлом (железо и медь) в катализаторе составляет более 10, и при следующем условии, что когда присутствует церий, то катализатор далее включает, по меньшей мере, один редкоземельный элемент, отличный от церия.
52. Способ по п.51, где катализатор представляет собой композицию формулы MOCl или MCl3, где М представляет редкоземельный элемент или смесь редкоземельных элементов, выбранных из лантана, церия, неодима, празеодима, диспрозия, самария, иттрия, гадолиния, эрбия, иттербия, гольмия, тербия, европия, тулия и лютеция.
53. Способ по п.52, где катализатор представляет собой композицию формулы MOCl.
54. Способ по п.53, где композиция катализатора имеет площадь поверхности BET от 12 до 200 м 2 /г.
55. Способ по любому из пп.52 и 53, где каталитическую композицию получают способом, включающим следующие стадии:
(a) получение раствора хлоридной соли редкоземельного элемента или элементов в растворителе, представляющем собой либо воду, спирт, либо их смеси;
(b) добавление азотсодержащего основания, чтобы вызвать образование осадка, и
(c) сбор, сушку и прокаливание осадка, чтобы образовать композицию MOCl.
56. Способ по п.52, где катализатор представляет собой композицию формулы MCl3.
57. Способ по п.56, где композиция катализатора формулы MCl3 имеет площадь поверхности BET от 5 до 200 м 2 /г.
58. Способ по любому из пп.56 и 57, где катализатор получают способом, включающим следующие стадии:
(a) получение раствора хлоридной соли редкоземельного элемента или элементов в растворителе, представляющем собой либо воду, спирт, либо их смеси;
(b) добавление азотсодержащего основания, чтобы вызвать образование осадка;
(c) сбор, сушку и прокаливание осадка, и
(d) контактирование прокаленного осадка с источником хлора.
59. Способ по любому из пп.51-58, где источник хлора является газом и представляет собой по меньшей мере один из следующих газов: хлорид водорода, хлор, хлорированный углеводород, содержащий подвижный хлор, и их смеси.
60. Способ по любому из пп.51-59, где этан смешивают также с этиленом, источником кислорода и источником хлора в реакторе.
61. Способ по любому из пп.51-60, где компонент катализатора, являющийся редкоземельным материалом, основан на лантане, церии, неодиме, празеодиме, диспрозии, самарии, иттербии, гадолинии, эрбии, иттрии, гольмии, тербии, европии, тулии, лютеции или их смесях.
💥 Видео
Получение этилена и изучение его свойств. | Практическая работа № 1.Скачать

Расчет выхода продукта от теоретически возможного. 10 класс.Скачать

Что такое линейный и логарифмический переменный резистор.Чем они отличаются и где применяются.Скачать

Когда ждать двойную индексацию пенсийСкачать

Химия 9 класс — Как определять Степень Окисления?Скачать

65. Что такое реакция гидратации и реакция дегидратацииСкачать

Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

ЭТО ПОМОЖЕТ разобраться в Органической Химии — Алкены, Урок ХимииСкачать

Реакция полимеризации. Производство полиэтилена. 10 класс.Скачать