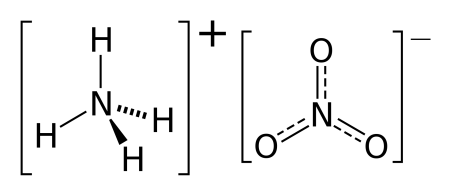Аммиачная селитра химическое соединение азота, водорода и кислорода, очень сильный окислитель.
Имеет несколько названий: нитрат аммония, аммонийная селитра, аммиачная селитра имеет формулу NH4NO3.
Основное применение как удобрение в сельском хозяйстве, а также в получении некоторых взрывчатых веществ.
- Что такое селитра аммиачная
- Аммиачная селитра NH4NO3 физические свойства
- Получение аммиачной селитры в лабораторных условиях
- Получение нитрата аммония в промышленности
- Методом Габера
- Нитрофосфатный метод
- Применение аммиачной селитры
- Что мы узнали о аммиачной селитра?
- Похожие страницы:
- Leave a Comment
- Азотная кислота: получение и химические свойства
- Строение молекулы и физические свойства
- Способы получения
- Химические свойства
- Нитрат аммония
- Содержание
- Физические свойства
- Растворимость
- Состав
- Методы получения
- Основной метод
- Метод Габера
- Нитрофосфатный метод
- Химические свойства
- Кристаллические состояния нитрата аммония
- Применение
- Удобрения
- Взрывчатые вещества
- Безопасный состав
- Дополнительная информация
- 🎬 Видео
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Что такое селитра аммиачная
Аммиачная селитра это азот содержащее неорганическое вещество, в нормальных условиях это белое кристаллическое вещество, очень хорошо растворяется в воде при этом вода начинает терять свою температуру, растворимость селитры напрямую зависит от температуры воды. Химический состав NH4NO3 — азот 35%, водород 5% и кислород 60%.
Имеет температуру плавления 169 С°. Более высокая температура приводит к медленному разложению селитры на оксид азота и воду
Мгновенное нагревание, сильный удар или детонация может привести его к разложению в виде взрыва, что используется в производстве некоторых взрывчатых веществ.
Видео:Химия 9 класс (Урок№15 - Азотная кислота. Строение молекулы.Соли азотной кислоты.Азотные удобрения.)Скачать

Аммиачная селитра NH4NO3 физические свойства
Нитрат аммония горючее взрывоопасное вещество в виде порошка или гранул. Мол. масса 80,04; плотн. 1725 кг/м 3 при 25 °С; т. плавл. 169,6 °С; в воде растворяется.
Температура самовоспл. 350 °С; нижн. конц. предел распр. пл. 175 г/м 3 . При нагревании в замкнутом пространстве, когда продукты терморазложения свободно не удаляются, аммиачная селитра может при некоторых условиях взрываться, а также может взрываться под воздействием сильных ударов (например, при инициировании взрывчатыми веществами).
Аммиачная селитра, содержащая 0,3% (масс.) хлор-иона, разлагается со взрывом при 230 °C. Образец смеси аммиачной селитры с полиэтиленом, фосфатом кальция или с 3%-ной талькомагнезитовой добавкой в соотношении 1 : 1 имеет т. самовоспл. 350 °С; нижн. конц. предел распр. пл. 125 г/м 3 .
Видео:Три способа получения азотной кислоты [NurdRage]Скачать
![Три способа получения азотной кислоты [NurdRage]](https://i.ytimg.com/vi/T0IGRlvcU4I/0.jpg)
Получение аммиачной селитры в лабораторных условиях
Для получения собирают установку (рис. ).
Нагревают колбу 1 с концентрированным раствором аммиака и одновременно прибавляют из капельной воронки 3 в поглотительную колонку 2 азотную кислоту (р = 1,4 г/см 3 ) по каплям, т. е. направляют реагирующие вещества навстречу друг другу (принцип противотока).

Для этого служит колонка с битым стеклом. Стекающую в стакан 4 жидкость испытывают универсальным индикатором (или лакмусовой бумажкой).
Если нейтрализация кислоты произошла не полностью, то содержимое стакана 4 приливают в капельную воронку 3 и снова пропускают через колонку 2.
Так поступают до тех пор, пока находящаяся в стакане с жидкостью индикаторная бумажная полоска не покажет нейтральную или слабощелочную реакцию. Тогда прекращают нагревание колбы 1, содержащей раствор аммиака, и дают стечь всей жидкости в стакан 4.
Рис. Установка для получения аммиачной селитры:
1 — колба реактор, 2- поглотительная колонка с битым стеклом, 3 — капельная воронка, 4 — стакан.
Газообразный аммиак и раствор азотной кислоты, встречаясь друг с другом в поглотительной колонке 2, образуют белый дым, состоящий из кристалликов нитрата аммония.
Раствор соли (вместе с непрореагировавшей азотной кислотой) стекает в стакан. О разогревании жидкости судят по показаниям термоскопа.
Из стакана 4 жидкость переливают в фарфоровую чашку, осторожно упаривают и охлаждают. Выделившиеся кристаллы аммиачной селитры (после сливания маточного раствора) дают рассмотреть учащимся.
После полного удаления воды из раствора аммиачной селитры последняя плавится. Жидкость застывает в сплошную кристаллическую массу белого цвета с желтоватым оттенком. При температуре 190°С аммиачная селитра разлагается.
Видео:Реакции 16ти металлов с азотной кислотой разной концентрации Reactions of 16 metals with nitric acidСкачать

Получение нитрата аммония в промышленности
Основная часть нитрата аммония получаемая в промышленных масштабах, производиться в поглотительных установках, где производиться на прямую реакция между газообразным аммиаком и азотной кислотой:
В результате реакции образуется большое количество тепла, что неприменимо получения аммиачной селитры в не производстве так как возможны выбросы газообразного аммиака или азотной кислоты.
Полученный водный раствор обезвоживают и гранулируют для предотвращения поглощения воды из кислорода воздуха, так как аммиачная селитра очень гигроскопична.
Методом Габера
Основан на том что в процессе синтеза аммиака, некоторая часть его окисляется до азотной кислоты которая реагирует с аммиаком в результате чего образуется аммиачная селитра.
реакция протекает при высокой температуре, давлении и в присутствии катализатора.
Нитрофосфатный метод
Основан на биохимических процессах которые происходят в природе, результаты этих процессов подвергают обработкой азотной кислотой.
Этот процесс протекает в три этапа:
2. Полученную смесь охлаждают до 0 °C, в результате чего нитрат кальция кристаллизуется.
3. Не очищенный нитрат кальция действуют аммиаком в результате чего образуется аммиачная селитра (нитрат аммония).
Видео:Получение концентрированной азотной кислотыСкачать

Применение аммиачной селитры
Основной источник применения в сельском хозяйстве для удобрения сельскохозяйственных угодий, а также в небольших количествах гранулы плодородия используют в домашних условиях.
В химической промышленности иногда используют в разогреве контактного аппарата в получении фталевого ангидрида в смесях с другими азот содержащими веществами (нитрат калия, нитрит натрия).
В военном деле в производстве на основе аммиачной селитры взрывчатых веществ таких как амонал, аммонит, детонит, акванал и некоторые другие.
Так широко известны аммониты как смеси с другими взрывчатыми веществами, тринитротолуолом, гексогеном, а так же для снижения взрывного свойства динамит (тринитроглицерин).
Видео:Реакция АЛЮМИНИЯ, СЕРЫ и НИТРАТА АММОНИЯ.The reaction of aluminum, sulfur and ammonium nitrateТермитСкачать

Что мы узнали о аммиачной селитра?
Что в составе аммиачной селитры?
Базовое действующее вещество в составе аммиачной селитры – азот. Его содержание ограничивается пределами от 26 до 34,4 %.
Селитру также называют нитратом аммония или азотнокислым аммонием. Сера – еще один важный элемент. Ее в составе – от 3 до 14 %.
Как получают аммиачную селитру?
Основное получение действием азотной кислоты на аммиак, но нитрат аммония может быть получен из его солей.
Для чего применяют аммиачную селитру?
Аммиачная селитра применяется в огороде для обеспечения культур азотом. Азот нужен растениям в начале процесса роста.
В этот период они потребляют вещество большими порциями. Благодаря наличию серы в составе селитры азот быстро усваивается.
Чем опасна аммиачная селитра?
Сам по себе нитрат аммония не опасен. Конечно, он может послужить причиной взрыва, если его намеренно использовать в качестве взрывчатого вещества.
Присутствие таких примесей как органические материалы, другие взрывчатые вещества, металлы и сера увеличивают опасность аммиачной селитры.
Что можно сделать с аммиачной селитрой?
Селитры используются как азотные удобрения, при этом калиевая селитра является также источником необходимого растениям калия.
Нитрат калия также является одним из ингредиентов чёрного пороха. Аммонийная селитра используется для приготовления таких взрывчатых веществ как аммонал и аммотол.
Статья на тему Аммиачная селитра
Похожие страницы:
Понравилась статья поделись ей
Leave a Comment
Для отправки комментария вам необходимо авторизоваться.
Видео:Азотная кислота. Физические и химические свойства азотной кислоты. Подготовка к ЕГЭ по химии | ХимияСкачать

Азотная кислота: получение и химические свойства
Видео:Химия 9 класс (Урок№14 - Азот: свойства и применение. Аммиак. Физические и химические свойства.)Скачать

Строение молекулы и физические свойства
Азотная кислота HNO3 – это сильная одноосновная кислота-гидроксид. При обычных условиях бесцветная, дымящая на воздухе жидкость, температура плавления −41,59 °C, кипения +82,6 °C ( при нормальном атмосферном давлении). Азотная кислота смешивается с водой во всех соотношениях. На свету частично разлагается.
Валентность азота в азотной кислоте равна IV, так как валентность V у азота отсутствует. При этом степень окисления атома азота равна +5. Так происходит потому, что атом азота образует 3 обменные связи и одну донорно-акцепторную, является донором электронной пары.
Поэтому строение молекулы азотной кислоты можно описать резонансными структурами:
Обозначим дополнительные связи между азотом и кислородом пунктиром. Этот пунктир по сути обозначает делокализованные электроны. Получается формула:
Видео:Получение азотной кислоты. НитратыСкачать

Способы получения
В лаборатории азотную кислоту можно получить разными способами:
1. Азотная кислота образуется при действии концентрированной серной кислоты на твердые нитраты металлов. При этом менее летучая серная кислота вытесняет более летучую азотную.
Например , концентрированная серная кислота вытесняет азотную из кристаллического нитрата калия:
2. В промышленности азотную кислоту получают из аммиака . Процесс осуществляется постадийно.
1 стадия. Каталитическое окисление аммиака.
2 стадия. Окисление оксида азота (II) до оксида азота (IV) кислородом воздуха.
3 стадия. Поглощение оксида азота (IV) водой в присутствии избытка кислорода.
Видео:Новейший способ синтеза азотной кислоты .Скачать

Химические свойства
Азотная кислота – это сильная кислота . За счет азота со степенью окисления +5 азотная кислота проявляет сильные окислительные свойства .
1. Азотная кислота практически полностью диссоциирует в водном растворе.
2. Азотная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например , азотная кислота взаимодействует с оксидом меди (II):
Еще пример : азотная кислота реагирует с гидроксидом натрия:
3. Азотная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов, сульфитов).
Например , азотная кислота взаимодействует с карбонатом натрия:
4. Азотная кислота частично разлагается при кипении или под действием света:
5. Азотная кислота активно взаимодействует с металлами. При этом никогда не выделяется водород! При взаимодействии азотной кислоты с металлами окислителем всегда выступает азот +5. Азот в степени окисления +5 может восстанавливаться до степеней окисления -3, 0, +1, +2 или +4 в зависимости от концентрации кислоты и активности металла.
металл + HNO3 → нитрат металла + вода + газ (или соль аммония)
С алюминием, хромом и железом на холоду концентрированная HNO3 не реагирует – кислота «пассивирует» металлы, т.к. на их поверхности образуется пленка оксидов, непроницаемая для концентрированной азотной кислоты. При нагревании реакция идет. При этом азот восстанавливается до степени окисления +4:
Золото и платина не реагируют с азотной кислотой, но растворяются в «царской водке» – смеси концентрированных азотной и соляной кислот в соотношении 1 : 3 (по объему):
HNO3 + 3HCl + Au → AuCl3 + NO + 2H2O
Концентрированная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (IV), азот восстанавливается минимально:
С активными металлами (щелочными и щелочноземельными) концентрированная азотная кислота реагирует с образованием оксида азота (I):
Разбавленная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (II).
С активными металлами (щелочными и щелочноземельными), а также оловом и железом разбавленная азотная кислота реагирует с образованием молекулярного азота:
При взаимодействии кальция и магния с азотной кислотой любой концентрации (кроме очень разбавленной) образуется оксид азота (I):
Очень разбавленная азотная кислота реагирует с металлами с образованием нитрата аммония:
Таблица . Взаимодействие азотной кислоты с металлами.
| Азотная кислота | ||||
| Концентрированная | Разбавленная | |||
| с Fe, Al, Cr | с неактивными металлами и металлами средней активности (после Al) | с щелочными и щелочноземельными металлами | с неактивными металлами и металлами средней активности (после Al) | с металлами до Al в ряду активности, Sn, Fe |
| пассивация при низкой Т | образуется NO2 | образуется N2O | образуется NO | образуется N2 |
6. Азотная кислота окисляет и неметаллы (кроме кислорода, водорода, хлора, фтора и некоторых других). При взаимодействии с неметаллами HNO3 обычно восстанавливается до NO или NO2, неметаллы окисляются до соответствующих кислот, либо оксидов (если кислота неустойчива).
Например , азотная кислота окисляет серу, фосфор, углерод, йод:
Безводная азотная кислота – сильный окислитель. Поэтому она легко взаимодействует с красным и белым фосфором . Реакция с белым фосфором протекает очень бурно. Иногда она сопровождается взрывом.
Видеоопыт взаимодействия фосфора с безводной азотной кислотой можно посмотреть здесь.
Видеоопыт взаимодействия угля с безводной азотной кислотой можно посмотреть здесь.
7. Концентрированная а зотная кислота окисляет сложные вещества (в которых есть элементы в отрицательной, либо промежуточной степени окисления): сульфиды металлов, сероводород, фосфиды, йодиды, соединения железа (II) и др. При этом азот восстанавливается до NO2, неметаллы окисляются до соответствующих кислот (или оксидов), а металлы окисляются до устойчивых степеней окисления.
Например , азотная кислота окисляет оксид серы (IV):
Еще пример : азотная кислота окисляет иодоводород:
Сера в степени окисления -2 окисляется без нагревания до простого вещества, при нагревании до серной кислоты.
Например , сероводород окисляется азотной кислотой без нагревания до молекулярной серы:
При нагревании до серной кислоты:
Соединения железа (II) азотная кислота окисляет до соединений железа (III):
8. Азотная кислота окрашивает белки в оранжево-желтый цвет («ксантопротеиновая реакция«).
Ксантопротеиновую реакцию проводят для обнаружения белков, содержащих в своем составе ароматические аминокислоты. К раствору белка прибавляем концентрированную азотную кислоту. Белок свертывается. При нагревании белок желтеет. При добавлении избытка аммиака окраска переходит в оранжевую.
Видеоопыт обнаружения белков с помощью азотной кислоты можно посмотреть здесь.
Видео:ВСЕ РЕАКЦИИ С АЗОТОМ И ЕГО СОЕДИНЕНИЯМИ | ЕГЭ ХИМИЯ 2024| НООСкачать

Нитрат аммония
наименование
210 °C
Нитрат аммония (аммонийная (аммиачная) селитра) — химическое соединение NH4NO3, соль азотной кислоты. Впервые получена Глаубером в 1659 году. Используется в качестве компонента взрывчатых веществ и как азотное удобрение.
Видео:Азотная кислота. Химические свойства. Взаимодействие с металламиСкачать

Содержание
- 1 Физические свойства
- 1.1 Растворимость
- 1.2 Состав
- 2 Методы получения
- 2.1 Основной метод
- 2.2 Метод Габера
- 2.3 Нитрофосфатный метод
- 3 Химические свойства
- 4 Кристаллические состояния нитрата аммония
- 5 Применение
- 5.1 Удобрения
- 5.2 Взрывчатые вещества
- 6 Безопасный состав
- 7 Дополнительная информация
Видео:Разные Селитры для Азотной кислоты и Какую нельзя использовать! Опасно!Скачать

Физические свойства
Кристаллическое вещество белого цвета. Температура плавления 169,6 °C, при нагреве выше этой температуры начинается постепенное разложение вещества, а при температуре 210 °C происходит полное разложение. Температура кипения при пониженном давлении — 235 °C. Молекулярная масса 80,04 а. е.м. Скорость детонации 2570 м/с.
Растворимость
Растворимость в воде:
| Температура, °C | Растворимость, г/100мл |
|---|---|
| 0 | 119 |
| 10 | 150 |
| 25 | 212 |
| 50 | 346 |
| 80 | 599 |
| 100 | 1024 |
При растворении происходит сильное поглощение тепла (аналогично нитрату калия), что значительно замедляет растворение. Поэтому для приготовления насыщенных растворов нитрата аммония применяется нагревание, при этом твёрдое вещество засыпается небольшими порциями.
Также соль растворима в аммиаке, пиридине, метаноле, этаноле.
Состав
Содержание элементов в нитрате аммония в массовых процентах:
Видео:🔥 5 экспериментов с АЗОТНОЙ КИСЛОТОЙ.Скачать

Методы получения
Основной метод
В промышленном производстве используется безводный аммиак и концентрированная азотная кислота:
Реакция протекает бурно с выделением большого количества тепла. Проведение такого процесса в кустарных условиях крайне опасно (хотя в условиях большого разбавления водой нитрат аммония может быть легко получен). После образования раствора, обычно с концентрацией 83 %, лишняя вода выпаривается до состояния расплава, в котором содержание нитрата аммония составляет 95—99,5 % в зависимости от сорта готового продукта. Для использования в качестве удобрения расплав гранулируется в распылительных аппаратах, сушится, охлаждается и покрывается составами для предотвращения слёживания. Цвет гранул варьируется от белого до бесцветного. Нитрат аммония для применения в химии обычно обезвоживается, так как он очень гигроскопичен и процентное количество воды в нём получить практически невозможно.
Метод Габера
По способу Габера из азота и водорода синтезируется аммиак, часть которого окисляется до азотной кислоты и реагирует с аммиаком, в результате чего образуется нитрат аммония:
Нитрофосфатный метод
Этот способ также известен как способ Одда, названный так в честь норвежского города, в котором был разработан этот процесс. Он применяется непосредственно для получения азотных и азотно-фосфорных удобрений из широко доступного природного сырья. При этом протекают следующие процессы:
- Природный фосфат кальция (апатит) растворяют в азотной кислоте:
- Ca3(PO4)2 + 6HNO3 ⟶ 2H3PO4 + 3Ca(NO3)2
- Полученную смесь охлаждают до 0 °C, при этом нитрат кальция кристаллизуется в виде тетрагидрата — Ca(NO3)2·4H2O, и его отделяют от фосфорной кислоты.
- На полученный нитрат кальция, не очищенный от фосфорной кислоты, действуют аммиаком, получая в итоге нитрат аммония:
- Ca(NO3)2 + 4H3PO4 + 8NH3 ⟶ CaHPO4↓ + 2NH4NO3 + 3(NH4)2HPO4
А также амфотерный метод.
Видео:Получение АЗОТНОЙ кислотыСкачать

Химические свойства
Термическое разложение нитрата аммония может происходить по-разному, в зависимости от температуры:
Видео:Азотная кислота и металлы за 13 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

Кристаллические состояния нитрата аммония
Изменения кристаллического состояния нитрата аммония под воздействием температуры и давления меняют его физические свойства. Обычно различают следующие состояния:
| Система | Диапазон температур (°C) | Состояние | Изменение объёма (%) | |
|---|---|---|---|---|
| — | > 169.6 | жидкость | ||
| I | 169.6 — 125.2 | кубическая | −2.13 | |
| II | 125.5 — 84.2 | тетрагональная | −1.33 | |
| III | 84.2 — 32.3 | α-ромбическая | +0.8 | |
| IV | 32.3 — −16.8 | β-ромбическая | −3.3 | |
| V | −50 — −16.8 | тетрагональная | +1.65 | |
| VI | существует при высоких давлениях | |||
| VII | 170 | |||
| VIII | существует при высоких давлениях | |||
| IX | существует при высоких давлениях |
Фазовый переход от IV к III при 32,3 °C приносит неприятности производителям удобрений, потому как изменения плотности приводят к разрушению частиц при хранении и применении. Это особенно важно в тропических странах, где нитрат аммония испытывает циклические изменения, приводящие к разрушению гранул, слёживанию, повышенному пылению и риску возникновения взрыва.
Видео:азотный кислота чуть не взорвалась до конца смотрите химия реакция лабораторияСкачать

Применение
Удобрения
Бо́льшая часть нитрата аммония используется либо непосредственно как хорошее азотное удобрение, либо как полупродукт для получения прочих удобрений. Для предотвращения создания взрывчатых веществ на основе нитрата аммония в удобрения, доступные в широкой продаже, добавляют компоненты, снижающие взрывоопасность и детонационные свойства чистого нитрата аммония, такие как мел (карбонат кальция).
В Австралии, Китае, Афганистане, Ирландии и некоторых других странах свободная продажа нитрата аммония даже в виде удобрений запрещена или ограничена. После террористического акта в Оклахома-Сити ограничения на продажу и хранение нитрата аммония были введены в некоторых штатах США.
Взрывчатые вещества
Наиболее широко в промышленности и горном деле применяются смеси аммиачной селитры с различными видами углеводородных горючих материалов, других взрывчатых веществ, а также многокомпонентные смеси:
- составы типа аммиачная селитра/дизельное топливо (АСДТ)
- жидкая смесь аммиачная селитра/гидразин (Астролит)
- водонаполненные промышленные взрывчатые вещества (Акванал, Акванит и др.)
- смеси с другими взрывчатыми веществами (Аммонит, Детонит и др.)
- смесь с алюминиевой пудрой (аммонал)
Аммиачная селитра отличается большой гигроскопичностью, поэтому в качестве взрывчатого вещества не используется, так как в сыром виде взрывчатые свойства утрачиваются.
Видео:Азотная кислота на ОГЭ по химии | ОГЭ 2023 | УмскулСкачать

Безопасный состав
В 2013 г. сотрудники Sandia National Laboratories объявили о разработке безопасного и эффективного состава на основе смеси нитрата аммония с сульфатом железа, который не может быть использован для создания на его основе взрывчатых веществ. При разложении состава ион SO4 2− связывается с ионом аммония, а ион железа — с нитрат-ионом, что предотвращает взрыв. Введение в состав удобрения сульфата железа может улучшить и технологические характеристики удобрения, особенно на закисленных почвах. Авторы отказались от защиты формулы удобрения патентом с тем, чтобы этот состав мог получить быстрое распространение в регионах с высокой террористической опасностью.
Видео:Как правильно писать ОВР с азотной кислотой? В интернете кто-то неправСкачать

Дополнительная информация
Мировое производство аммиачной селитры на 1980 год составляло 14 млн т, в пересчёте на азот.
🎬 Видео
Разложение нитратов (солей азотной кислоты)Скачать