Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Содержание Видео:Химия с нуля — АЛКИНЫ, Тройная связь, Типы Гибридизации // Органическая ХимияСкачать  РЕАКЦИЯ КУЧЕРОВАРеакция Кучерова для ацетилена (1881 г) стала основой промышленного получения уксусного альдегида как исходного сырья в синтезе многих органических соединений. Кучеров Михаил Григорьевич (1850 – 1911) – российский химик-органик, внесший значительный вклад в развитие органического синтеза. Взаимодействие ацетилена с водой (гидратация) приводит к образованию уксусного альдегида (ацетальдегида): Обязательным условием протекания реакции является присутствие в качестве катализатора раствора (5%) соли ртути (II) в сернокислой (10%) среде. Катализаторами могут быть также соли Au + , Cu + , Ag + и Ru 3+ . Однако доказана лучшая эффективность солей Hg 2+ (чаще HgSO4). Механизм реакции Кучерова для ацетиленаНесмотря на кажущуюся простоту процесса, механизм его до сих пор не совсем ясен. Однако достоверно известно, что одной из промежуточных стадий является образование неустойчивых непредельных спиртов (енолей). Их молекулы содержат гидроксильную группу –ОН у атома углерода с двойной связью. Например, реакция Кучерова для ацетилена проходит следующим образом: Механизм реакции Кучерова для гомологов ацетиленаПри гидратации гомологов ацетилена образуются не альдегиды, а кетоны . Причем присоединение воды происходит по правилу Марковникова: Алкины ряда R ̶ C≡CH при гидратации всегда образуют метилкетоны: R ̶ C(O) ̶ CH3. Реакция получения ацетона (диметилкетона) как раз является таким примером. Алкины ряда R1 ̶ C≡C ̶ R2 при гидратации в зависимости от строения R1 и R2 могут давать смесь кетонов с явным преобладанием одного из них: Как определить, какой кетон будет преобладать? Молекула 4-метилпентина-2 содержит третичный атом углерода. Ближний к нему атом углерода с тройной связью находится в α-положении к нему, следующий – в β-положении. Образование карбонильной группы, характерной для кетонов, происходит в основном у углерода в α-положении. Еще пример:
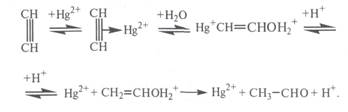
Видео:57. Тримеризация ацетилена получение бензола из ацетиленаСкачать  Получение ацетальдегида гидратацией ацетилена на ртутных катализаторахЛитературный обзор Свойства и применение ацетальдегида Ацетальдегид (этаналь, уксусный альдегид) СНзСНО представляет собой бесцветную легкокипящую жидкость с резким удушливым запахом, с температурой кипения 20,2°С, температурой замерзания -123,5 °С и плотностью 783 кг/м 3 . Критическая температура ацетальдегида 188 °С, температура самовоспламенения 156°С. С воздухом ацетальдегид образует взрывчатые смеси с пределами воспламеняемости при 400°С 3,97 и 57,0% об. Смеси с кислородом воспламеняются при более низкой температуре — около 140 °С. Токсичен, пары ацетальдегида вызывают раздражении слизистых оболочек удушье, головную боль, ПДК составляет 5 мг/м 3 . Относится к 3-му классу опасности. Ацетальдегид смешивается во всех отношениях с водой, этанолом, диэтиловым эфиром и другими органическими растворителями, с некоторыми образует азеотропные смеси.[1, с. 299 ]. Ацетальдегид — это один из важнейших многотоннажных продуктов переработки ацетилена и этилена. Он применяется в широких масштабах в промышленности органического синтеза. Важнейшие направления использования ацетальдегида: o окисление в уксусную кислоту и уксусный ангидрид; o получение циангидрина с последующей переработкой его в акрилонитрил, эфиры акриловой кислоты, молочную кислоту; o альдольная конденсация и переработка альдоля в бутандиол-1,3 и бутадиен-1,3, н-бутанол, кротоновый альдегид; o конденсация с аммиаком с образованием гомологов пиридина и винилпиридинов; o конденсация с формальдегидом до пентаэритрита. В настоящее время на производство уксусной кислоты и ее ангидрида, этилацетата и 2-этилгексанола расходуется в мире 95%, а в нашей стране 75% всего производимого ацетальдегида. [1, с. 300] Помимо этого ацетальдегид или его триммер паральдегид применяют в производстве ацетатов целлюлозы, пероксиуксусной кислоты, этилацетата, глиоксаля, 2-этилгексанола, алкиламинов, алкилпиридинов, хлораля; как восстановитель применяется в производстве зеркал.[2, с.224] Методы получения ацетальдегида Известен ряд методов получения ацетальдегида. Рассмотрим эти методы. Получение ацетальдегида гидратацией ацетилена на ртутных катализаторах Реакция гидратации ацетилена на ртутных катализаторах была открыта М.Г. Кучеровым в 1881 г. и использовалась в промышленности с целью получения ацетальдегида более 60 лет: Реакция сильно экзотермична. До 300 °С она практически необратима, но с дальнейшим ростом температуры равновесие смещается в сторону разложения ацетальдегида. Она протекает в нужном направлении с приемлемой скоростью в присутствии катализаторного раствора (10-20%-ная H2SO4, содержащая 0,5-0,6% HgO в виде HgSO4). Реакция протекает через промежуточное образование комплекса ацетилена с Hg 2+ . Дальнейшее его разложение приводит к образованию ацетальдегида[3, с.440]: Скорость реакции увеличивается с повышением концентрации H2SO4 и температуры процесса, однако при этом возрастает и выход побочных продуктов, прежде всего за счет кротоновой конденсации с образованием кротонового альдегида: и альдольной конденсации с образованием смол (в том числе и с последующей полимеризацией кротонового альдегида). С целью сокращения образования побочных продуктов в реакционную зону подается избыток ацетилена, с которым получающийся ацетальдегид уносится из зоны реакции. Это приводит и к увеличению производительности установки. Вместе с тем подача в избытке ацетилена приводит к уменьшению выхода ацетальдегида за один проход через катализаторный раствор и увеличению рециркуляционных потоков. Конверсия ацетилена в ацетальдегид за один проход составляет 30-50 %. Ацетальдегид является сильным восстановителем. В данном случае в его присутствии Hg 2+ вначале восстанавливается до Hg + , а затем до металлической ртути: в результате образуется ртутный шлам. Восстановителями также могут выступать H2S, РН3 и др. Этот процесс является крайне нежелательным, поскольку металлическая ртуть имеет высокое давление насыщенных паров, которые уносятся с реакционными газами, дезактивируя катализатор и загрязняя окружающую среду. Для предотвращения восстановления ртути в катализаторный раствор добавляют соли трехвалентного железа (в избытке по сравнению с солями ртути). Этим обеспечивается протекание реакции Fe 3+ + Hg + поддерживающей ртуть в максимальной степени окисления. Соль железа добавляют в избытке по отношению к ртути ( 4%: в расчете на Fe2O3), поэтому катализаторный раствор работает достаточно длительное время. Однако в нем постепенно накапливаются соли двухвалентного железа, и раствор направляют на регенерацию, состоящую в окислении азотной кислотой. Несмотря на все эти мероприятия, ртуть все же теряется в виде шлама вместе с продуктами осмоления. Ее расход составляет 1-1,5 кг на 1 т ацетальдегида.[4, с. 195] В промышленности процесс проводят при температуре 75-100 °С, пропуская ацетилен через водный катализаторный раствор. При 50 % конверсии ацетилена выход альдегида составляет 92-93% от прореагировавшего ацетилена. Основную реакцию осуществляют в полой футерованной колонне, заполненной катализаторным раствором и имеющей расширение в верхней части (заполненной насадкой).[3, с. 442] Большим недостатком процесса синтеза ацетальдегида по Кучерову является необходимость применения дорогостоящей и весьма токсичной металлической ртути и ее соединений. Металлическая ртуть летуча; несмотря на высокую температуру кипения (357°С), она испаряется уже при комнатной температуре. При повышенной температуре в условиях процесса гидратации ртуть проникает почти во все аппараты установки и в получаемые продукты. Следствием этого являются значительные потери ртути и возможность профессиональных заболеваний у обслуживающего персонала.[5, с. 489] Вместе с тем этот способ обладает многими преимуществами, которые могут быть успешно реализованы в других технологиях. В частности, этот процесс является одностадийным, обладает хорошей селективностью, может обеспечить одновременное получение двух целевых продуктов (ацетальдегид и кротоновый альдегид). Кроме того, реактор обеспечивает не только проведение собственно реакции, но и отделение продуктов от катализаторного раствора. Эффективное применение рециркуляции как по воде, так и ацетилену обеспечивает не только полное использование сырья, но и служит для подавления побочных реакций, повышая выход целевого продукта. Все это делает процесс достаточно привлекательным, однако высокотоксичная каталитическая система делает его бесперспективным.[3, с. 446] 🌟 ВидеоНеобычное окисление ацетилена #органическаяхимия #ацетиленСкачать  3.2. Алкины: Способы полученияСкачать  Ацетилен получениеСкачать  10 класс - Химия - Химические свойства и применение ацетилена. ПоливинилхлоридСкачать  ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать  ЭТО ПОМОЖЕТ разобраться в Органической Химии — Алкены, Урок ХимииСкачать  Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать  Составление уравнений реакций для генетических цепочек по кислородсодержащим. часть 1Скачать  10 класс - Химия - Алкины. Ацетилен. Состав и строение. ПолучениеСкачать  Опыты по химии. Получение ацетилена и опыты с нимСкачать  Видео №3. Как составить изомерыСкачать  Составление уравнений реакций для генетических цепочек по кислородсодержащим. часть 2Скачать  Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать  Получение АЦЕТИЛЕНА. Получение КАРБИДА КАЛЬЦИЯ. Реакция КАРБИДА КАЛЬЦИЯ и ВОДЫ. Опыты по химии дома.Скачать  Ацетиленовые углеводородыСкачать  3.3. Алкины: Химические свойстваСкачать  Взаимодействие ацетилена с бромной водойСкачать  53. Химические свойства алкинов на примере ацетиленаСкачать  |









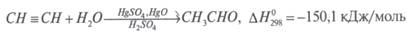
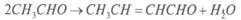
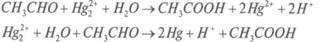
 Fe 2+ + Hg 2+
Fe 2+ + Hg 2+