1 реакция — горение алюминия в кислороде (взаимодействие алюминия с кислородом)
2 реакция — на оксид действуют соляной кислотой, на полученное вещество — щелочью
3 реакция — взаимодействие с соляной кислотой
все легко и просто
2Al + 6Н2О = 2Al(ОН) 3 + 3Н2 — р-ция проводится после снятия оксидной плёнки или с амальгамой.
затем разложить Al(ОН) 3 при нагревании
Видео:Al(OH)3 + NaOH → Na[Al(OH)4] | Получение гидроксида алюминия и растворение его в избытке щёлочиСкачать
![Al(OH)3 + NaOH → Na[Al(OH)4] | Получение гидроксида алюминия и растворение его в избытке щёлочи](https://i.ytimg.com/vi/_u6eAdWg96A/0.jpg)
Алюминий (Al)
Алюминий (квасцы) впервые был полуен в 1825 году датчанином Г. К. Эрстедом. Изначально, до открытия промышленного способа получения, алюминий был дорооже золота.
Алюминий является самым распространенным металлом в земной коре (массовая доля составляет 7-8%), и третьим по распространенности среди всех элементов после кислорода и кремния. В свободном виде в проироде алюминий не встречается.
Важнейшие природные соединения алюминия:
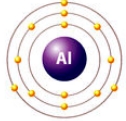
Рис. Строение атома алюминия.
Алюминий химически активный металл — на его внешнем электронном уровне находятся три электрона, которые участвуют в образовании ковалентных связей при взаимодействии алюминия с другими химическими элементами (см. Ковалентная связь). Алюминий — сильный восстановитель, во всех соединениях проявляет степень окисления +3.
При комнатной температуре алюминий вступает в реакцию с кислородом, содержащимся в атмосферном воздухе, с образованием прочной оксидной пленки, которая надежно препятствует процессу дальнейшего окисления (корродирования) металла, в результате чего химическая активность алюминия снижается.
Благодаря оксидной пленке алюминий не вступает в реакцию с азотной кислотой при комнатной температуре, поэтому, алюминиевая посуда является надежной тарой для хранения и трансопртирования азотной кислоты.
Физические свойства алюминия:
- металл серебристо-белого цвета;
- твердый;
- прочный;
- легкий;
- пластичный (протягивается в тонкую проволоку и фольгу);
- обладает высокой электро- и теплопроводностью;
- температура плавления 660°C
- природный алюминий состоит из одного изотопа 27 13Al
Химические свойства алюминия:
- при снятии оксидной пленки алюминий реагирует с водой:
2Al + 6H2O = 2Al(OH)3 + 3H2; - при комнатной температуре вступает в реакции с бромом и хлором с образованием солей:
2Al + 3Br2 = 2AlCl3; - при высокой температуре алюминий реагирует с кислородом и серой (реакция сопровождается выделением большого кол-ва тепла):
4Al + 3O2 = 2Al2O3 + Q;
2Al + 3S = Al2S3 + Q; - при t=800°C реагирует с азотом:
2Al + N2 = 2AlN; - при t=2000°C реагирует с углеродом:
2Al + 3C = Al4C3; - восстанавливает многие металлы из их оксидов — алюмотермией (при t до 3000°C) получают промышленным способом вольфрам, ванадий, титан, кальций, хром, железо, марганец:
8Al + 3Fe3O4 = 4Al2O3 + 9Fe; - с соляной и разбавленной серной кислотой реагирует с выделением водорода:
2Al + 6HCl = 2AlCl3 + 3H2;
2Al + 3H2SO4 = Al2(SO4)3 + 3H2; - с концентрированной серной кислотой реагирует при высокой температуре:
2Al + 6H2SO4 = Al2(SO4)3 + 3SO2 + 6H2O; - со щелочами реагирует с выделением водорода и образованием комплексных солей — реакция идет в несколько этапов: при погружении алюминия в раствор щелочи происходит растворение прочной защитной оксидной пленки, которая находится на поверхности металла; после растворения пленки, алюминий, как активиный металл, реагирует с водой с образованием гидроксида алюминия, который взаимодействует со щелочью, как амфотерный гидроксид:
- Al2O3+2NaOH = 2NaAlO2+H2O — растворение оксидной пленки;
- 2Al+6H2O = 2Al(OH)3+3H2↑ — взаимодействие алюминия с водой с образованием гидроксида алюминия;
- NaOH+Al(OH)3 = NaAlO2+2H2O — взаимодействие гидроксида алюминия со щелочью
- 2Al+2NaOH+2H2O = 2NaAlO2+3H2↑ — суммарное уравнение реакции алюминия со щелочью.
Видео:Качественные реакции с гидроксидами Cu(OH)2, Fe(OH)3, Fe(OH)2, Al(OH)3, Mg(OH)2, NH4OH, Ag2OСкачать

Соединения алюминия
Al2O3 (глинозем)
Оксид алюминия Al2O3 является белым, очень тугоплавким и твердым веществом (в природе тверже только алмаз, карборунд и боразон).
Свойства глинозема:
- не растворяется в воде и вступает с ней в реакцию;
- является амфотерным веществом, реагируя с кислотами и щелочами:
Al2O3 + 6HCl = 2AlCl3 + 3H2O;
Al2O3 + 6NaOH + 3H2O = 2Na3[Al(OH)6]; - как амфотерный оксид реагирует при сплавлении с оксидами металлов и солями, образуя алюминаты:
Al2O3 + K2O = 2KAlO2.
В промышленности глинозем получают из бокситов. В лабораторных условиях глинозем можно получить сжигая алюминий в кислороде:
4Al + 3O2 = 2Al2O3.
Применение глинозема:
- для получения алюминия и электротехнической керамики;
- в качестве абразивного и огнеупорного материала;
- в качестве катализатора в реакциях органического синтеза.
Al(OH)3
Гидроксид алюминия Al(OH)3 является белым твердым кристаллическим веществом, которое получается в результате обменной реакции из раствора гидроксида алюминия — выпадает в виде белого студенистого осадка, кристаллизующегося со временем. Это амфотерное соединение почти не растворимое в воде:
Al(OH)3 + 3NaOH = Na3[Al(OH)6];
Al(OH)3 + 3HCl = AlCl3 + 3H2O.
Гидроксид алюминия получают путем действия щелочей на растворы солей алюминия:
AlCl3 + 3NaOH = Al(OH)3 + 3NaCl.
Видео:Оксид и гидроксид алюминия (Al2O3 и Al(OH)3)Скачать

Получение и применение алюминия
Алюминий достаточно трудно выделить из природных соединений химическим способом, что объясняется высокой прочностью связей в оксиде алюминия, поэтому, для промышленного получения алюминия применяют электролиз раствора глинозема Al2O3 в расплавленном криолите Na3AlF6. В результате процесса алюминий выделяется на катоде, на аноде — кислород:
Исходным сырьем служат бокситы. Электролиз протекает при температуре 1000°C: температура плавления оксида алюминия составляет 2500°C — проводить электролиз при такой температуре не представляется возможным, поэтому оксид алюминия растворяют в расплавленном криолите, и уже затем полученный электролит используют при электролизе для получения алюминия.
Применение алюминия:
- алюминиевые сплавы широко применяются в качестве конструкционных материалов в автомобиле-, самолето-, судостроении: дюралюминий, силумин, алюминиевая бронза;
- в химической промышленности в качестве восстановителя;
- в пищевой промышленности для изготовления фольги, посуды, упаковочного материала;
- для изготовления проводов и проч.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

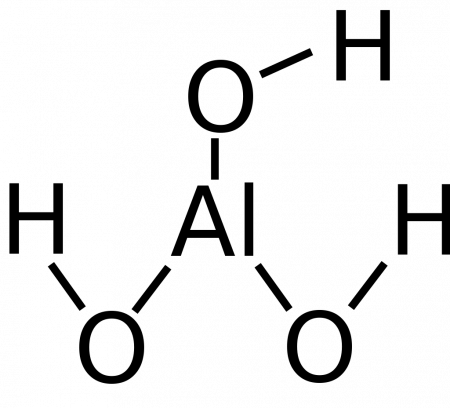
Гидроксид алюминия
Гидроксид алюминия — вещество с формулой Al(OH)3 (а также H3AlO3) — соединение оксида алюминия с водой. Белое студенистое вещество, плохо растворимое в воде, обладает амфотерными свойствами.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Содержание
- 1 Получение
- 2 Физические свойства
- 3 Химические свойства
- 4 Безопасность
- 4.1 ЛД50
- 5 Применение
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Получение
Al(OH)3 получают при взаимодействии солей алюминия с водными растворами щёлочи, избегая их избытка:
AlCl3 + 3 NaOH ⟶ Al(OH)3 ↓ + 3 NaCl
Гидроксид алюминия выпадает в виде белого студенистого осадка.
Второй способ получения гидроксида алюминия — взаимодействие водорастворимых солей алюминия с растворами карбонатов щелочных металлов:
Видео:Решение цепочек превращений по химииСкачать

Физические свойства
Гидроксид алюминия представляет собой белое кристаллическое вещество, для которого известны 4 кристаллические модификации:
- моноклинный (γ) гиббсит
- триклинный (γ’) гиббсит (гидрагилит)
- байерит (γ)
- нордстрандит (β)
Существует также аморфный гидроксид алюминия переменного состава Al2O3•nH2O
Видео:How to Balance Al(OH)3 + HBr = AlBr3 + H2OСкачать

Химические свойства
Свежеосаждённый гидроксид алюминия может взаимодействовать с:
- кислотами
Al(OH)3 + 3 HCl ⟶ AlCl3 + 3 H2O Al(OH)3 + 3 HNO3 ⟶ Al(NO3)3 + 3 H2O
- щелочами
В концентрированном растворе гидроксида натрия: Al(OH)3 + NaOH ⟶ Na[Al(OH)4] При сплавлении твёрдых реагентов: Al(OH)3 + NaOH → 1000oC NaAlO2 + 2 H2O
При нагревании разлагается:
С растворами аммиака не реагирует.
Видео:Взаимодействие гидроксида алюминия с серной кислотой (2Al(OH)3 + 3H2SO4 = 6H2O + Al2(SO4)3)Скачать

Безопасность
>5000 мг/кг (крысы, перорально).
Видео:Амфотерные гидроксиды. Химия ОГЭ 2023 | TutorOnlineСкачать

Применение
Гидроксид алюминия используется при очистке воды, так как обладает способностью адсорбировать различные вещества.
В медицине, в качестве антацидного средства, в качестве адъюванта при изготовлении вакцин.
В качестве абразивного компонента зубной пасты.
В качестве антипирена (подавителя горения) в пластиках и других материалах.
После обработки до окислов применяется в качестве носителя для катализаторов.
🔥 Видео
8 класс. Составление уравнений химических реакций.Скачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

КАК УРАВНЯТЬ Al + O2 = Al2O3 ЭЛЕКТРОННЫМ БАЛАНСОМ / Реакция алюминия и кислородаСкачать

Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать

How to write Equation for Al(OH)3 + H2O (Aluminum hydroxide + Water)Скачать

Как получить соль в 2 стадииСкачать

Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

How to Balance AlP + H2O = Al(OH)3 + PH3Скачать

8 класс. Химия. Как расставить коэффициенты в уравнении?Скачать