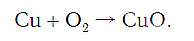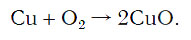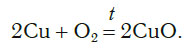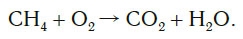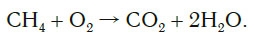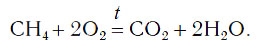В уроке 12 «Составление уравнений химических реакций» из курса «Химия для чайников» мы научимся составлять уравнения химических реакций и правильно расставлять в них коэффициенты.
Составлять химические уравнения и производить расчеты по ним нужно, опираясь на закон сохранения массы веществ при химических реакциях. Рассмотрим, как можно составить химическое уравнение, на примере реакции меди с кислородом.
Слева запишем названия исходных веществ, справа — продуктов реакции. Если веществ два и более, соединяем их знаком «+». Между левой и правой частями пока поставим стрелку:
медь + кислород → соединение меди с кислородом.
Подобное выражение называют схемой химической реакции. Запишем эту схему при помощи химических формул:
Число атомов кислорода в левой части схемы равно двум, а в правой — одному. Так как при химических реакциях атомы не исчезают, а происходит только их перегруппировка, то число атомов каждого элемента до реакции и после реакции должно быть одинаковым. Чтобы уравнять число атомов кислорода в левой и правой частях схемы, перед формулой CuO ставим коэффициент 2:
Теперь число атомов меди после реакции (в правой части схемы) равно двум, а до реакции (в левой части схемы) — только одному, поэтому перед формулой меди Cu так же поставим коэффициент 2. В результате произведенных действий число атомов каждого вида в левой и правой частях схемы одинаково, что дает нам основание заменить стрелку на знак «=» (равно). Схема превратилась в уравнение химической реакции:
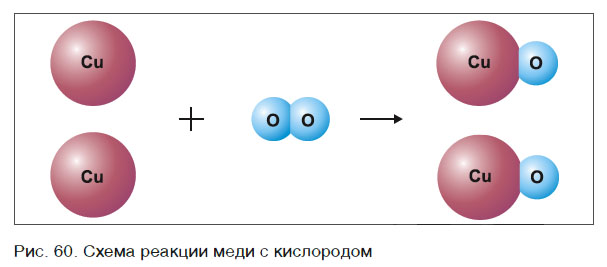
Это уравнение читается так: два купрум плюс о-два равно два купрум-о (рис. 60).
Рассмотрим еще один пример химической реакции между веществами СН4 (метан) и кислородом. Составим схему реакции, в которой слева запишем формулы метана и кислорода, а справа — формулы продуктов реакции — воды и соединения углерода с кислородом (углекислый газ):
Обратите внимание, что в левой части схемы число атомов углерода равно их числу в правой части. Поэтому уравнивать нужно числа атомов водорода и кислорода. Чтобы уравнять число атомов водорода, поставим перед формулой воды коэффициент 2:
Теперь число атомов водорода справа стало 2×2=4 и слева — также четыре. Далее посчитаем число атомов кислорода в правой части схемы: два атома кислорода в молекуле углекислого газа (1×2=2) и два атома кислорода в двух молекулах воды (2×1=2), суммарно 2+2=4. В левой части схемы кислорода только два атома в молекуле кислорода. Для того чтобы уравнять число атомов кислорода, поставим коэффициент 2 перед формулой кислорода:
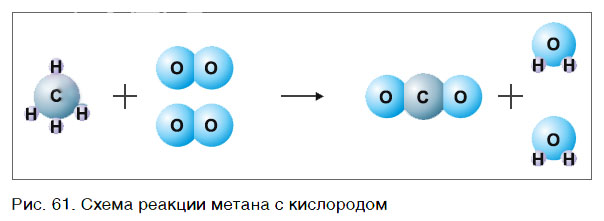
В результате проведенных действий число атомов всех химических элементов до реакции равно их числу после реакции. Уравнение составлено. Читается оно так: це-аш-четыре плюс два о-два равно це-о-два плюс два аш-два-о (рис. 61).
Данный способ расстановки коэффициентов называют методом подбора.
В химии существуют и другие методы уравнивания чисел атомов элементов в левой и правой частях уравнений реакций, с которыми мы познакомимся позднее.
Краткие выводы урока:
Для составления уравнений химических реакций необходимо соблюдать следующий порядок действий.
- Установить состав исходных веществ и продуктов реакции.
- Записать формулы исходных веществ слева, продуктов реакции — справа.
- Между левой и правой частями уравнения сначала поставить стрелку.
- Расставить коэффициенты, т. е. уравнять числа атомов каждого химического элемента до и после реакции.
- Связать левую и правую части уравнения знаком «=» (равно).
Надеюсь урок 12 «Составление уравнений химических реакций» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.
- Химические уравнения. Составление уравнений химической реакции. 8-й класс
- Презентация к уроку
- Как решать химические уравнения — схемы и примеры решения для разных реакций
- Основные термины и понятия
- Виды химических реакций
- Окислительно-восстановительный процесс
- Классический алгоритм
- Решение методом полуреакций
- Использование онлайн-расчёта
- 🔥 Видео
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Химические уравнения. Составление уравнений химической реакции. 8-й класс
Класс: 8
Презентация к уроку
Цель урока: помочь обучающимся сформировать знания о химическом уравнении как об условной записи химической реакции с помощью химических формул.
- систематизировать ранее изученный материал;
- обучать умению составлять уравнения химических реакций.
- воспитывать коммуникативные навыки (работа в паре, умение слушать и слышать).
- развивать учебно-организационные умения, направленные на выполнение поставленной задачи;
- развивать аналитические навыки мышления.
Тип урока: комбинированный.
Оборудование: компьютер, мультимедийный проектор, экран, оценочные листы, карта рефлексии, “набор химических знаков”, тетрадь с печатной основой, реактивы: гидроксид натрия, хлорид железа(III), спиртовка, держатель, спички, лист ватмана, разноцветные химические знаки.
Презентация урока (приложение 3)
І. Организационный момент.
ІІ. Актуализация знаний и умений.
ІІІ. Мотивация и целеполагание.
ІV. Изучение нового материала:
4.1 реакция горения алюминия в кислороде;
4.2 реакция разложения гидроксида железа (III);
4.3 алгоритм расстановки коэффициентов;
4.4 минута релаксации;
4.5 расставь коэффициенты;
V. Закрепление полученных знаний.
VІ. Подведение итогов урока и выставление оценок.
VІІ. Домашнее задание.
VІІІ. Заключительное слово учителя.
Химическая натура сложной частицы
определяется натурой элементарных
составных частей,
количеством их и
химическим строением.
Д.И.Менделеев
Учитель. Здравствуйте, ребята. Садитесь.
Обратите внимание: у вас на столе лежит тетрадь с печатной основой (Приложение 2), в которой вы сегодня будете работать, и оценочный лист, в нем вы будете фиксировать свои достижения, подпишите его.
| Фамилия и имя обучающегося | |
| Этапы работы | Количество баллов |
| Тест “Физические и химические явления. | |
| Задание “Расставь коэффициенты” | |
| Выходной контроль | |
| Общее количество баллов | |
| Оценка за урок | |
Актуализация знаний и умений.
Учитель. Мы с вами познакомились с физическими и химическими явлениями, химическими реакциями и признаками их протекания. Изучили закон сохранения массы веществ.
Давайте проверим ваши знания. Я предлагаю вам открыть тетради с печатной основой и выполнить задание 1. На выполнение задания вам дается 5 минут.
Тест по теме “Физические и химические явления. Закон сохранения массы веществ”.
1. Чем химические реакции отличаются от физических явлений?
- Изменение формы, агрегатного состояния вещества.
- Образование новых веществ.
- Изменение местоположения.
2. Каковы признаки химической реакции?
- Образование осадка, изменение цвета, выделение газа.
- Намагничивание, испарение, колебание.
- Рост и развитие, движение, размножение.
3. В соответствии с каким законом составляются уравнения химических реакций?
- Закон постоянства состава вещества.
- Закон сохранения массы вещества.
- Периодический закон.
- Закон динамики.
- Закон всемирного тяготения.
4. Закон сохранения массы вещества открыл:
5. Химическим уравнением называют:
- Условную запись химической реакции.
- Условную запись состава вещества.
- Запись условия химической задачи.
Учитель. Вы выполнили работу. Я предлагаю вам осуществить ее проверку. Поменяйтесь тетрадями и осуществите взаимопроверку. Внимание на экран. За каждый правильный ответ – 1 балл. Общее количество баллов занесите в оценочные листы.
Мотивация и целеполагание.
Учитель. Используя эти знания, мы сегодня будем составлять уравнения химических реакций, раскрывая проблему “Является ли закон сохранения массы веществ основой для составления уравнений химических реакций”
Изучение нового материала.
Учитель. Мы привыкли считать, что уравнение-это математический пример, где есть неизвестное, и это неизвестное нужно вычислить. А вот в химических уравнениях обычно ничего неизвестного не бывает: в них просто записывается все формулами: какие вещества вступают в реакцию и какие получаются в ходе этой реакции. Посмотрим опыт.
(Реакция соединения серы и железа.) Приложение 3
Учитель. С точки зрения массы веществ, уравнение реакции соединения железа и серы понимается следующим образом
Железо + сера → сульфид железа (II ) (задание 2 тпо)
Но в химии слова отражаются химическими знаками. Запишите это уравнение химическими символами.
(Один ученик пишет на доске, остальные в ТПО.)
Учитель. Теперь прочитайте.
Обучающиеся. Молекула железа взаимодействует с молекулой серы, получается одна молекула сульфида железа (II).
Учитель. В данной реакции мы видим, что количество исходных веществ равно количеству веществ в продукте реакции.
Всегда надо помнить, что при составлении уравнений реакций ни один атом не должен потеряться или неожиданно появиться. Поэтому иногда, записав все формулы в уравнении реакции, приходиться уравнивать число атомов в каждой части уравнения – расставлять коэффициенты. Посмотрим еще один опыт
(Горение алюминия в кислороде.) Приложение 4
Учитель. Запишем уравнение химической реакции (задание 3 в ТПО)
Чтобы записать правильно формулу оксида, вспомним что
Обучающиеся. Кислород в оксидах имеет степень окисления -2, алюминий – химический элемент с постоянной степенью окисления +3. НОК = 6
Учитель. Мы видим, что в реакцию вступает 1 атом алюминия, образуется два атома алюминия. Вступает два атома кислорода, образуется три атома кислорода.
Просто и красиво, но неуважительно по отношению к закону сохранения массы веществ – она разная до и после реакции.
Поэтому нам необходимо расставить коэффициенты в данном уравнении химической реакции. Для этого найдем НОК для кислорода.
Обучающиеся. НОК = 6
Учитель. Перед формулами кислорода и оксида алюминия ставим коэффициенты, чтобы число атомов кислорода слева и справа было равно 6.
Учитель. Теперь получаем, что в результате реакции образуется четыре атома алюминия. Следовательно, перед атомом алюминия в левой части ставим коэффициент 4
Еще раз пересчитаем все атомы до реакции и после нее. Ставим равно.
Учитель. Рассмотрим еще один пример
(Учитель демонстрирует опыт по разложению гидроксида железа (III).)
Учитель. Расставим коэффициенты. В реакцию вступает 1 атом железа, образуется два атома железа. Следовательно, перед формулой гидроксида железа (3) ставим коэффициент 2.
Учитель. Получаем, что в реакцию вступает 6 атомов водорода (2х3), образуется 2 атома водорода.
Обучающиеся. НОК =6. 6/2 = 3. Следовательно, у формулы воды ставим коэффициент 3
Учитель. Считаем кислород.
Обучающиеся. Слева – 2х3 =6; справа – 3+3 = 6
Обучающиеся. Количество атомов кислорода ,вступивших в реакцию, равно количеству атомов кислорода, образовавшихся в ходе реакции. Можно ставить равно.
Учитель. Теперь давайте обобщим все сказанное ранее и познакомимся с алгоритмом расстановки коэффициентов в уравнениях химических реакций.
- Подсчитать количество атомов каждого элемента в правой и левой части уравнения химической реакции.
- Определить, у какого элемента количество атомов меняется, найти НОК.
- Разделить НОК на индексы – получить коэффициенты. Поставить их перед формулами.
- Пересчитать количество атомов, при необходимости действие повторить.
- Последним проверить количество атомов кислорода.
Учитель. Вы хорошо потрудились и , наверное, устали. Я предлагаю вам расслабиться, закрыть глаза и вспомнить какие-либо приятные моменты жизни. У каждого из вас они разные. Теперь откройте глаза и сделайте круговые движения ими сначала по часовой стрелке, затем – против. Теперь интенсивно подвигайте глазами по горизонтали: направо – налево, и вертикали: вверх – вниз.
А сейчас активизируем мыслительную деятельность и помассируем мочки ушей.
Учитель. Продолжаем работу.
В тетрадях с печатной основой выполним задание 5. Работать вы будете в парах. Вам необходимо расставить коэффициенты в уравнених химических реакций. На выполнение задания дается 10 минут.
Учитель. Проверим выполнение задания (учитель опрашивает и выводит на слайд правильные ответы). За каждый правильно поставленный коэффициент – 1 балл.
С заданием вы справились. Молодцы!
Учитель. Теперь давайте вернемся к нашей проблемы.
Ребята, как вы считаете, является ли закон сохранения массы веществ основой для составления уравнений химических реакций.
Обучающиеся. Да, в ходе урока мы доказали, что закон сохранения массы веществ – основа для составления уравнений химических реакций.
Учитель. Все основные вопросы мы изучили. Теперь выполним небольшой тест, который позволит увидеть, как вы освоили тему. Вы должны на него отвечать только “да” или “нет”. На работу дается 3 минуты.
- В реакции Ca + Cl2→ CaCl2 коэффициенты не нужны.(Да)
- В реакции Zn + HCl → ZnCl2 + H2 коэффициент у цинка 2.(Нет)
- В реакции Ca + O2 → CaO коэффициент у оксида кальция 2.(Да)
- В реакции CH4 → C + H2 коэффициенты не нужны.(Нет)
- В реакции CuO + H2 → Cu + H2O коэффициент у меди 2.(Нет)
- В реакции C + O2 → CO коэффициент 2 надо поставить и у оксида углерода (II) , и у углерода.(Да)
- В реакции CuCl2 + Fe → Cu + FeCl2 коэффициенты не нужны.(Да)
Учитель. Проверим выполнение работы. За каждый правильный ответ – 1 балл.
Учитель. Вы справились хорошо с заданием. Сейчас подсчитайте общее количество набранных баллов за урок и поставьте себе оценку согласно рейтингу, который вы видите на экране. Сдайте мне оценочные листы для выставления вашей оценки в журнал.
Учитель. Наш урок подошел к концу, в ходе которого мы смогли доказать, что закон сохранения массы веществ является основой для составления уравнений реакций, и научились составлять уравнения химических реакций. И, как финальная точка, запишите домашнее задание
§ 27, упр. 1 – для тех, кто получил оценку “3”
упр. 2– для тех, кто получил оценку “4”
упр. 3 – для тех, кто получил оценку “5”
Заключительное слово учителя.
Учитель. Я благодарю вас за урок. Но прежде чем вы покинете кабинет, обратите внимание на таблицу (учитель показывает на лист ватмана с изображением таблицы и разноцветными химическими знаками). Вы видите химические знаки разного цвета. Каждый цвет символизирует ваше настроение.. Я предлагаю вам составить свою таблицу химических элементов (она будет отличаться от ПСХЭ Д.И.Менделеева) – таблицу настроения урока. Для этого вы должны подойти к нотному листу, взять один химический элемент, согласно той характеристике, которую вы видите на экране, и прикрепить в ячейку таблицы. Я сделаю это первой, показав вам свою комфортность от работы с вами.
F Мне было на уроке комфортно, я получил ответ на все интересующие меня вопросы.
F На уроке я достиг цели наполовину.
F Мне на уроке было скучно, я ничего не узнал нового .
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Как решать химические уравнения — схемы и примеры решения для разных реакций
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Основные термины и понятия
Составление уравнений химических реакций невозможно без знания определённых обозначений, показывающих, как проходит реакция. Объединение атомов, имеющих одинаковый ядерный заряд, называют химическим элементом. Ядро атома состоит из протонов и нейтронов. Первые совпадают с числом атомного номера элемента, а значение вторых может варьироваться. Простейшими веществами называют элементы, состоящие из однотипных атомов.
Любой химический элемент описывается с помощью символов, условно обозначающих структуру веществ. Формулы являются неотъемлемой частью языка науки. Именно на их основе составляют уравнения и схемы. По своей сути они отражают количественный и качественный состав элементов. Например, запись HNO3 сообщает, что в соединении содержится одна молекула азотной кислоты, а оно само состоит из водорода, азота и кислорода. При этом в состав одного моля азотной кислоты входит по одному атому водорода и азота и 3 кислорода.
Символика элементов, условное обозначение, представляет собой химический язык. В значке содержится информация о названии, массовом числе и порядковом номере. Международное обозначение принято, согласно периодической таблице Менделеева, разработанной в начале 1870 года.
Взаимодействующие между собой вещества называются реагентами, а образующиеся в процессе реакции — продуктами. Составление и решение химических уравнений фактически сводится к определению результатов реакций, поэтому просто знать формулы веществ мало, нужно ещё уметь подбирать коэффициенты. Располагаются они перед формулой и указывают на количество молекул или атомов, принимающих участие в процессе. С правой стороны от химического вещества ставится индекс, указывающий место элемента в системе.
Записывают уравнения в виде цепочки, в которой указываются все стадии превращения вещества начиная с левой части. Вначале пишут формулы элементов в исходном состоянии, а затем последовательно их преобразование.
Видео:8 класс. Составление уравнений химических реакций.Скачать

Виды химических реакций
Химические явления характеризуются тем, что из двух и более элементов образуются новые вещества. Уравнения описывают эти процессы. Впервые с объяснениями протекания реакций знакомят в восьмом классе средней образовательной школы на уроках неорганической химии. Ученикам демонстрируют опыты, в которых явно наблюдаются различия в протекании реакций.
Всего существует 4 типа химического взаимодействия веществ:
- Соединение. В реакцию могут вступать 2 простых вещества: металл и неметалл или неметалл и неметалл. Например, алюминий с серой образуют сульфид алюминия. Кислород, взаимодействуя с водородом, превращается в воду. Объединятся могут 2 оксида с растворимым основанием, как оксид кальция с водой: CaO + H2O = Ca (OH)2 или основной оксид с кислотным: CaO + SO3 = CaSO4.
- Разложение. Это процесс обратный реакции соединения: было одно вещество, а стало несколько. Например, при пропускании электрического тока через воду получается водород и кислород, а при нагревании известняка 2 оксида: CaCO3 = CaO + CO2.
- Замещение. В реакцию вступают 2 элемента. Один из них простой, а второй сложный. В итоге образуются 2 новых соединения, при котором атом простого вещества заменяет сложный, как бы вытесняя его. Условие протекания процесса: простое вещество должно быть более активным, чем сложное. Например, Zn + 2HCl = ZnCl2 + H2. Величину активности можно узнать из таблицы ряда электрохимических напряжений.
- Обмен. В этом случае между собой реагируют 2 сложных элемента, обменивающиеся своими составными частями. Условием осуществления такого типа реакции является обязательное образование воды, газа или осадка. Например, CuO + 2HCl = CuCl2 + H2O. Чтобы узнать, смогут ли вещества прореагировать, используют таблицу растворимости.
Основными признаками химических реакций является изменение цвета, выделение газа или образование осадка. Различают их по числу веществ, вступивших в реакцию и образовавшихся продуктов. Правильное определение типа реакции особо важно при составлении химических уравнений, а также определения свойств и возможностей веществ.
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Окислительно-восстановительный процесс
Составление большинства реакций сводится к подбору коэффициентов. Но при этом могут возникнуть трудности с установлением равновесия, согласно закону сохранения массы веществ. Чаще всего такая ситуация возникает при решении заданий, связанных с расстановкой количества атомов в уравнениях окислительно-восстановительных процессов.
Под ними принято понимать превращения, протекающие с изменением степени окисления элементов. При окислении происходит процесс передачи атомом электронов, сопровождающийся приобретением им положительного заряда или ионом, после чего он становится нейтральным. При этом также происходит процесс восстановления, связанный с присоединением элементарных частиц атомом.
Для составления уравнений необходимо определить восстановитель, окислитель и число участвующих в реакции электронов. Коэффициенты же подбирают с помощью метода электронно-ионного баланса (полуреакций). Его суть состоит в установлении равенства путём уравнивания количества электронов, отдаваемых одним элементом и принимаемым другим.
Видео:ХИМИЧЕСКИЕ УРАВНЕНИЯ | Как составлять уравнения реакций | Химия 8 классСкачать

Классический алгоритм
В основе решения задач этим методом — закон сохранения массы. Согласно ему, совокупная масса элементов до реакции и после остаётся неизменной. Другими словами, происходит перегруппировка частиц. Если рассматривать решение химического уравнения поэтапно, оно будет состоять из трёх шагов:
- Написания формул элементов, вступающих в реакцию с левой стороны.
- Указания справа формулы образующихся веществ.
- Уравнивания числа атомов с добавлением коэффициентов.
Перед тем как переходить к сложным соединениям, лучше всего потренироваться на простых. Например, нужно составить уравнение, описывающее взаимодействие двух сложных веществ: гидроксида натрия и серной кислоты. При таком соединении образуется сульфат натрия и вода.
Согласно алгоритму, в левой части уравнения необходимо записать реагенты, а в правой продукты реакции: NaOH + H2SO 4 → Na 2SO4 + H2O. Теперь следует уравнять коэффициенты. Начинают с первого элемента. В примере это натрий. В правой части содержится 2 его атома, а в левой один, поэтому необходимо возле реагента поставить цифру 2. Затем нужно уровнять водород. В результате получится выражение: 2 NaOH + H2SO 4 → Na2 SO4 +2H2O.
Ещё одним наглядным примером является процесс реакции тринитротолуола с кислородом. При их взаимодействии образуется: C7H5N3O6 + O2 → CO2 + H2O + N2. Исходя из того, что слева находится нечётное число атомов H и N, а справа чётное, нужно их уравнять: 2C7H5N3O6 + O2 → CO2 + H2O + N2.
Теперь становится понятным, что 14 и 10 атомов углерода и водорода должны образовать 14 долей диоксида и 5 молекул воды. При этом 6 атомов азота превратятся в 3. Итоговое уравнение будет выглядеть как 2C7H5N3O6 + 10,5O2 → 14CO2 + 5H2O + 3N2.
Перед тем как начинать тренировку по составлению уравнений, следует научиться расставлять валентность. Это параметр, равный числу соединившихся атомов каждого элемента. Фактически это способность к соединению. Например, в формуле NH3 валентность атома азота равна 3, а водорода 1.
Видео:Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Решение методом полуреакций
Алгоритм для решения примеров химических уравнений проще рассмотреть на конкретном задании. Пускай необходимо описать процесс окисления пирита азотной кислоты с малой концентрацией: FeS2 + HNO3. Решать этот пример необходимо в следующей последовательности:
- Определить продукты реакции. Так как кислота является сильным окислителем, сера получит максимальную степень оксидации S6+, а железо Fe3+. HNO3 может восстановиться до одного из двух состояний NO2 или NO.
- Исходя из состава ионов и правила, что вещества, переходящие в газовую форму или плохо растворимые, записываются в молекулярном виде, верным будет записать: FeS2 — Fe3+ + 2SO2−4. Гидролизом можно пренебречь.
- В записи уравнивают кислород. Для этого в левую часть добавляют 8 молекул воды, а в правую 16 ионов водорода: FeS2 + 8H20 — Fe3+ + 2SO2−4 + 16H+. Так как заряда в левой части нет, а в правой он равный +15, то серное железо должно будет отдать 15 электронов. Значит, уравнение примет вид: FeS2 + 8H20 — 15e → Fe3+ + 2SO2−4 + 16H+.
- Теперь переходят к реакции восстановления нитрата иона: NO-3 →NO. Для её составления нужно отнять у оксида азота 2 атома кислорода. Делают это путём прибавления к левой части 4 ионов водорода, а правой — 2 молекул воды. В итоге получится: NO-3 + 4H+ → NO + 2H2O.
- Полученную формулу уравнивают добавлением к левой части 3 электронов: NO-3 + 4H+ 3e → NO + 2H2O.
- Объединяют найденные выражения и записывают результат: FeS2 + 8H20 + 5NO-3 + 20H+ → Fe3+ + 2SO2−4 + 16H+ + 5NO + 10H2O.
Уравнение можно сократить на 16H + и 8H2O. В итоге получится сокращённое выражение окислительно-восстановительной реакции: FeS2 + 5NO — 3 + 4 H + = Fe3 + + 2SO 2- 4 + 5NO + 2H2O.
Такой алгоритм считается классическим, но для упрощения понимания лучше использовать способ электронного баланса. Процесс восстановления переписывают как N5+ + 3e → N2+. Степень же окисления составить сложнее. Сере нужно приписать степень 2+ и учесть, что на 1 атом железа приходится 2 атома серы: FeS2 → Fe3++ 2S6+. Запись общего баланса будет выглядеть: FeS2 + 5N5+ = Fe3+ + 2S6+ + 5N2+.
Пять молекул потратятся на окисление серного железа, а ещё 3 на образование Fe (NO3)3. После уравнения двух сторон запись реакции примет вид, аналогичный полученному с использованием предыдущего метода.
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Использование онлайн-расчёта
Простые уравнения решать самостоятельно довольно просто. Но состоящие из сложных веществ могут вызвать трудности даже у опытных химиков. Чтобы получить точную формулу и не подбирать вручную коэффициенты, можно воспользоваться онлайн-калькуляторами. При этом их использовать сможет даже пользователь, не особо разбирающийся в науке.
Чтобы расстановка коэффициентов в химических уравнениях онлайн происходила автоматически, нужно лишь подключение к интернету и исходные данные. Система самостоятельно вычислит продукты реакции и уравняет обе стороны формулы. Интересной особенностью таких сайтов является не только быстрый и правильный расчёт, но и описание правил с алгоритмами, по которому выполняются действия.
После загрузки калькулятора в веб-обозревателе единственное, что требуется от пользователя — правильно ввести реагенты в специальные формы латинскими буквами и нажать кнопку «Уравнять». Иногда возникает ситуация, когда запись сделана верно, но коэффициенты не расставляются. Это происходит, если суммы в уравнении могут быть подсчитаны разными способами. Характерно это для реакций окисления. В таком случае нужно заменить фрагменты молекул на любой произвольный символ. Таким способом можно не только рассчитать непонятное уравнение, но и выполнить проверку своих вычислений.
🔥 Видео
Типы химических реакций. 1 часть. 8 класс.Скачать

Уравнения химический реакций на ОГЭ: как составлять без ошибок?Скачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать

Интенсив к РЭ Максвелла для 7-8 классов | Гидростатика и сила АрхимедаСкачать

Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать

ХИМИЧЕСКИЕ УРАВНЕНИЯ - Топ 5 Ошибок в уравнениях химических реакций // Подготовка к ЕГЭ по ХимииСкачать

СЕКРЕТНЫЙ СПОСОБ — Как составлять химические уравнения? Химия 8 класс #shorts #youtubeshortsСкачать

Составление уравнений реакций. 1 часть. 8 класс.Скачать

Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

Реакции соединения 8 классСкачать

8 класс. Химия. Как расставить коэффициенты в уравнении?Скачать