- Серная кислота
- Строение молекулы и физические свойства
- Способы получения
- Химические свойства
- Серная кислота
- Химическая технология серной кислоты
- Значение и применение серной кислоты
- Свойства серной кислоты
- Сырьевые источники для производства серной кислоты
- Промышленные сорта серной кислоты
- Способы получения серной кислоты
- Основные стадии производства серной кислоты
- Получение диоксида серы SO2
- Получение SO2 из флотационного колчедана
- Основные стадии получения диоксида серы
- Физико-химические основы процесса обжига флотационного колчедана
- Очистка обжигового газа от пыли
- Специальная тонкая очистка печного газа
- Осушка обжигового газа
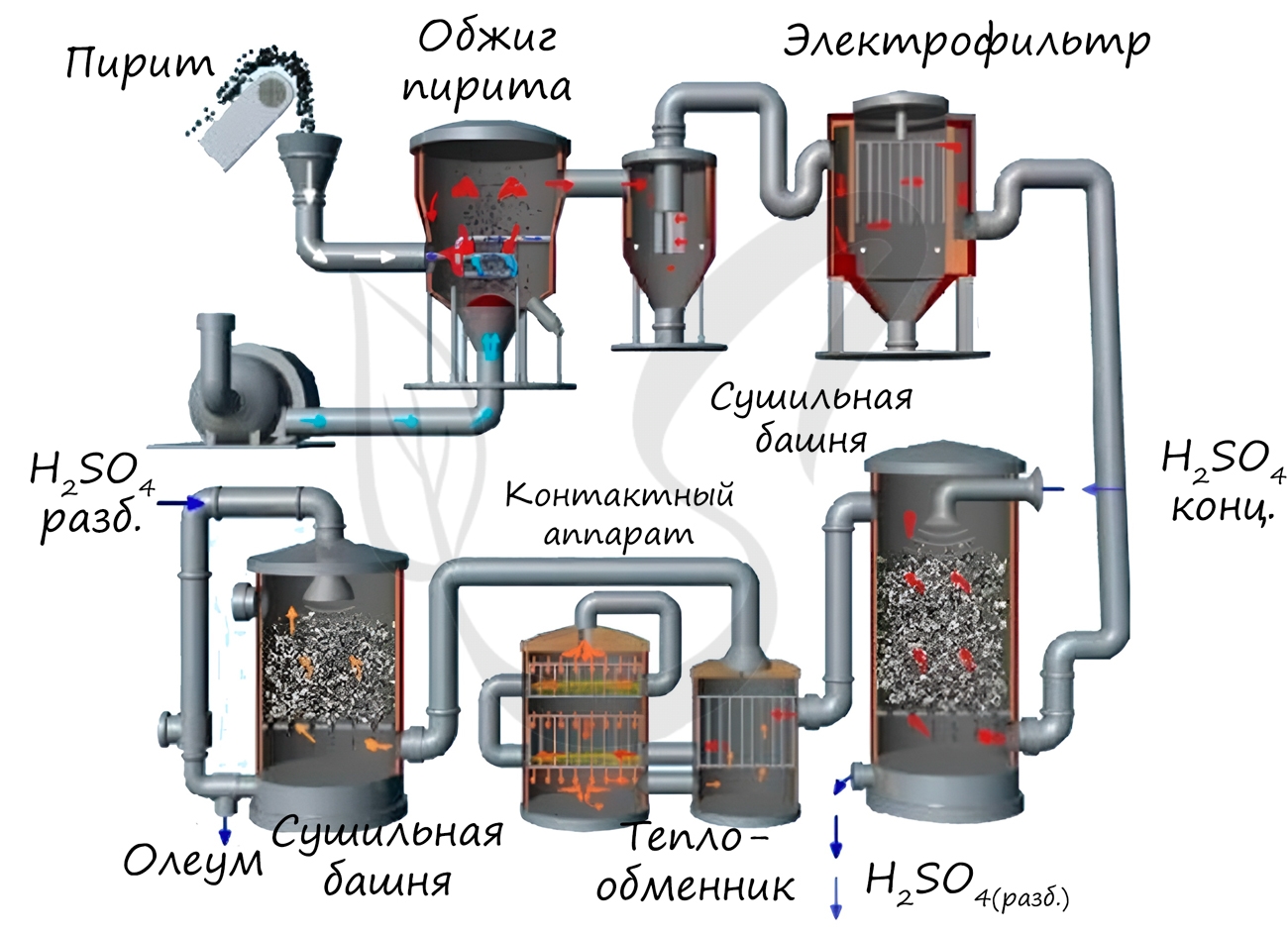
- Принципиальная схема производства серной кислоты из железного колчедана
- 📹 Видео
Серная кислота
Строение молекулы и физические свойства
Серная кислота H2SO4 – это сильная кислота, двухосновная, прочная и нелетучая. При обычных условиях серная кислота – тяжелая маслянистая жидкость, хорошо растворимая в воде.
Растворение серной кислоты в воде сопровождается выделением значительного количества кислоты. Поэтому по правилам безопасности в лаборатории при смешивании серной кислоты и воды мы добавляем серную кислоту в воду небольшими порциями при постоянном перемешивании.
Валентность серы в серной кислоте равна VI.
Способы получения
1. Серную кислоту в промышленности производят из серы, сульфидов металлов, сероводорода и др. Один из вариантов — производство серной кислоты из пирита FeS2.
Основные стадии получения серной кислоты :
- Сжигание или обжиг серосодержащего сырья в кислороде с получением сернистого газа.
- Очистка полученного газа от примесей.
- Окисление сернистого газа в серный ангидрид.
- Взаимодействие серного ангидрида с водой.
Рассмотрим основные аппараты, используемые при производстве серной кислоты из пирита (контактный метод):
| Аппарат | Назначение и уравнения реакций |
| Печь для обжига | 4FeS2 + 11O2 → 2Fe2O3 + 8SO2 + Q Измельченный очищенный пирит сверху засыпают в печь для обжига в «кипящем слое». Снизу (принцип противотока) пропускают воздух, обогащенный кислородом, для более полного обжига пирита. Температура в печи для обжига достигает 800 о С |
| Циклон | Из печи выходит печной газ, который состоит из SO2, кислорода, паров воды и мельчайших частиц оксида железа. Такой печной газ очищают от примесей. Очистку печного газа проводят в два этапа. Первый этап — очистка газа в циклоне. При этом за счет центробежной силы твердые частички ссыпаются вниз. |
| Электрофильтр | Второй этап очистки газа проводится в электрофильтрах. При этом используется электростатическое притяжение, частицы огарка прилипают к наэлектризованным пластинам электрофильтра). |
| Сушильная башня | Осушку печного газа проводят в сушильной башне – снизу вверх поднимается печной газ, а сверху вниз льется концентрированная серная кислота. |
| Теплообменник | Очищенный обжиговый газ перед поступлением в контактный аппарат нагревают за счет теплоты газов, выходящих из контактного аппарата. |
| Контактный аппарат | 2SO2 + O2 ↔ 2SO3 + Q В контактном аппарате производится окисление сернистого газа до серного ангидрида. Процесс является обратимым. Поэтому необходимо выбрать оптимальные условия протекания прямой реакции (получения SO3):
Как только смесь оксида серы и кислорода достигнет слоев катализатора, начинается процесс окисления SO2 в SO3. Образовавшийся оксид серы SO3 выходит из контактного аппарата и через теплообменник попадает в поглотительную башню. |
| Поглотительная башня | Получение H2SO4 протекает в поглотительной башне. Однако, если для поглощения оксида серы использовать воду, то образуется серная кислота в виде тумана, состоящего из мельчайших капелек серной кислоты. Для того, чтобы не образовывался сернокислотный туман, используют 98%-ную концентрированную серную кислоту. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H2SO4·nSO3. Образовавшийся олеум сливают в металлические резервуары и отправляют на склад. Затем олеумом заполняют цистерны, формируют железнодорожные составы и отправляют потребителю. |
Общие научные принципы химического производства:
- Непрерывность.
- Противоток
- Катализ
- Увеличение площади соприкосновения реагирующих веществ.
- Теплообмен
- Рациональное использование сырья
Химические свойства
Серная кислота – это сильная двухосновная кислота .
1. Серная кислота практически полностью диссоциирует в разбавленном в растворе по первой ступени:
По второй ступени серная кислота диссоциирует частично, ведет себя, как кислота средней силы:
HSO4 – ⇄ H + + SO4 2–
2. Серная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например , серная кислота взаимодействует с оксидом магния:
Еще пример : при взаимодействии серной кислоты с гидроксидом калия образуются сульфаты или гидросульфаты:
Серная кислота взаимодействует с амфотерным гидроксидом алюминия:
3. Серная кислота вытесняет более слабые из солей в растворе (карбонаты, сульфиды и др.). Также серная кислота вытесняет летучие кислоты из их солей (кроме солей HBr и HI).
Например , серная кислота взаимодействует с гидрокарбонатом натрия:
Или с силикатом натрия:
Концентрированная серная кислота реагирует с твердым нитратом натрия. При этом менее летучая серная кислота вытесняет азотную кислоту:
Аналогично – концентрированная серная кислота вытесняет хлороводород из твердых хлоридов, например , хлорида натрия:
4. Т акже серная кислота вступает в обменные реакции с солями.
Например , серная кислота взаимодействует с хлоридом бария:
5. Разбавленная серная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Например , серная кислота реагирует с железом. При этом образуется сульфат железа (II):
Серная кислота взаимодействует с аммиаком с образованием солей аммония:
Концентрированная серная кислота является сильным окислителем . При этом она обычно восстанавливается до сернистого газа SO2. С активными металлами может восстанавливаться до серы S, или сероводорода Н2S.
Железо Fe, алюминий Al, хром Cr пассивируются концентрированной серной кислотой на холоде. При нагревании реакция возможна.
При взаимодействии с неактивными металлами концентрированная серная кислота восстанавливается до сернистого газа:
При взаимодействии с щелочноземельными металлами и магнием концентрированная серная кислота восстанавливается до серы:
При взаимодействии с щелочными металлами и цинком концентрированная серная кислота восстанавливается до сероводорода:
6. Качественная реакция на сульфат-ионы – взаимодействие с растворимыми солями бария. При этом образуется белый кристаллический осадок сульфата бария:
Видеоопыт взаимодействия хлорида бария и сульфата натрия в растворе (качественная реакция на сульфат-ион) можно посмотреть здесь.
7. Окислительные свойства концентрированной серной кислоты проявляются и при взаимодействии с неметаллами.
Например , концентрированная серная кислота окисляет фосфор, углерод, серу. При этом серная кислота восстанавливается до оксида серы (IV):
Уже при комнатной температуре концентрированная серная кислота окисляет галогеноводороды и сероводород:
Видео:Концентрированная серная кислота. Получаем. Измеряем. Храним.Скачать

Серная кислота
Серная кислота — сильная двухосновная кислота, при н.у. маслянистая жидкость без цвета и запаха.
Обладает выраженным дегидратационным (водоотнимающим) действием. При попадании на кожу или слизистые оболочки приводит к тяжелым ожогам.
Замечу, что существует олеум — раствор SO3 в безводной серной кислоте, дымящее жидкое или твердое вещество. Олеум применяется при изготовлении красителей, органическом синтезе и в производстве серной кислот.
Получение
Известны несколько способов получения серной кислоты. Применяется промышленный (контактный) способ, основанный на сжигании пирита, окислении образовавшегося SO2 до SO3 и последующим взаимодействием с водой.
Нитрозный способ получения основан на взаимодействии сернистого газа с диоксидом азота IV в присутствии воды. Он состоит из нескольких этапов:
В окислительной башне смешивают оксиды азота (II) и (IV) с воздухом:
Смесь газов подается в башни, орошаемые 75-ной% серной кислотой, здесь смесь оксидов азота поглощается с образованием нитрозилсерной кислоты:
В ходе гидролиза нитрозилсерной кислоты получают азотистую кислоту и серную:
В упрощенном виде нитрозный способ можно записать так:
Химические свойства
- Кислотные свойства
В водном растворе диссоциирует ступенчато.
Сильная кислота. Реагирует с основными оксидами, основаниями, образуя соли — сульфаты.
KOH + H2SO4 = KHSO4 + H2O (гидросульфат калия, соотношение 1:1 — кислая соль)
2KOH + H2SO4 = K2SO4 + 2H2O (сульфат калия, соотношение 2:1 — средняя соль)
С солями реакция идет, если в результате выпадает осадок, образуется газ или слабый электролит (вода). Серная кислота, как и многие другие кислоты, способна растворять осадки.
Серная кислота окисляет неметаллы — серу и углерод — соответственно до угольной кислоты (нестойкой) и сернистого газа.
Реакции с металлами
Реакции разбавленной серной кислоты с металлами не составляют никаких трудностей: она реагирует как самая обычная кислота, например HCl. Все металлы, стоящие до водорода, вытесняют из серной кислоты водород, а стоящие после — не реагируют с ней.
Подчеркну, что реакции разбавленной серной кислоты с железом и хромом не сопровождаются переходом этих элементов в максимальную степень окисления. Они окисляются до +2.
Cu + H2SO4(разб.) ⇸ (реакция не идет, медь не может вытеснить водород из кислоты)
Концентрированная серная кислота ведет себя совершенно по-иному. Водород никогда не выделяется, вместо него с активными металлами выделяется H2S, с металлами средней активности — S, с малоактивными металлами — SO2.
Холодная концентрированная серная кислота пассивирует Al, Cr, Fe, Ni, Be, Co. При нагревании или амальгамировании данных металлов реакция идет.
Обратите особое внимание, что при реакции железа, хрома с концентрированной серной кислотой достигается степень окисления +3. В подобных реакциях с разбавленной серной кислотой (написаны выше) достигается степень окисления +2.
Иногда в тексте задания даны подсказки. Например, если написано, что выделился газ с неприятным запахом тухлых яиц — речь идет об H2S, если же написано, что выделилось простое вещество — речь о сере (S).
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Видео:Учебный фильм о производстве серной кислотыСкачать
Химическая технология серной кислоты
1.1. Значение и применение серной кислоты.
1.2. Свойства серной кислоты.
1.3. Сырьевые источники.
1.4. Промышленные сорта серной кислоты.
1.5. Способы получения серной кислоты.
- Производство серной кислоты.
2.1. Основные стадии производства серной кислоты.
2.2. Получение диоксида серы SO2.
- Получение SO2 из флотационного колчедана.
3.1. Основные стадии получения диоксида серы..
3.2. Физико-химические основы обжига пирита.
3.3. Очистка обжигового газа от пыли.
3.4. Специальная (тонкая) очистка обжигового газа.
3.6. Принципиальная схема производства.
Значение и применение серной кислоты
Серная кислота – это один из самых крупнотоннажных продуктов промышленного производства. Серной кислоты получают больше, чем азотной, соляной, уксусной и других кислот вместе взятых.
Во всём мире более полутора тысяч установок серной кислоты и производят они около 160 млн. т серной кислоты.
Серная кислота применяется практически во всех отраслях промышленности. Наибольшее её количество расходуется на следующие производства:
- минеральные удобрения (40 – 50%)
- взрывчатые вещества
- минеральные кислоты и соли.
- для очистки нефтепродуктов
- в металлообработке
- в производстве органических соединений
- красителей
- химических волокон и т.д.
Крупными производителями серной кислоты являются Япония и Германия.
Свойства серной кислоты
Большое разнообразие областей применения связано с комплексом её свойств. Серная кислота самая дешевая из кислот, она не дымит, не имеет запаха. При обычных условиях это жидкость. В концентрированном состоянии она не способна разрушать черные металлы, что удобно для её использования и транспортировки.
В технике под «серной кислотой» подразумеваются любые смеси триоксида серы с водой:
При m = n = 1 получается моногидрат, или 100%-я H2SO4 (плотность 1850 т/м 3 или 1,85 г/см 3 или 1850 кг/дм 3 ).
Если m n, то – олеум.
Изучите диаграммы состояния «состав – свойства» (Рис. 15 и 16).
На рисунке (Рис.15) представлена диаграмма кристаллизации системы H2O – SO3.
Часть диаграммы (слева) представляет зависимость температуры кристаллизации серной кислоты от её концентрации, другая часть (справа) представляет зависимость температуры кристаллизации олеума от содержания в нём триоксида серы.
Из рисунка видно, что на кривой имеется несколько экстремумов. Наличие максимумов свидетельствует о том, что с водой триоксид серы образует ряд соединений. Каждая максимальная точка соответствуют определённому соединению. Точки минимумов показывают, при каком соотношении H2O и SO3 имеет место минимальная температура замерзания смеси.
С учётом этих данных товарные сорта серной кислоты и олеума производят в виде эвтектических смесей, имеющих меньшую температуру кристаллизации. Благодаря этому уменьшается вероятность замерзания готового продукта при снижении температуры в условиях производства, хранения и транспортировки.
Чтобы уменьшить возможность кристаллизации серной кислоты при перевозке и хранении, товарные сорта должны иметь такую концентрацию, которая соответствует достаточно низкой температуре её кристаллизации (левая часть диаграммы). Так, башенная кислота (75% H2SO4) имеет температуру замерзания (–41ºС), а контактная кислота (92,5% H2SO4) имеет температуру замерзания (–35 ºС).
Аналогично выбирают товарные сорта олеума (правая часть диаграммы). Так 20%-й олеум имеет температуру кристаллизации (–11ºС), а 65%-й олеум имеет (–0,35ºС).
Эти данные имеют большое практическое значение, так как во многих процессах и в производстве самой серной кислоты используется серная кислота различной концентрации. Кроме того, необходимо учитывать, что поскольку оборудование цехов в большинстве случаев размещено на открытой площадке, имеется опасность кристаллизации серной кислоты.
Температура кипения серной кислоты также зависит от её концентрации. На рисунке (Рис. 16) представлена диаграмма кипения раствора серной кислоты (левая часть диаграммы) и олеума (правая часть диаграммы).
Из рисунка видно, что смесь, содержащая 98,3% H2SO4, является азеотропной (состав её жидкой и паровой фаз одинаковый). При небольших отклонениях концентрации серной кислоты от азеотропной точки, состав её жидкой и газовой фаз значительно отличается.
Серная кислота является сильным окислителем.
Концентрированная и разбавленная кислоты с металлами взаимодействует по-разному.
Концентрированная серная кислота пассивирует некоторые металлы.
При повышенных температурах пары серной кислоты диссоциируют
а выше 400 ºС диссоциация почти полная.
При дальнейшем нагревании триоксид серы разлагается по реакции
а при температуре выше 1000 ºС – почти полностью, что используется для получения серной кислоты из отработанной.
Сырьевые источники для производства серной кислоты
Сырьём для производства серной кислоты служат сульфидные руды. Например, используется пирит (FeS2), или серный колчедан (флотационный колчедан). Содержание серы в нём от 40 до 54%. В нашей стране только 1/4 всего объёма серной кислоты вырабатывается из флотационного колчедана. Сульфидные руды, содержащие медь, цинк и др., также могут быть сырьём.
Сера. Используется либо самородная сера, либо сера, полученная из природных газов, а также полученная в процессе нефтепереработки.
Сероводород. Используют сероводород, выделяемый как побочный продукт в нефтехимической и нефтегазоперерабатывающих отраслях. Производство серной кислоты из сероводорода называется методом «мокрого катализа».
Кислые гудроны (или отработанная серная кислота).
Природные сульфаты – гипс (CaSO4·2H2O), ангидрит (CaSO4).
Промышленные сорта серной кислоты
В нашей стране выпускают серную кислоту следующих сортов:
- техническая (купоросное масло), примерно 92,5% H2SO4;
- моногидрат, примерно 98,5% H2SO4;
- олеум, примерно 18,5% свободного SO3 в моногидрате;
- нитрозная или башенная, примерно 75% H2SO4.
Предусматривается также производство специальных сортов серной кислоты (реактивная, аккумуляторная и т.д.).
Способы получения серной кислоты
Серную кислоту получают двумя принципиально отличными способами.
Контактный. Этот способ отличается тем, что стадия окисления SO2 в SO3 осуществляется на твёрдых катализаторах. Получаемая серная кислота отличается высокой концентрацией и чистотой.
Нитрозный. Здесь окисление SO2 в SO3 происходит под действием нитрозы – оксидов азота, поглощенных серной кислотой.
Нитрозный метод возник раньше контактного. Первым был так называемый камерный метод. Он предполагал сжигание серы в смеси с нитратом калия в свинцовых камерах.
Позже свинцовые камеры были заменены башнями, а в качестве сырья стали использовать серный колчедан. Этот метод ещё называют башенным.
В настоящее время нитрозный способ вследствие несовершенства утратил своё значение, так как готовая серная кислота загрязнена примесями и концентрация кислоты не превышает 75%. Поэтому в этом методе требуется очистка и концентрирование готового продукта. Без дополнительной переработки её можно использовать лишь в производстве удобрений.
Основные стадии производства серной кислоты
Серную кислоту получают из различных видов сырья. Общим для каждого вида сырья является то, что сначала получают диоксид серы SO2, затем его окисляют до SO3, после чего при абсорбции водой образуется серная кислота. Кроме того, в производстве обязательна очистка отходящих газов.
Таким образом, можно выделить четыре основных стадии производства серной кислоты:
- получение SO2;
- окисление SO2 с целью получения SO3;
- абсорбция SO3, приводящая к образованию H2SO4;
- очистка отходящих газов.
Получение диоксида серы SO2
Физические свойства диоксида серы SO2. Диоксид серы в обычных условиях – газ. Температура сжижения его равна
(–10)ºС, поэтому диоксид серы может использоваться как хладагент.
Химические свойства. Сера в этом соединении имеет степень окисления (+4), поэтому проявляет как окислительные, так и восстановительные свойства.
Сырьём для получения SO2 являются следующие материалы:
– флотационный колчедан, содержащий пирит
– газы, содержащие сероводород (это природные газы, газы коксохимии, газы цветной металлургии)
– отходящие газ цветной металлургии, содержащие SO2,
– отработанная серная кислота
Диоксид серы применяется для получения серной кислоты.
Видео:Производство серной кислотыСкачать

Получение SO2 из флотационного колчедана
Основные стадии получения диоксида серы
Уравнение химической реакции получения диоксида серы.
Основные процессы (стадии) получения диоксида серы:
- сушка флотационного колчедана;
- обжиг колчедана;
- охлаждение обжигового газа;
- очистка обжигового газа от пыли;
- специальная очистка (промывка);
- осушка газа.
В соответствии с указанной последовательностью самостоятельно составьте принципиальную схему получения диоксида серы из флотационного колчедана и объясните назначение каждой стадии.
Самой первой стадии предшествует измельчение колчедана.
Подумайте и ответьте, для чего измельчают сырьё?
Подумайте и ответьте, для чего проводят сушку колчедана?
Рассмотрим, что происходит при обжиге колчедана. В состав флотационного колчедана входит пирит FeS2, который при взаимодействии с кислородом воздуха образует обжиговый газ, содержащий примерно 12 – 15% SO2 и огарок, содержащий твёрдую фазу – оксид железа (III) Fe2O3, не прореагировавший пирит FeS2 и твёрдые примеси колчедана.
Подумайте и ответьте, почему требуется охлаждение обжигового газа перед очисткой? как используется тепло реакции? зачем необходима очистка от пыли? зачем нужна специальная очистка?
Все указанные операции (стадии) нужны, как минимум, для предотвращения засорения аппаратуры, для уменьшения гидравлического сопротивления в системе, главное для предотвращения отравления катализатора, предотвращения загрязнения готового продукта, для извлечения ценных продуктов (селена, теллура, фтора).
Физико-химические основы процесса обжига флотационного колчедана
Уравнение химической реакции и его анализ.
Заметим, что флотационный колчедан, кроме пирита FeS2, содержит сульфиды других металлов. В колчедане также содержится небольшое количество мышьяка, селена и теллура, которые окисляются кислородом воздуха и дают побочные продукты, отравляющие катализатор на стадии окисления SO2 в SO3.
Рассмотрим окисление пирита кислородом воздуха.
Установлено, что при нагревании флотационного колчедана до 500ºС происходит диссоциация пирита:
FeS2 = FeS + S (3.1а)
Сера быстро сгорает в газовой фазе:
При дальнейшем повышении температуры сульфид железа окисляется:
(Эта реакция является лимитирующей).
Суммарным уравнением является уравнение
Обсудим, каков состав огарка. При обжиге флотационного колчедана происходит окисление сульфидов металлов, содержащихся в нём, поэтому кроме Fe2O3, в огарке содержатся оксиды других металлов. Кроме того, в состав огарка войдёт не окисленное сернистое железо, а также инертные твёрдые примеси колчедана. В огарке также остаётся от 0,5 до 2% серы.
В состав обжигового газа входят:
- целевой компонент SO2 (12 – 15%);
- избыточный кислород воздуха;
- азот воздуха;
- газообразные соединения мышьяка, селена и теллура;
- влага (колчедана и воздуха);
- пыль.
Теоретические основы обжига колчедана зависят от того, в каких печах происходит обжиг.
Аппаратура, применяемая для обжига:
- механические печи, в которых колчедан находится на нескольких подах и сгорает по мере перемещения его с одного пода на другой;
- печи пылевидного обжига, в которых частицы пиритного концентрата сгорают во время падения в полой камере;
- печи кипящего слоя, в которых частицы пиритного концентрата поддерживаются во взвешенном (псевдоожиженном) состоянии поступающим снизу воздухом и сгорают при интенсивном перемешивании.
Первые два типа мало интенсивны. В сернокислотных цехах устанавливают главным образом печи кипящего слоя (КС).
Физико–химические основы обжига флотационного колчедана в кипящем слое.
Теоретические основы процесса всегда рассматриваем исключительно для того, чтобы обосновать оптимальные условия проведения процесса, а затем при необходимости скорректировать их для промышленных установок.
Первое, что подлежит анализу – это уравнение химической реакции. Запишем его:
Поскольку лимитирующим процессом является реакция
то изучать необходимо данную реакцию.
Обжиг сульфида железа – необратимый экзотермический гетерогенный процесс. Скорость реакции зависит от следующих факторов:
- природы реагирующих веществ;
- температуры;
- концентрации;
- поверхности взаимодействия.
Кинетическое уравнение, то есть выражение скорости реакции, выглядит следующим образом:
где υ – скорость реакции;
k – константа скорости (зависит от природы реагирующих веществ и от температуры);
F – поверхность соприкосновения фаз;
∆c – движущая сила процесса (это разность концентраций либо исходных веществ, либо продуктов реакции на поверхности и в массе).
Как любой гетерогенный процесс, представленный моделью частиц с невзаимодействующим ядром, обжиг пирита состоит из трёх последовательных стадий:
- внешняя диффузия (газ подходит к поверхности);
- кинетика (это само химическое взаимодействие);
- внутренняя диффузия (продукты реакции отторгаются, а к поверхности диффундируют новые молекулы).
Вторую стадию — химическое взаимодействие — называют кинетической стадией или кинетической областью протекания процесса, две другие – диффузной областью процесса.
Известно, что гетерогенный процесс лимитируется самой медленной стадией процесса. Установлено, что в данном случае лимитирующей стадией является окисление сульфида железа(II) – уравнение 3.1в.
Далее исследуют влияние различных факторов (температура, концентрация и величина поверхности соприкосновения) на реакцию окисления сульфида железа(II). Интенсификация этой реакции в итоге приведёт к увеличению скорости горения пирита в целом – уравнение (3.1).
Рассмотрим, как установили оптимальную температуру обжига.
Зависимость скорости реакции (точнее, константы скорости) от температуры описывается уравнением Аррениуса:
где K – константа скорости реакции;
k0 – предэкспоненциальный множитель;
e – основание натурального логарифма;
E – энергия активации, кДж/моль;
R – универсальная газовая постоянная, 8,3 Дж/моль·К;
T – температура, К.
Это уравнение часто используется в логарифмической форме:
Такую форму легко представлять графически. На Рис. 17 показана зависимость константы скорости реакции от температуры.
Если К1 и К2 – константы скорости реакции при соответствующих температурах Т1 и Т2, то
Очевидно, что с увеличением температуры (T2 > T1) lnK увеличивается, следовательно, увеличивается и скорость реакции.
Зависимость константы скорости реакции от температуры
Для реакции окисления сульфида железа (II) зависимость lnK от 1/T выглядит следующим образом (Рис.18):
АБ – кинетическая область, Еакт = 250 КДж/моль;
ГВ – диффузная область, Еакт = 17,5 КДж/моль;
ВБ – переходная область, Еакт = 152 КДж/моль.
Самая низкая энергия активации в диффузной области, это значит, что самый энергетически выгодный путь протекания процесса находится в диффузной области.
Как следует из графика, оптимальная температура обжига составляет порядка 800ºС.
Нельзя ли снизить температуру процесса? – Из графика видно, что при низких температурах процесс протекает в кинетической области, которая характеризуется более высокой энергией активации и более низкими скоростями.
А может для увеличения скорости можно температуру увеличить более, чем 800ºС? – Увеличение температуры приводит к спеканию флотационного колчедана.
Итак, оптимальная температура процесса 800ºС. Поскольку реакция экзотермическая, то для снижения температуры, то есть для поддержания оптимального значении, в печах кипящего слоя размещают охлаждающие элементы, в которые подаётся либо вода (при этом образуется пар) либо пар (при этом образуется перегретый пар).
Итак, одним из условий ускорения обжига пирита является увеличение температуры, но в пределах оптимальных значений – 800ºС.
Для интенсификации процесса обжига флотационного колчедана в кипящем слое необходимо повышать скорость газового потока. В печах кипящего слоя должна поддерживаться такая скорость, при которой частицы находятся во взвешенном состоянии. Но увеличение скорости потока приводит к выносу частиц из печи. Таким образом, увеличение скорости потока имеет свои границы.
Дисперсный состав твёрдой фазы.
Очевидно, что для интенсификации процесса большое значение имеет дисперсный состав твёрдой фазы. Чем мельче частицы, тем больше поверхность соприкосновения. Но очень мелкие частицы уносятся с газовым потоком, что влечёт большие потери сырья (колчедана).
С другой стороны, при увеличении размера частиц уменьшается их общая поверхность в единице объёма, что снижает интенсивность процесса.
Интенсивное перемешивание обеспечивает большую скорость процесса диффузии в кипящем слое, а, следовательно, и процесса обжига флотационного колчедана в целом.
Основные выводы.
Обжиг флотационного колчедана определяется лимитирующей стадией. Ею является реакция горения сульфида железа (FeS2) (уравнение реакции 3.1в).
Поскольку процесс горения протекает во внутридиффузной области, ускорение (интенсификация) указанного процесса происходит при следующих условиях:
- повышение температуры, но не более 800°С, для чего ставят охлаждающие элементы;
- увеличение концентрации кислорода, тоже самое что «увеличение скорости дутья» в определённых пределах (1,5 – 2,0 раза от теоретического), в противном случае имеет место унос частиц флотационного колчедана;
- увеличение поверхности соприкосновения за счёт уменьшения размеров частиц, но до определённых пределов, в противном случае увеличивается унос, если частицы более мелкие или, если частицы слишком крупные, изнутри не реагируют, что увеличивает потери колчедана;
- перемешивание флотационного колчедана воздухом, как необходимое условие всех массообменных процессов, в том числе процессов в кипящем слое.
Очевидно, что газ, полученный обжигом флотационного колчедана, не может быть подан непосредственно из печи на контактное окисление. Поэтому далее он подвергается переработке, в которую входят следующие основные процессы:
- охлаждение
- очистка от пыли
- специальная очистка
- осушка.
Очистка обжигового газа от пыли
По выходе из печи кипящего слоя в газе содержится до 300г/м 3 пыли. Наличие пыли в газе, поступающем на катализатор недопустимо, так как пыль засоряет аппаратуру и в результате повышается гидравлическое сопротивление, а также пыль загрязняет катализатор.
Итак, очистка от пыли необходима. Что надо сделать перед очисткой? Перед очисткой требуется охлаждение обжигового газа, для чего непосредственно после печи ставят котёл-утилизатор.
Очистка газа от пыли проводится в два этапа: грубая и тонкая.
Грубая очистка осуществляется следующим образом: после котла–утилизатора газ поступает в циклон, где осаждается основная часть пыли, в результате чего содержание пыли в газе снижается до 10 – 20 г/м3.
Тонкая очистка осуществляется так: из циклона газ направляется в сухой электрофильтр, где достигается более высокая степень очистки газа (содержание пыли в газе остаётся 0,05 – 0,1г/м 3 ).
Специальная тонкая очистка печного газа
После выделения пыли обжиговой газ подвергается специальной очистке (или промывке). Это делается для удаления примесей, присутствие которых недопустимо в газе, поступающем на катализатор. Это остатки пыли, соединения мышьяка, селена, теллура, фтора и др.
Проводится очистка в башнях с насадкой или в полых башнях, которые орошаются серной кислотой различной концентрации.
Обжиговый газ из печного отделения поступает в промывное. Здесь обжиговый газ направляется в первую промывную колонну, в верхней части которой разбрызгивается 50% серная кислота. Затем газ проходит вторую промывную колонну с насадкой, орошаемой противоточно (10 – 20) % серной кислотой. В результате соприкосновения газа с кислотой газ охлаждается, и из него выделяются остатки пыли, соединения мышьяка и селена, триоксид серы и другие примеси.
Однако часть SO3 при охлаждении образует пары серной кислоты, которые конденсируются в виде тумана. Для выделения тумана серной кислоты газ направляется в мокрые электрофильтры, а затем в сушильные башни для удаления влаги
Осушка обжигового газа
Подумайте и ответьте, почему нужна осушка?
Ответ. Газ во второй промывной колонне практически полностью насыщается водяными парами. Содержание водяных паров тем больше, чем выше температура газа во второй промывной башне и ниже концентрация кислоты, орошающей эту башню.
Таким образом, газ, поступающий в сушильные башни, содержит большое количество водяных паров.
Осушка газа проводится в насадочной (скруберной) башне, где пары воды абсорбируются 93 – 95%-й серной кислотой, орошающей эти башни.
Содержание влаги в газе, выходящем из сушильных башен, не должно превышать 0,01 – 0,02%(об.) или 0,08 – 0,15г/м 3 .
Концентрация серной кислоты, выходящей из башни, не должна уменьшаться более чем на 0,5%.
Для поддержания необходимой концентрации серной кислоты в сборник сушильной кислоты непрерывно добавляют концентрированную серную кислоту, а избыток сушильной кислоты перекачивается насосом в абсорбционное отделение.
Температура кислоты на входе в сушильную башню 30 – 40°С, на выходе 45 – 50°С. Почему температура изменилась?
В первой башне концентрация серной кислоты 90 – 93%, во второй концентрация 94 – 95%.
Перед сушильными башнями газ разбавляют воздухом. Зачем это делают и почему «перед» сушильными башнями?
Ответ. Газы, получаемые при сжигании серосодержащего сырья (колчедана) содержит от 9 до 17% (об.) SO2. Оптимальное же содержание SO2 в газе, поступающем на контактирование, должно быть 7,3±0,2% (об.). Поэтому обжиговый газ разбавляют воздухом, который также требует осушки.
А почему разбавление необходимо именно перед сушильными башнями?
Ответ. Разбавлять раньше нецелесообразно, так как увеличивается гидравлическое сопротивление аппаратуры очистного отделения, следовательно, снижается производительность аппаратов.
Осушка – гетерогенный массообменный процесс. Скорость процесса описывается уравнением:
где m(H2O) – масса паров воды, поглощаемых из газа (или скорость процесса);
k – коэффициент массопередачи (или коэффициент абсорбции паров воды);
F – поверхность соприкосновения фаз (или поверхность насадки);
∆p – среднелогарифмическая разность давлений паров воды в начале и в конце процесса (или движущая сила процесса).
где и – давление паров воды в газе на входе и на выходе соответственно;
и – давление паров воды над серной кислотой на входе и на выходе соответственно.
Принципиальная схема производства серной кислоты из железного колчедана
По технологическому оформлению производство серной кислоты из железного колчедана является наиболее сложным и состоит из нескольких последовательных стадий.
На Рис. 19 представлена принципиальная схема этого производства.
1 – обжиг флотационного колчедана и получение обжигового газа; 2 – охлаждение газа в котле-утилизаторе; 3 – очистка газа от пыли; 4 – промывка и осушка газа; 5 – подогрев газа; 6 – окисление сернистого ангидрида в серный на катализаторе; 7 – абсорбция серного ангидрида и образование серной кислоты.
📹 Видео
Все про серную кислоту | Химия ОГЭ 2023 | УмскулСкачать

УЧЕБНОЕ КИНО - ПРОИЗВОДСТВО СЕРНОЙ КИСЛОТЫ КОНТАКТНЫМ СПОСОБОМ.Скачать

Практическая работа №5. Разбавленная серная кислота и её соли. 9 класс.Скачать

СЕРНАЯ КИСЛОТА разбавленная и концентрированная - в чем отличия? | Химия ОГЭСкачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

СЕКРЕТ ИЗГОТОВЛЕНИЯ СЕРНОЙ КИСЛОТЫ.Скачать

Опасно для здоровья! ⚠️ Опыты с серной кислотойСкачать

Серная кислота и ее соли. 9 класс.Скачать

Взаимодействие цинка с серной кислотойСкачать

В цеху серной кислоты. И всё о кислотахСкачать

Контактный способ получения серной кислоты. 11 класс.Скачать

Как сделать серную кислоту.Скачать

Производство серной кислоты | Химия ЕГЭ 10 класс | УмскулСкачать

Как сделать серную кислоту в домашних условиях?Скачать

Производство серной кислоты контактным способомСкачать