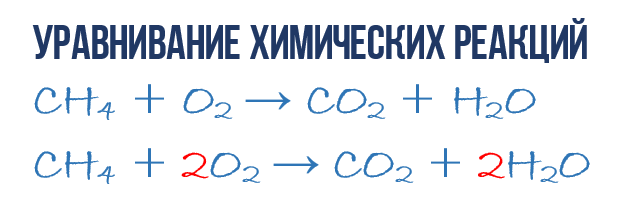Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Тема «Ионные уравнения»
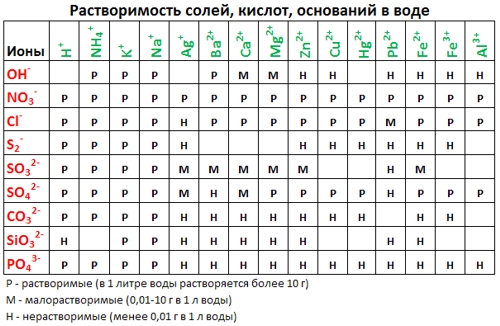
Обязательно используем для работы таблицу растворимости .
Слабые электролиты – нерастворимые ↓: основания, кислота H 2 SiO 3 , соли ;
— все оксиды , H 2 O.
Сильные электролиты – растворимые основания (щелочи), соли;
— кислоты H 2 SO 4 , HNO 3 , HCl, HBr, HI.
Некоторые вещества при получении распадаются, вместо них пишем две формулы продуктов распада: H 2 CO 3 = H 2 O + CO 2 ↑ H 2 SO 3 = H 2 O + SO 2 ↑
Помним, что при составлении формул веществ применяем правило:
формулы ионов – заряды ионов – индексы (делаем «крест-накрест», если нужно)
Все заряды ионов есть в таблице растворимости!
Алгоритм составления ионно-молекулярных уравнений (ИМУ)
правильно составляя формулы, и подбираем
2. Под каждой формулой пишем сильный или
слабый электролит, проверяя по табл.раств.
сил . сил . слаб . сил .
3. Составляем ИМУ: формулы сильных
электролитов делим на ионы (с ЗАРЯДАМИ!),
формулы слабых пишем целиком.
2Na + + SO 4 2- + Ba 2+ + 2Cl — = BaSO 4 ↓ + 2Na + + 2Cl —
это полное ионно-молекулярное уравнение (ИМУ)
4. Зачеркиваем формулы одинаковых ионов,
которые есть и в левой части ур-ия, и в правой.
2Na + + SO 4 2- + Ba 2+ + 2Cl — = BaSO 4 ↓ + 2Na + + 2Cl —
5. Переписываем оставшееся, ничего не теряя,
ни заряды, ни коэффициенты.
Определение возможности протекания реакции ионного обмена
II ) + гидроксид калия
2. Проверяем по табл.раств. другое сочетание ионов.
3. Если при этом получается одно
нерастворимое вещество (или вода, или газ),
4. Если оба вещества получаются растворимые,
реакция НЕ ИДЕТ. Знак = зачеркиваем,
формулы продуктов не пишем.
нитрат меди ( II ) + хлорид калия
Курс повышения квалификации
- Дистанционное обучение как современный формат преподавания
- Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Дистанционные курсы для педагогов
- Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
- Материал подходит для УМК
- Другие материалы
- Вам будут интересны эти курсы:
- Оставьте свой комментарий
- Автор материала
- Дистанционные курсы для педагогов
- Подарочные сертификаты
- Как составлять уравнения ионных реакций
- Алгоритм составления уравнения ионных реакций
- Составление молекулярных уравнений по ионным
- Урок 13. Составление химических уравнений
- Химическое уравнение
- Уравнивание химических реакций
- Коэффициенты в уравнениях химических реакций
- 📽️ Видео
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 925 человек из 80 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Курс добавлен 23.11.2021
- Сейчас обучается 35 человек из 23 регионов
Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 24 человека из 14 регионов
Ищем педагогов в команду «Инфоурок»
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Дистанционные курсы для педагогов
«Взбодрись! Нейрогимнастика для успешной учёбы и комфортной жизни»
Свидетельство и скидка на обучение каждому участнику
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 576 396 материалов в базе
Материал подходит для УМК
«Химия», Габриелян О.С.
§ 38. Ионные уравнения
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
33 конкурса для учеников 1–11 классов и дошкольников от проекта «Инфоурок»
Другие материалы
- 07.09.2020
- 279
- 3
- 05.09.2020
- 680
- 21
- 04.06.2020
- 226
- 2
- 12.04.2020
- 290
- 1
- 23.02.2020
- 757
- 25
- 11.02.2020
- 529
- 7
- 04.02.2020
- 1085
- 65
- 15.11.2019
- 309
- 4
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Добавить в избранное
- 07.10.2020 1296
- DOCX 19.6 кбайт
- 11 скачиваний
- Оцените материал:
Настоящий материал опубликован пользователем Андреева Ирина Ивановна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
- На сайте: 1 год и 4 месяца
- Подписчики: 0
- Всего просмотров: 3228
- Всего материалов: 6
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Видео:Химия | Молекулярные и ионные уравненияСкачать

Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Онлайн-конференция о создании школьных служб примирения
Время чтения: 3 минуты
ЕГЭ в 2022 году будут сдавать почти 737 тыс. человек
Время чтения: 2 минуты
Полный перевод школ на дистанционное обучение не планируется
Время чтения: 1 минута
В Ленобласти школьники 5-11-х классов вернутся к очному обучению с 21 февраля
Время чтения: 1 минута
Тринадцатилетняя школьница из Индии разработала приложение против буллинга
Время чтения: 1 минута
Приемная кампания в вузах начнется 20 июня
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Видео:Химия. Молекулярные и ионные уравненияСкачать

Как составлять уравнения ионных реакций
Знания, необходимые для составления уравнений ионных реакций:
- умение отличать электролит от неэлектролита;
- умение составлять уравнения диссоциации электролитов;
- умение устанавливать значение зарядов ионов.
Таблица растворимости:
Таблица электрохимического ряда напряжений металлов:
В ионных уравнениях химические формулы веществ записывают в двух видах — в виде ионов, либо в виде молекул. Возникает естественный вопрос, — когда то или иное вещество надо записывать в виде иона или молекулы?
В виде ионов записывают формулы следующих веществ:
- сильные кислоты: H2SO4, HNO3, HI. ;
- сильные основания: KOH, NaOH, Ba(OH)2. ;
- растворимые в воде соли: KNO3, BaCl2, NaBr.
В виде молекул записывают формулы следующих веществ:
В случае, если среди продуктов реакции имеются нерастворимые или малорастворимые вещества (осадок), возле таких веществ ставят стрелку вниз (↓). Газообразные и летучие соединения соответственно обозначаются стрелкой, направленной вверх (↑).
Видео:как составить к сокращенному ионному уравнению молекулярноеСкачать

Алгоритм составления уравнения ионных реакций
- Записать уравнение в молекулярной форме:
- В тех случаях, когда реакция идет не до конца, у продуктов реакции, выпадающих в осадок или выделяющихся в виде газа, ставят стрелку:
- Записывают уравнение в ионном виде для тех веществ, которые диссоциируют на ионы, с указанием их зарядов:
- Определяют наличие одинаковых ионов в левой и правой части уравнения — это ионы, не принимающие участия в реакции, поэтому, их можно убрать, такая форма записи ионного уравнения называется сокращенной:
- ионы водорода и металлов имеют положительный заряд;
- ионы гидроксония и кислотных остатков — отрицательный заряд;
- как правило, заряд иона численно равен валентности атома.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Составление молекулярных уравнений по ионным
Теперь рассмотрим обратную задачу — как составить молекулярное уравнение, если известно сокращенное ионное уравнение.
- Дано сокращенное ионное уравнение взаимодействия между фосфором и хлором:
- По таблице Растворимостей (см. выше) подбираем соответствующие вещества, содержащие нужный катион и анион — хлорид натрия (NaCl) и нитрат свинца (II) (Pb(NO3)2);
- Пишем формулы выбранных веществ, которые должны прореагировать:
- Пишем формулы получившихся в результате реакции веществ:
- Осталось расставить стехиометрические коэффициенты, чтобы уравнять кол-во вещества в левой и правой части уравнения:
Реакции обмена в водных растворах электролитов могут протекать до конца (необратимые реакции)) или же одновременно протекать в противоположных направлениях (обратимые реакции).
Условия протекания необратимых реакций:
- образование осадка;
- выделение газа;
- образование малодиссоциирующего вещества (например, воды).
В случае, если в растворе нет ионов, способных связаться между собой, реакция является обратимой, т.е., не протекает до конца.
Пример необратимой реакции с выпадением осадка был приведен выше — взаимодействие хлорида натрия и нитрата свинца (II).
Пример необратимой реакции с выделением газа — взаимодействие карбоната натрия и соляной кислоты:
Пример необратимой реакции с образованием воды — взаимодействие гидроксида калия и азотной кислоты:
Пример обратимой реакции взаимодействия слабого электролита (CH3COOH) и нерастворимого основания (Cu(OH)2):
Если в реакцию вступают сильные электролиты, не дающие в результате взаимодействия малорастворимых или малодиссоциирующих веществ, то такие реакции не протекают — в растворе образуется смесь ионов, которые никак не взаимодействуют друг с другом:
Левая и правая части уравнения содержат абсолютные одинаковые ионы, которые можно сократить, поэтому никакой реакции не происходит.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Видео:Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

Урок 13. Составление химических уравнений
В уроке 13 «Составление химических уравнений» из курса «Химия для чайников» рассмотрим для чего нужны химические уравнения; научимся уравнивать химические реакции, путем правильной расстановки коэффициентов. Данный урок потребует от вас знания химических основ из прошлых уроков. Обязательно прочитайте об элементном анализе, где подробно рассмотрены эмпирические формулы и анализ химических веществ.
Видео:составляем молекулярные уравнения по сокращённым ионнымСкачать

Химическое уравнение
В результате реакции горения метана CH4 в кислороде O2 образуются диоксид углерода CO2 и вода H2O. Эта реакция может быть описана химическим уравнением:
Попробуем извлечь из химического уравнения больше сведений, чем просто указание продуктов и реагентов реакции. Химичекое уравнение (1) является НЕполным и потому не дает никаких сведений о том, сколько молекул O2 расходуется в расчете на 1 молекулу CH4 и сколько молекул CO2 и H 2 O получается в результате. Но если записать перед соответствующими молекулярными формулами численные коэффициенты, которые укажут сколько молекул каждого сорта принимает участие в реакции, то мы получим полное химическое уравнение реакции.
Для того, чтобы завершить составление химического уравнения (1), нужно помнить одно простое правило: в левой и правой частях уравнения должно присутствовать одинаковое число атомов каждого сорта, поскольку в ходе химической реакции не возникает новых атомов и не происходит уничтожение имевшихся. Данное правило основывается на законе сохранения массы, который мы рассмотрели в начале главы.
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Уравнивание химических реакций
Уравнивание химических реакций нужно для того, чтобы из простого химического уравнения получить полное. Итак, перейдем к непосредственному уравниванию реакции (1): еще раз взгляните на химическое уравнение, в точности на атомы и молекулы в правой и левой части. Нетрудно заметить, что в реакции участвуют атомы трех сортов: углерод C, водород H и кислород O. Давайте подсчитаем и сравним количество атомов каждого сорта в правой и левой части химического уравнения.
Начнем с углерода. В левой части один атом С входит в состав молекулы CH4, а в правой части один атом С входит в состав CO2. Таким образом в левой и в правой части количество атомов углерода совпадает, поэтому его мы оставляем в покое. Но для наглядности поставим коэффициент 1 перед молекулами с углеродом, хоть это и не обязательно:
Затем переходим к подсчету атомов водорода H. В левой части присутствуют 4 атома H (в количественном смысле H4 = 4H) в составе молекулы CH4, а в правой – всего 2 атома H в составе молекулы H2O, что в два раза меньше чем в левой части химического уравнения (2). Будем уравнивать! Для этого поставим коэффициент 2 перед молекулой H2O. Вот теперь у нас и в реагентах и в продуктах будет по 4 молекулы водорода H:
Обратите свое внимание, что коэффициент 2, который мы записали перед молекулой воды H2O для уравнивания водорода H, увеличивает в 2 раза все атомы, входящие в ее состав, т.е 2H2O означает 4H и 2O. Ладно, с этим вроде бы разобрались, осталось подсчитать и сравнить количество атомов кислорода O в химическом уравнении (3). Сразу бросается в глаза, что в левой части атомов O ровно в 2 раза меньше чем в правой. Теперь-то вы уже и сами умеете уравнивать химические уравнения, поэтому сразу запишу финальный результат:
Как видите, уравнивание химических реакций не такая уж и мудреная штука, и важна здесь не химия, а математика. Уравнение (4) называется полным уравнением химической реакции, потому что в нем соблюдается закон сохранения массы, т.е. число атомов каждого сорта, вступающих в реакцию, точно совпадает с числом атомов данного сорта по завершении реакции. В каждой части этого полного химического уравнения содержится по 1 атому углерода, по 4 атома водорода и по 4 атома кислорода. Однако стоит понимать пару важных моментов: химическая реакция — это сложная последовательность отдельных промежуточных стадий, и потому нельзя к примеру истолковывать уравнение (4) в том смысле, что 1 молекула метана должна одновременно столкнуться с 2 молекулами кислорода. Процессы происходящие при образовании продуктов реакции гораздо сложнее. Второй момент: полное уравнение реакции ничего не говорит нам о ее молекулярном механизме, т.е о последовательности событий, которые происходят на молекулярном уровне при ее протекании.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Коэффициенты в уравнениях химических реакций
Еще один наглядный пример того, как правильно расставить коэффициенты в уравнениях химических реакций: Тринитротолуол (ТНТ) C7H5N3O6 энергично соединяется с кислородом, образуя H2O, CO2 и N2. Запишем уравнение реакции, которое будем уравнивать:
Проще составлять полное уравнение, исходя из двух молекул ТНТ, так как в левой части содержится нечетное число атомов водорода и азота, а в правой — четное:
- 2C7H5N3O6 + O2 → CO2 + H2O + N2 (6)
Тогда ясно, что 14 атомов углерода, 10 атомов водорода и 6 атомов азота должны превратиться в 14 молекул диоксида углерода, 5 молекул воды и 3 молекулы азота:
Теперь в обеих частях содержится одинаковое число всех атомов, кроме кислорода. Из 33 атомов кислорода, имеющихся в правой части уравнения, 12 поставляются двумя исходными молекулами ТНТ, а остальные 21 должны быть поставлены 10,5 молекулами O2. Таким образом полное химическое уравнение будет иметь вид:
Можно умножить обе части на 2 и избавиться от нецелочисленного коэффициента 10,5:
Но этого можно и не делать, поскольку все коэффициенты уравнения не обязательно должны быть целочисленными. Правильнее даже составить уравнение, исходя из одной молекулы ТНТ:
Полное химическое уравнение (9) несет в себе много информации. Прежде всего оно указывает исходные вещества — реагенты, а также продукты реакции. Кроме того, оно показывает, что в ходе реакции индивидуально сохраняются все атомы каждого сорта. Если умножить обе части уравнения (9) на число Авогадро NA=6,022·10 23 , мы сможем утверждать, что 4 моля ТНТ реагируют с 21 молями O2 с образованием 28 молей CO2, 10 молей H2O и 6 молей N2.
Есть еще одна фишка. При помощи таблицы Менделеева определяем молекулярные массы всех этих веществ:
- C 7 H 5 N 3 O 6 = 227,13 г/моль
- O 2 = 31,999 г/моль
- CO 2 = 44,010 г/моль
- H 2 O = 18,015 г/моль
- N 2 = 28,013 г/моль
Теперь уравнение 9 укажет еще, что 4·227,13 г = 908,52 г ТНТ требуют для осуществления полной реакции 21·31,999 г = 671,98 г кислорода и в результате образуется 28·44,010 г = 1232,3 г CO2, 10·18,015 г = 180,15 г H2O и 6·28,013 г = 168,08 г N2. Проверим, выполняется ли в этой реакции закон сохранения массы:
| Реагенты | Продукты | |
| 908,52 г ТНТ | 1232,3 г CO 2 | |
| 671,98 г CO 2 | 180,15 г H 2 O | |
| 168,08 г N 2 | ||
| Итого | 1580,5 г | 1580,5 г |
Но необязательно в химической реакции должны участвовать индивидуальные молекулы. Например, реакция известняка CaCO 3 и соляной кислоты HCl, с образованием водного раствора хлорида кальция CaCl 2 и диоксида углерода CO 2 :
Химическое уравнение (11) описывает реакцию карбоната кальция CaCO3 (известняка) и хлористоводородной кислоты HCl с образованием водного раствора хлорида кальция CaCl2 и диоксида углерода CO2. Это уравнение полное, так как число атомов каждого сорта в его левой и правой частях одинаково.
Смысл этого уравнения на макроскопическом (молярном) уровне таков: 1 моль или 100,09 г CaCO3 требует для осуществления полной реакции 2 моля или 72,92 г HCl, в результате чего получается по 1 молю CaCl2 (110,99 г/моль), CO2 (44,01 г/моль) и H2O (18,02 г/моль). По этим численным данным нетрудно убедиться, что в данной реакции выполняется закон сохранения массы.
Интерпретация уравнения (11) на микроскопическом (молекулярном) уровне не столь очевидна, поскольку карбонат кальция представляет собой соль, а не молекулярное соединение, а потому нельзя понимать химическое уравнение (11) в том смысле, что 1 молекула карбоната кальция CaCO3 реагирует с 2 молекулами HCl. Тем более молекула HCl в растворе вообще диссоциирует (распадается) на ионы H + и Cl — . Таким образом более правильным описанием того, что происходит в этой реакции на молекулярном уровне, дает уравнение:
Здесь в скобках сокращенно указано физическое состояние каждого сорта частиц (тв. — твердое, водн. — гидратированный ион в водном растворе, г. — газ, ж. — жидкость).
Уравнение (12) показывает, что твердый CaCO3 реагирует с двумя гидратированными ионами H + , образуя при этом положительный ион Ca 2+ , CO2 и H2O. Уравнение (12) как и другие полные химические уравнения не дает представления о молекулярном механизме реакции и менее удобно для подсчета количества веществ, однако, оно дает лучшее описание происходящего на микроскопическом уровне.
Закрепите полученные знания о составлении химических уравнений, самостоятельно разобрав пример с решением:
Надеюсь из урока 13 «Составление химических уравнений» вы узнали для себя что-то новое. Если у вас возникли вопросы, пишите их в комментарии.
📽️ Видео
Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать

Уравнения химический реакций на ОГЭ: как составлять без ошибок?Скачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

ХИМИЧЕСКИЕ УРАВНЕНИЯ | Как составлять уравнения реакций | Химия 8 классСкачать

Реакции ионного обмена. 9 класс.Скачать

Реакции ионного обмена. 9 класс.Скачать

Ионные уравнения реакций. По сокращенному ионному уравнению составляем полное ионное и молекулярное.Скачать

9 класс. Реакции ионного обмена. Ионные уравнения.Скачать

Составление формул органических соединений по названиюСкачать

Реакции ионного обменаСкачать