- Как составлять ионные уравнения. Задача 31 на ЕГЭ по химии
- Зачем нужны ионные уравнения
- Алгоритм написания ионных уравнений
- Как составить молекулярное уравнение реакции
- Как превратить молекулярное уравнение в полное ионное уравнение
- В виде ионов записывают:
- В виде молекул записывают:
- Вопрос № 5 Напишите уравнения реакций в молекулярном, ионном и сокращенном ионном виде, при помощи которых можно различить соляную, серную и азотную кислоты.
- Химия, Биология, подготовка к ГИА и ЕГЭ
- Уравнения качественных реакций неорганической химии.
- 🎦 Видео
Как составлять ионные уравнения. Задача 31 на ЕГЭ по химии
Достаточно часто школьникам и студентам приходится составлять т. н. ионные уравнения реакций. В частности, именно этой теме посвящена задача 31, предлагаемая на ЕГЭ по химии. В данной статье мы подробно обсудим алгоритм написания кратких и полных ионных уравнений, разберем много примеров разного уровня сложности.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Зачем нужны ионные уравнения
Напомню, что при растворении многих веществ в воде (и не только в воде!) происходит процесс диссоциации — вещества распадаются на ионы. Например, молекулы HCl в водной среде диссоциируют на катионы водорода (H + , точнее, H 3 O + ) и анионы хлора (Cl — ). Бромид натрия (NaBr) находится в водном растворе не в виде молекул, а в виде гидратированных ионов Na + и Br — (кстати, в твердом бромиде натрия тоже присутствуют ионы).
Записывая «обычные» (молекулярные) уравнения, мы не учитываем, что в реакцию вступают не молекулы, а ионы. Вот, например, как выглядит уравнение реакции между соляной кислотой и гидроксидом натрия:
HCl + NaOH = NaCl + H 2 O. (1)
Разумеется, эта схема не совсем верно описывает процесс. Как мы уже сказали, в водном растворе практически нет молекул HCl, а есть ионы H + и Cl — . Так же обстоят дела и с NaOH. Правильнее было бы записать следующее:
H + + Cl — + Na + + OH — = Na + + Cl — + H 2 O. (2)
Это и есть полное ионное уравнение . Вместо «виртуальных» молекул мы видим частицы, которые реально присутствуют в растворе (катионы и анионы). Не будем пока останавливаться на вопросе, почему H 2 O мы записали в молекулярной форме. Чуть позже это будет объяснено. Как видите, нет ничего сложного: мы заменили молекулы ионами, которые образуются при их диссоциации.
Впрочем, даже полное ионное уравнение не является безупречным. Действительно, присмотритесь повнимательнее: и в левой, и в правой частях уравнения (2) присутствуют одинаковые частицы — катионы Na + и анионы Cl — . В процессе реакции эти ионы не изменяются. Зачем тогда они вообще нужны? Уберем их и получим краткое ионное уравнение:
H + + OH — = H 2 O. (3)
Как видите, все сводится к взаимодействию ионов H + и OH — c образованием воды (реакция нейтрализации).
Все, полное и краткое ионные уравнения записаны. Если бы мы решали задачу 31 на ЕГЭ по химии, то получили бы за нее максимальную оценку — 2 балла.
Итак, еще раз о терминологии:
- HCl + NaOH = NaCl + H 2 O — молекулярное уравнение («обычное» уравнения, схематично отражающее суть реакции);
- H + + Cl — + Na + + OH — = Na + + Cl — + H 2 O — полное ионное уравнение (видны реальные частицы, находящиеся в растворе);
- H + + OH — = H 2 O — краткое ионное уравнение (мы убрали весь «мусор» — частицы, которые не участвуют в процессе).
Видео:Химия | Молекулярные и ионные уравненияСкачать

Алгоритм написания ионных уравнений
- Составляем молекулярное уравнение реакции.
- Все частицы, диссоциирующие в растворе в ощутимой степени, записываем в виде ионов; вещества, не склонные к диссоциации, оставляем «в виде молекул».
- Убираем из двух частей уравнения т. н. ионы-наблюдатели, т. е. частицы, которые не участвуют в процессе.
- Проверяем коэффициенты и получаем окончательный ответ — краткое ионное уравнение.
Пример 1 . Составьте полное и краткое ионные уравнения, описывающие взаимодействие водных растворов хлорида бария и сульфата натрия.
Решение . Будем действовать в соответствии с предложенным алгоритмом. Составим сначала молекулярное уравнение. Хлорид бария и сульфат натрия — это две соли. Заглянем в раздел справочника «Свойства неорганических соединений». Видим, что соли могут взаимодействовать друг с другом, если в ходе реакции образуется осадок. Проверим:
BaCl 2 + Na 2 SO 4 = BaSO 4 ↓ + 2NaCl.
Таблица растворимости подсказывает нам, что BaSO 4 действительно не растворяется в воде (направленная вниз стрелка, напомню, символизирует, что данное вещество выпадает в осадок). Молекулярное уравнение готово, переходим к составлению полного ионного уравнения. Обе соли, присутствующие в левой части, записываем в ионной форме, а вот в правой части оставляем BaSO 4 в «молекулярной форме» (о причинах этого — чуть позже!) Получаем следующее:
Ba 2+ + 2Cl — + 2Na + + SO 4 2- = BaSO 4 ↓ + 2Cl — + 2Na + .
Осталось избавиться от балласта: убираем ионы-наблюдатели. В данном случае в процессе не участвуют катионы Na + и анионы Cl — . Стираем их и получаем краткое ионное уравнение:
Ba 2+ + SO 4 2- = BaSO 4 ↓.
А теперь поговорим подробнее о каждом шаге нашего алгоритма и разберем еще несколько примеров.
Видео:Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

Как составить молекулярное уравнение реакции
Должен сразу вас разочаровать. В этом пункте не будет однозначных рецептов. Действительно, вряд ли можно рассчитывать, что я смогу разобрать здесь ВСЕ возможные уравнения реакций, которые могут встретиться вам на ЕГЭ или ОГЭ по химии.
Ваш помощник — раздел «Свойства неорганических соединений». Если вы хорошо знакомы с четырьмя базовыми классами неорганических веществ (оксиды, основания, кислоты, соли), если вам известны химические свойства этих классов и методы их получения, можете на 95% быть уверены в том, что у вас не будет проблем на экзамене с написанием молекулярных уравнений.
Оставшиеся 5% — это некоторые «специфические» реакции, которые мы не сможем перечислить. Не будем лить слез по поводу этих 5%, а вспомним лучше номенклатуру и химические свойства базовых классов неорганических веществ. Три задания для самостоятельной работы:
Упражнение 1 . Напишите молекулярные формулы следующих веществ: оксид фосфора (V), нитрат цезия, сульфат хрома (III), бромоводородная кислота, карбонат аммония, гидроксид свинца (II), фосфат стронция, кремниевая кислота. Если при выполнении задания у вас возникнут проблемы, обратитесь к разделу справочника «Названия кислот и солей».
Упражнение 2 . Дополните уравнения следующих реакций:
- KOH + H 2 SO 4 =
- H 3 PO 4 + Na 2 O=
- Ba(OH) 2 + CO 2 =
- NaOH + CuBr 2 =
- K 2 S + Hg(NO 3 ) 2 =
- Zn + FeCl 2 =
Упражнение 3 . Напишите молекулярные уравнения реакций (в водном растворе) между: а) карбонатом натрия и азотной кислотой, б) хлоридом никеля (II) и гидроксидом натрия, в) ортофосфорной кислотой и гидроксидом кальция, г) нитратом серебра и хлоридом калия, д) оксидом фосфора (V) и гидроксидом калия.
Искренне надеюсь, что у вас не возникло проблем с выполнением этих трех заданий. Если это не так, необходимо вернуться к теме «Химические свойства основных классов неорганических соединений».
Видео:Ионные уравнения реакций. По сокращенному ионному уравнению составляем полное ионное и молекулярное.Скачать

Как превратить молекулярное уравнение в полное ионное уравнение
Начинается самое интересное. Мы должны понять, какие вещества следует записывать в виде ионов, а какие — оставить в «молекулярной форме». Придется запомнить следующее.
В виде ионов записывают:
- растворимые соли (подчеркиваю, только соли хорошо растворимые в воде);
- щелочи (напомню, что щелочами называют растворимые в воде основания, но не NH 4 OH);
- сильные кислоты (H 2 SO 4 , HNO 3 , HCl, HBr, HI, HClO 4 , HClO 3 , H 2 SeO 4 , . ).
Как видите, запомнить этот список совсем несложно: в него входят сильные кислоты и основания и все растворимые соли. Кстати, особо бдительным юным химикам, которых может возмутить тот факт, что сильные электролиты (нерастворимые соли) не вошли в этот перечень, могу сообщить следующее: НЕвключение нерастворимых солей в данный список вовсе не отвергает того, что они являются сильными электролитами.
Все остальные вещества должны присутствовать в ионных уравнениях в виде молекул. Тем требовательным читателям, которых не устраивает расплывчатый термин «все остальные вещества», и которые, следуя примеру героя известного фильма, требуют «огласить полный список» даю следующую информацию.
В виде молекул записывают:
- все нерастворимые соли;
- все слабые основания (включая нерастворимые гидроксиды, NH 4 OH и сходные с ним вещества);
- все слабые кислоты (H 2 СO 3 , HNO 2 , H 2 S, H 2 SiO 3 , HCN, HClO, практически все органические кислоты . );
- вообще, все слабые электролиты (включая воду. );
- оксиды (всех типов);
- все газообразные соединения (в частности, H 2 , CO 2 , SO 2 , H 2 S, CO);
- простые вещества (металлы и неметаллы);
- практически все органические соединения (исключение — растворимые в воде соли органических кислот).
Уф-ф, кажется, я ничего не забыл! Хотя проще, по-моему, все же запомнить список N 1. Из принципиально важного в списке N 2 еще раз отмечу воду.
Пример 2 . Составьте полное ионное уравнение, описывающие взаимодействие гидроксида меди (II) и соляной кислоты.
Решение . Начнем, естественно, с молекулярного уравнения. Гидроксид меди (II) — нерастворимое основание. Все нерастворимые основания реагируют с сильными кислотами с образованием соли и воды:
Cu(OH) 2 + 2HCl = CuCl 2 + 2H 2 O.
А теперь выясняем, какие вещества записывать в виде ионов, а какие — в виде молекул. Нам помогут приведенные выше списки. Гидроксид меди (II) — нерастворимое основание (см. таблицу растворимости), слабый электролит. Нерастворимые основания записывают в молекулярной форме. HCl — сильная кислота, в растворе практически полностью диссоциирует на ионы. CuCl 2 — растворимая соль. Записываем в ионной форме. Вода — только в виде молекул! Получаем полное ионное уравнение:
Сu(OH) 2 + 2H + + 2Cl — = Cu 2+ + 2Cl — + 2H 2 O.
Пример 3 . Составьте полное ионное уравнение реакции диоксида углерода с водным раствором NaOH.
Решение . Диоксид углерода — типичный кислотный оксид, NaOH — щелочь. При взаимодействии кислотных оксидов с водными растворами щелочей образуются соль и вода. Составляем молекулярное уравнение реакции (не забывайте, кстати, о коэффициентах):
CO 2 + 2NaOH = Na 2 CO 3 + H 2 O.
CO 2 — оксид, газообразное соединение; сохраняем молекулярную форму. NaOH — сильное основание (щелочь); записываем в виде ионов. Na 2 CO 3 — растворимая соль; пишем в виде ионов. Вода — слабый электролит, практически не диссоциирует; оставляем в молекулярной форме. Получаем следующее:
СO 2 + 2Na + + 2OH — = Na 2+ + CO 3 2- + H 2 O.
Пример 4 . Сульфид натрия в водном растворе реагирует с хлоридом цинка с образованием осадка. Составьте полное ионное уравнение данной реакции.
Решение . Сульфид натрия и хлорид цинка — это соли. При взаимодействии этих солей выпадает осадок сульфида цинка:
Na 2 S + ZnCl 2 = ZnS↓ + 2NaCl.
Я сразу запишу полное ионное уравнение, а вы самостоятельно проанализируете его:
2Na + + S 2- + Zn 2+ + 2Cl — = ZnS↓ + 2Na + + 2Cl — .
Предлагаю вам несколько заданий для самостоятельной работы и небольшой тест.
Упражнение 4 . Составьте молекулярные и полные ионные уравнения следующих реакций:
- NaOH + HNO 3 =
- H 2 SO 4 + MgO =
- Ca(NO 3 ) 2 + Na 3 PO 4 =
- CoBr 2 + Ca(OH) 2 =
Упражнение 5 . Напишите полные ионные уравнения, описывающие взаимодействие: а) оксида азота (V) с водным раствором гидроксида бария, б) раствора гидроксида цезия с иодоводородной кислотой, в) водных растворов сульфата меди и сульфида калия, г) гидроксида кальция и водного раствора нитрата железа (III).
В следующей части статьи мы научимся составлять краткие ионные уравнения и разберем большое количество примеров. Кроме того, мы обсудим специфические особенности задания 31, которое вам предстоит решать на ЕГЭ по химии.
Видео:9 класс. Реакции ионного обмена. Ионные уравнения.Скачать

Вопрос № 5 Напишите уравнения реакций в молекулярном, ионном и сокращенном ионном виде, при помощи которых можно различить соляную, серную и азотную кислоты.

задача №5
к главе «Глава IV §§ 21 — 23 стр. 62 — 63».
Выделите её мышкой и нажмите CTRL + ENTER
Большое спасибо всем, кто помогает делать сайт лучше! =)
Нажмите на значок глаза возле рекламного блока, и блоки станут менее заметны. Работает до перезагрузки страницы.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Химия, Биология, подготовка к ГИА и ЕГЭ
Материал для задания 37 ЕГЭ (по-старому С2 ЕГЭ), для олимпиад, да и вообще для тех, кому нужны нормальные знания по химии
Автор статьи — Саид Лутфуллин
В статье приведены многие реакции, которые встречаются в ЕГЭ. Формулировки описания реакций тоже как в ЕГЭ, поэтому не удивляйтесь если встретите что-то вроде «…осадок растворяется в кислотах…», конечно же, он не растворяется, он реагирует с кислотой. Растворение – это немного другой процесс, но господа составители из ФИПИ со мной не согласны и упорно применяют в таких случаях именно этот термин.
Видео:Реакции ионного обмена. 9 класс.Скачать

Уравнения качественных реакций неорганической химии.
(кликните на название категории, чтобы перейти в соответствующий раздел)
I. Элементы IA-группы (щелочные металлы)
– легкие металлы, настолько пластичные, что их можно разрезать ножом. Из-за чрезвычайной активности, на воздухе легко окисляются (некоторые со взрывом), поэтому их хранят в керосине, кроме лития. Литий хранить в керосине невозможно из-за физических свойств. Этот металл легче керосина, поэтому всплывает в нем. Литий хранят в вазелине или еще в чем-нибудь таком инертном и вязком.
Почти все соли щелочных металлов растворимы в воде.
Поэтому обнаружение их катионов выпадением осадка невозможно. Для определения катионов металлов используют метод пирохимического анализа.
Этот метод основан на способности ионов металлов, входящих в состав летучих солей, окрашивать пламя горелки в определенный цвет.
1) Li +
Окрашивает пламя горелки в карминово-красный цвет
Помимо этого, литий – один единственный щелочной металл, катион которого можно обнаружить с помощью осадка. Катион лития с фосфат-ионом дает белый осадок:
Сокращенное ионное уравнение:
3Li + + PO4 3- → Li3PO4↓
2) Na +
Окрашивает пламя горелки в желтый цвет.
3) K +
Окрашивает пламя горелки в фиолетовый цвет.
4) Rb +
Окрашивает пламя горелки в розово-фиолетовый цвет.
5) Cs +
Окрашивает пламя горелки в голубовато-фиолетовый цвет.
II. Щелочноземельные металлы (подгруппа кальция)
– металлы серого цвета. Твердые, ножом не режутся. На воздухе ведут себя спокойно: покрываются оксидной пленкой.
Определить катионы щелочноземельных металлов можно как с помощью выпадения осадка, так и с помощью пирохимического метода:
1. Ca 2+
Образует белый осадок с карбонат-ионом : CaCl 2 + K 2 CO 3 → CaCO 3 ↓ + 2 KCl
Сокращенное ионное уравнение: Ca 2+ + CO 3 2- → CaCO 3 ↓
Образуется карбонат кальция – мел. Так же карбонат кальция – составная часть накипи. Иногда можно встретить формулировку: «…белый осадок, растворимый в кислотах с выделением газа (без цвета, вкуса, запаха)…». Имеется в виду реакция карбонатов с кислотами:
Катион кальция окрашивает пламя горелки в оранжево-красный цвет .
2. Sr 2+
Образует белый нерастворимый в кислотах осадок с сульфат-ионом : SrCl 2 + K 2 SO 4 → SrSO 4 ↓ + 2 KCl
Сокращенное ионное уравнение: Sr 2+ + SO 4 2- → SrSO 4 ↓
Окрашивает пламя горелки в темно-красный цвет .
3. Ba 2+
Образует белый нерастворимый в кислотах осадок с сульфат-ионом : BaCl 2 + K 2 SO 4 → BaSO 4 ↓ + 2 KCl
Сокращенное ионное уравнение: Ba 2+ + SO 4 2- → BaSO 4 ↓
Катионы бария окрашивают пламя горелки в зеленый цвет
4. Mg 2+
Определяется, как и кальций, карбонат-ионами .
Карбонат магния – белый осадок: Mg ( NO 3 ) 2 + K 2 CO 3 → MgCO 3 ↓ + 2 KNO 3
Сокращенное ионное уравнение: Mg 2+ + CO 3 2- → MgCO 3 ↓
III. Be 0 (Be 2+ ), Zn 0 (Zn 2+ ), Al 0 (Al 3+ )
эти три металла объединяют амфотерные свойства. Поэтому если в задании встречается следующая формулировка: «…металл, растворимый в раствор е щелочи…», «…металл, который растворяется и в щелочах, и кислотах…» или «…металл, растворяющийся в щелочи с выделением горючего газа, легче воздуха…» , то имеют в виду один из этих трех металлов.
Ионы этих металлов в растворах тоже определяют добавлением щелочи.
Выпадает белый студенистый осадок (гидроксид металла), который в избытке щелочи растворяется (гидроксиды алюминия, цинка и бериллия реагируют со щелочами, образуя растворимые гидроксоалюминаты, гидроксоцинкаты и гидроксобериллаты соответственно):
BeCl 2 + 2 KOH → Be ( OH ) 2 ↓ + 2 KCl
(образование осадка) сокращенное ионное уравнение:
Be 2+ + 2 OH — → Be ( OH ) 2 ↓ Be ( OH ) 2 + 2 KOH → K 2 [ Be ( OH ) 4 ] (растворение осадка)
ZnCl 2 + 2 KOH → Zn ( OH ) 2 ↓ + 2 KCl (образование осадка)
сокращенное ионное уравнение: Zn 2+ + 2 OH — → Zn ( OH ) 2 ↓
Zn ( OH ) 2 + 2 KOH → K 2 [ Zn ( OH ) 4 ] (растворение осадка)
AlCl 3 + 3 KOH → Al ( OH ) 3 ↓ + 3 KOH (образование осадка)
сокращенное ионное уравнение:
Al 3+ + 3 OH — → Al ( OH ) 3 ↓
Al ( OH ) 3 + KOH → K [ Al ( OH ) 4 ] (растворение осадка)
Оксиды этих металлов, как и гидроксиды, растворяются в кислотах и щелочах, рассмотрим на примере оксида алюминия:
У гидроксида цинка есть характерная особенность: он растворяется в NH 3 (водн.)
Ион Zn 2+ с S 2+ образует белый осадок . Который растворяется в кислотах с выделением газа с запахом тухлых яиц – сероводорода (про него подробнее ниже, в разделе сера):
ZnSO 4 + K 2 S → ZnS ↓ + K 2 SO 4 (образование осадка)
Сокращенное ионное уравнение:
ZnS + H 2 SO 4 → ZnSO 4 + H 2 S ↑ (растворение осадка с выделением сероводорода)
Медь – пластичный розовато-красный металл.
Хороший проводник электрического тока.
Не вытесняет из кислот водород.
Реагирует только с кислотами-окислителями (азотной и концентрированной серной):
Оксид меди – CuO – черный – основный.
Растворяется в кислотах, окрашивая раствор в голубой цвет: CuO + 2HCl → CuCl 2 + H 2 O
Cu 2+
Летучие соли меди окрашивают пламя горелки в зеленый цвет. Соединения меди имеют голубоватую окраску , это можно использовать как диагностический признак.
В растворе ионы меди можно обнаружить добавлением щелочи выпадает растворимый в кислотах, голубой осадок, который используется в нескольких качественных реакциях органической химии.
Сокращенное ионное уравнение:
Осадок Cu ( OH ) 2 растворяется в избытке NH 3 (водн.) образуя интенсивно синий раствор:
Если нагреть осадок Cu ( OH ) 2 , то он почернеет. Потому что гидроксид меди( II ) – нерастворимое основание и разлагается:
Голубой – это фирменный цвет соединений меди, и если в задании ЕГЭ написано про этот цвет, то 90% вероятности, что говорят про соединение меди.
Серебро – мягкий благородный металл. Цвет серебристый.
Оксид серебра Ag 2 O- черный – основный.
Ag +
Катион серебра с хлорид-ионом дает белый творожистый осадок : AgNO 3 + KCl → AgCl ↓ + KNO 3
сокращенное ионное уравнение: Ag + + Cl — → AgCl ↓
Осадок хлорида серебра (и остальные галогениды) , как и гидроксида меди, растворяется в NH 3 * H 2 O
Еще одна особенность серебра, которая позволяет определить его ионы в растворе, – это его гидроксид, который нестабилен и быстро разлагается в водном растворе.
При добавлении к раствору соли серебра щелочи , выпадает черный осадок оксида серебра :
AgNO 3 + KOH → KNO 3 + AgOH
можно (и грамотнее) записать сразу:
То есть при добавлении к соли серебра щелочи выпадает черный осадок . Осадок оксида серебра , как и галогениды этого металла, растворяются в NH 3 (водн.) :
[ Ag ( NH 3 ) 2 ] OH – гидроксид диамминсеребра( I ) известен как раствор Толленса.
Он используется в качественной реакции на альдегиды (реакция серебряного зеркала).
Оксид серебра как основный гидроксид растворяется в кислотах (само собой, в тех, с которыми серебро может образовать растворимую соль):
Железо – серебристо-белый пластичный металл.
Обладает магнитными свойствами.
Вытесняет из растворов кислот водород (кроме азотной). Обратите внимание, что при взаимодействии с кислотами-неокислителями, и слабыми окислителями железо приобретает степень окисления +2, а при взаимодействии с сильными окислителями оно приобретет степень окисления +3:
2 Fe + 3 Cl 2 ( t )→ 2 FeCl 3
Катион Fe 3+
При добавлении к раствору, содержащему ионы трехвалентного железа , выпадает бурый осадок гидроксида железа ( III ):
Сокращенное ионное уравнение:
Оксид и гидроксид железа( III ) – амфотерные соединения, поэтому они растворяются в щелочах и кислотах:
Катион Fe 2+ с гидроксид ионом тоже образует осадок, только зеленоватого цвета .
Сокращенное ионное уравнение: Fe 2+ + 2 OH — → Fe ( OH ) 2 ↓
Оксид и гидроксид железа( II ) – основные.
В щелочах не растворяются. Осадок со временем буреет (меняет степень окисления с 2+ на +3):
На ионы железы есть еще две похожие канонические качественные реакции. Образуется одно и то же вещество: берлинская лазурь, или турнбулева синь.
Раньше считали, что это два разных вещества, в книжках писали: «не путайте», а потом оказалось, что это не так.
Ион Fe 2+ определяется добавлением красной кровяной соли (гексацианоферрат (III) калия):
4Fe 2+ + 3 [Fe III (CN) 6 ] 3− → Fe III 4 [Fe II (CN) 6 ] 3 ↓
Ион Fe 3+ определяется добавлением желтой кровяной соли (гексацианоферрат (II) калия):
4Fe 3+ + 3 [Fe II (CN) 6 ] 4− → Fe III 4 [Fe II (CN) 6 ] 3 ↓
Не очень активный, так как покрывается оксидной пленкой.
Название элемента переводится с греческого «цвет», потому что соединения хрома, как правило, окрашены. Простое вещество хром ведет себя как типичный металл, со щелочами не реагирует.
Реагирует с кислотами. Кислоты-неокислители ( в том числе разбавленная серная кислота) и вообще слабые окислители переводят хром в степень окисления +2:
Cr + S (t)→ CrS C окислителями приобретает степень окисления +3:
В общем тут все как у железа. Правило простое и вполне логичное.
С азотной и концентрированной серной кислотой не реагирует, так как пассивируется.
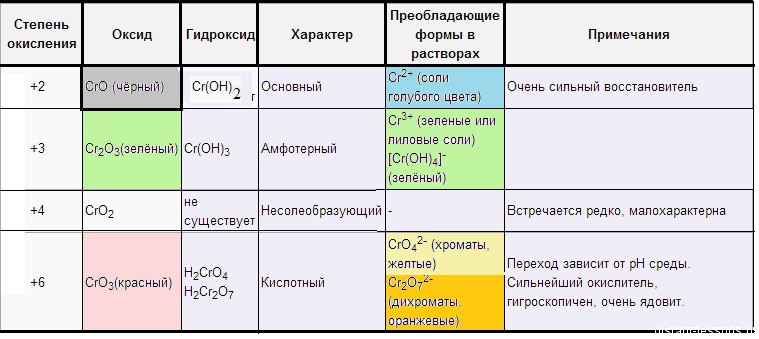
Проявляет несколько устойчивых степеней окисления.
Степень окисления +2
В этих соединениях хром проявляет сильные восстановительные свойства.
Оксид хрома ( II ) – CrO (основный) – черный.
Растворы солей Cr 2+ голубые . Если обработать черный оксид хрома( II ) соляной кислотой, образуется голубой раствор :
Если к раствору соли двухвалентного хрома добавить щелочь выпадет желтый осадок гидроксида хрома( II ), (осадок на воздухе зеленеет, об этом чуть позже):
Сокращенное ионное уравнение:
Гидроксид хрома( II ) основный,
поэтому он не растворяется в щелочах, зато прекрасно растворяется в кислотах, образуя все тот же синий раствор:
Степень окисления +3.
Оксид хрома( III ) – Cr 2 O 3 (амфотерный) – зеленый .
Как амфотерный оксид Cr 2 O 3 растворяется в кислотах и щелочах:
Соли трехвалентного хрома могут быть разного цвета (от фиолетового до темно-зеленого). Поэтому визуально опознать соль трехвалентного хрома со 100% уверенностью нельзя. Наличие катионов Cr 3+ в растворе определяется добавлением щелочи .
Cr 3+ с гидроксид-ионами образует зеленый осадок гидроксида хрома( III ) :
Сокращенное ионное уравнение:
Cr 3+ + 3 OH — → Cr ( OH ) 3 ↓
Выпавший осадок – гидроксид хрома( III ) амфотерный, поэтому растворяется в кислотах и щелочах, с образованием зеленых солей – гидроксохроматов :
Если оставить на некоторое время на воздухе желтый осадок гидроксида хрома( II ) , то он позеленеет . Cr +2 окисляется до Cr +3 ,
образуется зеленый гидроксид хрома( III ) :
Если подействовать на соединение хрома (+3) сильным окислителем, то произойдет смена окраски. Она станет желтой. Хром окислится до +6
Степень окисления +6.
В этих соединениях хром проявляет сильные окислительные свойства.
Оксид хрома( VI ) – CrO 3 (кислотный) – красный .
Окисляет многие органические соединения. Этот процесс описывают как «растворение [оксида хрома VI ] в спиртах (альдегидах, эфирах)»
Оксид кислотный, поэтому в кислотах не растворяется, растворяется в щелочах, с образованием хроматов:
Хроматы – это соли хромовой кислоты ( H 2 CrO 4 ). Они желтого цвета. Кроме хромовой (хром +6) образует дихромовую кислоту ( H 2 Cr 2 O 7 ), ее соли – бихроматы (дихроматы) оранжевые .
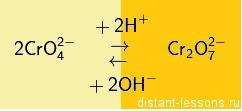
Хроматы и бихроматы переходят друг в друга при изменении кислотности среды (с щелочной на кислую и наоборот):
То есть в кислой среде более устойчивы бихроматы, в щелочной хроматы.
Хроматы и бихроматы так же являются сильнейшими окислителями.
При добавлении к раствору хромата катионов бария выпадает желтый осадок хромата бария BaCrO 4 :
Сокращенное ионное уравнение: Ва 2+ + СrO 4 2- → BaCr O 4 ↓
Полученный хромат бария растворяется в сильных неорганических кислотах. Потому что, как уже говорилось ранее, в кислой среде хроматы не устойчивы и переходят в бихроматы:
2 BaCrO 4 + 2 H + → 2 Ba 2+ + Cr 2 O 7 2- + H 2 O
Компактная таблица цветов соединения хрома, приведена у нас в статье “Хром”:
Как и хром малоактивен за счет пассивации.
Реагируя с кислотами (даже с кислотами-окислителями), окисляется до +2:
Mn + HCl → MnCl2 + H2↑
Mn + 2H2SO4(конц.) → MnSO4 + SO2↑ + 2H2O
В более агрессивных средах с кислотами-окислителями процесс окисления идет глубже: до +4 и +7.
Кислородом окисляется до +4 (там конечно есть другие варианты с другими температурами, но мы их рассматривать не будем):
Галогены (кроме фтора) до +2:
Mn + Cl2 (t)→ MnCl2
Проявляет различные степени окисления.
Степень окисления 2+.
Степень окисления 2+. Оксид марганца( II ) – MnO (основный) зеленого цвета .
На воздухе очень быстро окисляется до темно-бурого MnO 2 :
Соли, содержащие катион Mn 2+ как правило имеют бледный светло-розовый цвет .
Катион Mn 2+ обнаруживают гидроксид-ионами, с которыми он образует розовато-белый осадок гидроксида марганца( II ), который окисляется на воздухе и буреет (превращается в бурый оксид марганца( II )):
MnCl 2 + 2 KOH → Mn ( OH ) 2 ↓ + 2 KCl
Сокращенное ионное уравнение:
Mn 2+ + 2 OH — → Mn ( OH ) 2 ↓
Степень окисления 4+. Оксид марганца( IV ) – MnO 2 (амфотерный) т емно-бурый – одно из самых устойчивых и встречаемых соединений марганца.
Mn +4 O 2 + 4 HCl → Mn +2 Cl 2 + Cl 2 ↑ + 2 H 2 O
Степень окисления +6. Оксид марганца( VII ) – Mn 2 O 7 (кислотный) зелено-бурая жидкость.
Очень не стабильное и агрессивное вещество, может спонтанно взорваться. Сильный окислитель.
Оксиду марганца( VII ) соответствует марганцевая кислота HMnO 4 .
Она существует только в водном растворе, который как и растворы ее солей (перманганатов) имеет фиолетово-малиновую окраску .
Перманганаты так же являются сильными окислителями.
В ЕГЭ часто встречаются реакции окисления органических веществ перманганатом калия – это классика:
Приведенное выше уравнение – это качественная реакция на кратные связи – обесцвечивание раствора перманганата и выпадение темно-бурого осадка.
Это весьма необычное вещество. Может быть, трудно представить, но среди всех простых веществ есть только два, которые при нормальных условиях находятся в жидком агрегатном состоянии. Это бром и ртуть.
В нормальных условиях ртуть – серебристо-белая жидкость, с высокой плотностью, поэтому она тонет в воде.
Сама по себе металлическая ртуть вреда не представляет, а вот ее пары и соединения (в особенности органические) чрезвычайно ядовиты.
Качественная реакция на Hg 2+ : при добавлении к раствору соли ртути( II ) щелочи выпадает оранжевый осадок ОКСИДА ртути , гидроксид не образуется, его не существует:
NH 4 + – ион аммония
Если добавить к раствору аммония (иногда нужно нагреть) щелочь образуется нестабильный гидроксид аммония, который разлагается. В ыделяется аммиак – газ с реким запахом (запах нашатырного спирта) :
Можно записать сразу: NH 4 NO 3 + KOH → NH 3 ↑ + H 2 O + KNO 3
Сокращенное ионное уравнение: NH 4 + + NO 3 — → NH 3 ↑ + H 2 O
Выделившийся газ (аммиак) может быть поглощен растворами кислот, с образованием солей аммония: NH 3 + HCl → NH 4 Cl
H +
– частица, в которую превращается атом водорода, отдав электрон.
Получается протон, понятное дело, такая частица в воде не существует.
Частица эта прикреплена по донорно-акцепторному механизму к атому кислорода в молекуле воды, получается ион гидроксония: H 3 O + .
О чем свидетельствует наличие в растворе такого иона?
Конечно же о том, что среда раствора кислая.
А для определения кислотности используют индикаторы.
Рассмотрим несколько индикаторов: лакмус фиолетовый , метиловый оранжевый , фенолфталеин .
Лучше учить названия индикаторов именно так, ведь в таких названиях заключена информации о цвете индикатора в нейтральной среде:
метиловый оранжевый – оранжевый,
| Индикатор | Цвет в кислой среде pH | Цвет в нейтральной среде pH = 7 Цвет в щелочной среде pH > 7 | |
| Лакмус фиолетовый | Красный | Фиолетовый | Синий |
| Метиловый оранжевый | Красный | Оранжевый | Желтый |
| Фенолфталеин | Нет (бесцветный) | Нет (бесцветный) | Малиновый |
Существует несколько мнемонических правил для запоминания цветов индикаторов:
Фенолфталеиновый в щелочах малиновый, но несмотря на это в кислотах он без цвета.
В кислотах лакмус красный – цвет такой прекрасный, а в щелочах он синий как январский иней, а в нейтральной среде фиолетовый, как нигде. (Этот стишок сочинили когда-то мы с товарищем. Хоть он не совсем складный и мы так и не можем объяснить, с чего бы это иней, который обычно белый, в январе вдруг станет синим, стишок как-то по-особенному запал в мою память, всегда им пользуюсь)
Кислота – начинается на букву К, как и слово «кислый» — помогает вспомнить цвет лакмуса и метилоранжа в кислотах.
– элементы VIIA -группы( F , Cl , Br , I ), типичные неметаллы.
Пойдем по порядку:
Фтор – F 2 – желтый газ с легким зеленым отливом. Самый электроотрицательный неметалл, поэтому с кислородом образует не оксид фтора, а фторид кислорода: OF 2 степень окисления кислорода в нем равна +2. Чрезвычайно активное вещество, реагирует со всем, с чем не лень. И большинство реакций протекает бурно, взрывообразно.
Фторид-ионы ( F — ) в растворе определяются добавлением катионов кальция ( Ca 2+ ), наблюдается выпадение белого осадка :
2 KF + CaCl 2 → 2 KCl + CaF 2 ↓
Сокращенное ионное уравнение: Ca 2+ + 2 F — → CaF 2 ↓
- Хлор – Cl 2 – зеленый газ, с характерным резким запахом, сильный яд, тяжелее воздуха (при химической атаке стелется по земле):
Хлорид-ионы ( Cl — ) в растворе определяются добавлением катионов серебра ( Ag + ), наблюдается выпадение белого творожистого осадка (об этой реакции говорилось ранее в разделе серебро):
KCl + AgNO 3 → AgCl ↓ + KNO 3
Сокращенное ионное уравнение: Ag + + Cl — → AgCl ↓
- Бром – Br 2 – красно-бурая летучая жидкость, имеющая очень резкий неприятный запах.
Бромд-ионы ( Br — ) в растворе определяются добавлением катионов серебра ( Ag + ), наблюдается выпадение слегка желтоватого осадка :
KBr + AgNO 3 → AgBr ↓ + KNO 3
Сокращенное ионное уравнение: Ag + + Br — → AgBr ↓
- Иод – I 2 – летучие черно-серые с фиолетовым отливом кристаллы. Пары фиолетовые, имеют характерный запах.
Иодид-ионы ( I — ) в растворе определяются добавлением катионов серебра ( Ag + ), наблюдается выпадение желтоватого осадка (цвет интенсивнее, чем у бромида серебра) :
Сокращенное ионное уравнение: Ag + + I — → AgI ↓
Осадки-галогениды не растворяются в разбавленных кислотах.
Простое вещество сера – хрупкие желтые кристаллы.
Сера может проявлять различные степени окисления:
Степень окисления -2:
в сульфИД-ионе ( S 2- ) и гидросульфИД-ионе ( HS — ).
СульфИДы (и гидросульфИДы) – это соли сероводородной кислоты, которая является слабым электролитом. Поэтому сильные кислоты вытесняют ее из растворов солей. Выделяется H 2 S – сероводород, газ с неприятным запахом тухлых яиц :
K 2 S + 2HCl → 2KCl + H 2 S↑
Сокращенное ионное уравнение: 2 H + + S 2- → H 2 S ↑
Выделившийся газ ( H 2 S ) на воздухе сгорает синим пламенем (не в смысле, что выделился и сразу сгорел, а если начать сжигать):
Так же сероводород ( H 2 S ) может быть поглощен растворами щелочей: H 2 S + 2 NaOH →
Сероводород является хорошим восстановителем, так как сера в нем в низшей степени окисления.
Еще одна особенность ионов S
2- позволяет легко определить их в растворе. Ионы S 2- образуют осадки со многими тяжелыми металлами:
- Классическая реакция с ионами Pb2+ . Образуется черный осадок сульфида серы :
- С ионами Cu 2+ , Fe 2+ , Ni 2+ , Cu 2+ , Pb 2+ , Hg 2+ , Ag + и ионами многих других металлов тоже образуются осадки черного цвета .
- С ионом Zn 2+ образуется белый осадок (один из немногих нечерных нерастворимых сульфидов):
Так как сера в сульфид-ионе в низшей степени окисления, она может окислиться. При действии сильных окислителей на сульфиды они окисляются до сульфатов (как правило). Классическая ЕГЭ-шная реакция, цитата из С2: «…черный осадок побелел после обработки его пероксидом водорода… ». Речь идет о
черном осадке сульфида свинца ( PbS ). Пероксид водорода H 2 O 2 (сильный окислитель) превращает черный сульфид свинца в белый (тоже нерастворимый) сульфат свинца ( PbSO 4 ):
Степень окисления + 4:
встречается в оксиде серы ( IV ) (сернистом газе – SO 2 ), в соответствующей этому оксиду кислоте – сернистой ( H 2 SO 3 , существующей только в растворе) и в солях сернистой кислоты – сульфИТах и гидросульфИТах.
Сернистый газ ( SO 2 ) – бесцветный газ с резким запахом (по легендам – запахом ада). Его можно почувствовать чиркнув спичку. Образуется при сжигании серы, сероводородов, сульфидов, серосодержащих органических веществ. Классическое школьное уточнение: « обесцвечивает раствор фуксина и фиолетовые чернила », при этом совсем не обязательно знать, что такое фуксин, и какие реакции протекают. Просто хорошо бы запомнить эту формулировку.
Так как является кислотным оксидом, реагирует с растворами щелочей. (формулировка из задания ЕГЭ: «…выделившийся газ с резким запахом был поглощен раствором щелочи…» ). Образуются соли сернистой кислоты – сульфиты:
СульфИТ-ионы и гидросульфИТ-ионы в растворе можно обнаружить добавлением сильной кислоты. При этом из раствора сульфита (гидросульфита) вытесняется сернистая кислота: H 2 SO 3 , которая не стабильная, поэтому быстро разлагается на воду и соответствующий оксид ( SO 2 ). То есть, если совсем коротко: при действии на сульфиты и гидросульфиты кислот выделяется SO 2 – газ с резким запахом (обесцвечивающий раствор фуксина и фиолетовые чернила):
Можно (и грамотнее) записать сразу:
Степень окисления +6
встречается в серном ангидриде (оксиде серы( VI ) – SO 3 ), в соответствующей ему серной кислоте ( H 2 SO 4 ) и в ее солях, сульфАТах.
Серный ангидрид ( SO 3 ) и серная кислота( H 2 SO 4 ) содержат серу в высшей степени окисления, поэтому являются сильными окислителями.
Сульфаты в растворе определяются добавлением катионов бария ( Ba 2+ ). Сульфат-ион с катионом бария образует белый осадок ( нерастворимый в кислотах ):
Сокращенное ионное уравнение: Ва 2+ + S O 4 2- → BaS O 4 ↓
CO 3 2-
– карбонат-ион и HCO 3 — – гидрокарбонат-ион
являются анионом слабой, нестабильной, существующей только в растворе, угольной кислоты. Поэтому она легко вытесняется сильными кислотами из растворов солей (карбонатов и гидрокарбонатов).
Вытесняется и тут же распадается на воду и углекислый газ.
При действии кислот на карбонаты выделяется бесцветный газ без вкуса и запаха :
Можно (и грамотнее) записать сразу: K 2 CO 3 + 2 HCl → 2 KCl + CO 2 ↑ + H 2 O
Эта качественная реакция вам хорошо известна, вы наверняка проводили ее у себя дома. Добавим уксус к соде, и как раз будет выделяться газ, в чем можно убедиться если поднести спичку, она погаснет, так как CO 2 не поддерживает горения:
Выделившийся углекислый газ может быть поглощен раствором щелочи:
В связи со способностью поглощаться щелочами для описания углекислого газа часто встречается следующая формулировка: «… газ, при пропускании его через известковую воду, вызвал ее помутнение… ». Известковая вода – это профильтрованный раствор гидроксида кальция (гидроксид кальция полностью не растворяется в воде, образуется взвесь, и чтобы получить прозрачный раствор – его фильтруют, для очищения от не растворившихся частиц гидроксида кальция). При взаимодействии гидроксида кальция с углекислым газом образуется нерастворимый карбонат кальция, который и обеспечивает мутность:
PO 4 3-
– анион ортофосфорной кислоты (H 3 PO 4 ). В растворе его можно определить добавлением катионов серебра , при этом выпадает интенсивно-желтый осадок :
Сокращенное ионное уравнение: 3 Ag + + PO 4 3- → Ag 3 PO 4 ↓
SiO 3 2-
– анион кремниевой кислоты ( H 2 SiO 3 ) , которая являясь слабым электролитом, вытесняется из растворов ее солей. Кроме того, кремниевая кислота малорастврима в воде, поэтому в момент вытеснения ее из раствора соли, появляется гелеобразный осадок – это и будет H 2 SiO 3 :
Кремниевая кислота настолько слабая, что вытесняется даже угольной:
– оксид азота ( VI ).
Ядовитый газ с неприятным запахом бурого цвета.
В ЕГЭ его обычно именно так и обзывают – бурый газ .
Химически очень активное вещество:
- при взаимодействии не очень активных металлов с HNO 3 концентрированной;
- при разложении нитратов этих металлов.
В реакции с водой диспропорционируется, образуя азотную и азотистую кислоты:
Похожая реакция диспропорционирования происходит при растворении NO 2 в щелочах (образуются не кислоты, а соли этих кислот, нитраты и нитриты соответственно):
В присутствии избытка кислорода реакция идет без образования азотистой кислоты (диспропорционирования не происходит):
OH —
Наличие в растворе ионов OH — указывает на щелочную реакцию среды ( pH >7).
Определить pH можно с помощью индикаторов.
Окраски индикаторов в разных средах указаны в пункте про ион H + . Щелочную среду имеют не только щелочи, но и растворы аммиака и аминов, растворы солей, образованных сильными основаниями и слабыми кислотами.
Если нужно определить щелочь, то к раствору надо добавить соль металла, образующего слабое основание. Щелочь с такой солью даст осадок гидроксида металла:
CuCl 2 + 2NaOH → Cu(OH) 2 ↓ + 2NaCl
🎦 Видео
Реакции ионного обмена. 9 класс.Скачать

Реакция ионного обмена. Полное и сокращенное ионное уравнение. Практика. Видеоурок 39. Химия 9 классСкачать

Составление ур-й окислительно-восст. реакций методом ионно-электронного баланса. 1ч. 10 класс.Скачать

Реакции ионного обменаСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА и условия их протекания | Как составлять молекулярные и ионные уравненияСкачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Гидролиз солей. 9 класс.Скачать

Ионные уравнения реакций. Составляем полные и сокращенные ионные уравнения. Часть 1.Скачать

Реакции ионного обмена. Все типы №14Скачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать