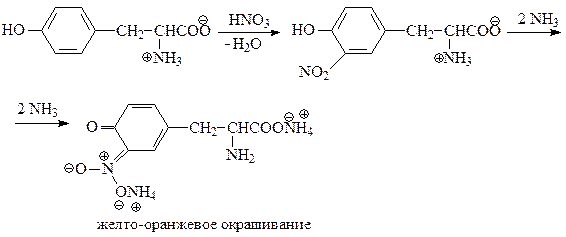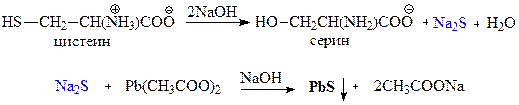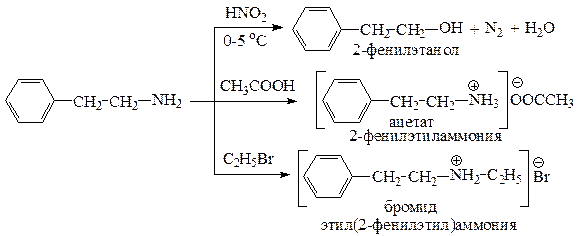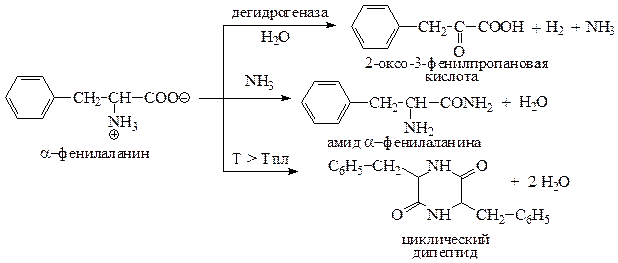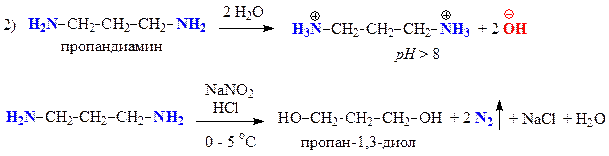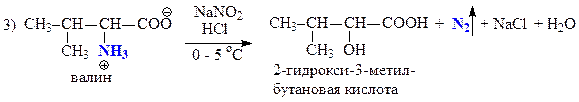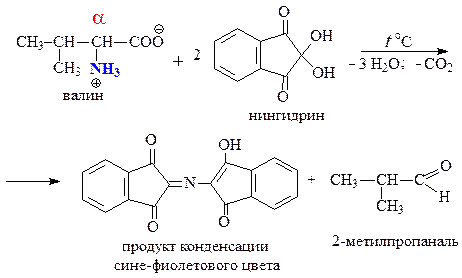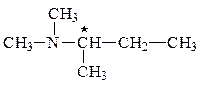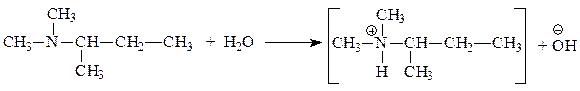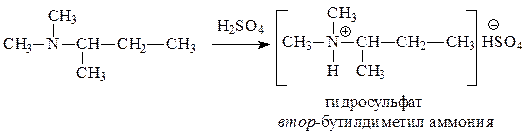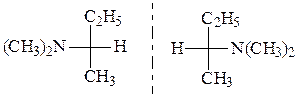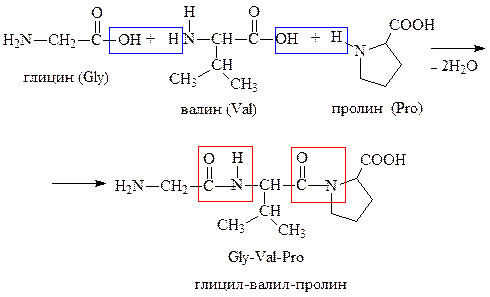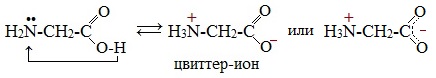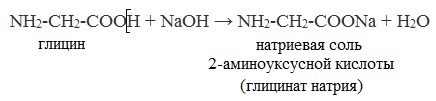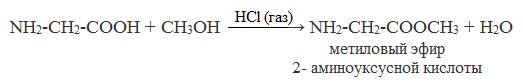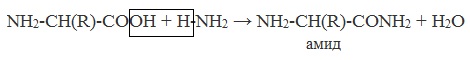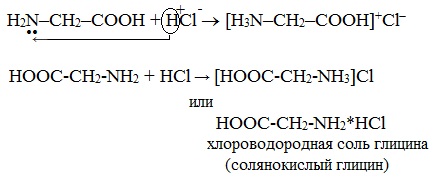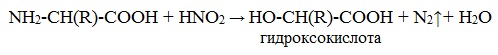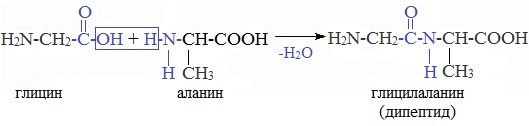1) Нингидриновая реакция — качественная реакция на a-аминокислоты — при взаимодействии с нингидрином происходит окислительное дезаминирование a-аминокислот с образованием продукта конденсации сине-фиолетового цвета.
2) Ксантопротеиновая реакция — качественная реакция на ароматические и гетероциклические аминокислоты — появление желто-оранжевой окраски после добавления аммиака к продукту нитрования ароматического кольца
3) Реакция Фоля — качественная реакция на серосодержащие аминокислоты (цистеин, метионин) — образование черного осадка PbS при добавлении ацетата свинца к продуктам щелочного гидролиза серосодержащих аминокислот.
Решение
Приведем уравнения реакций 2-фенилэтанамина с HNO2; CH3COOH; С2Н5Br.
Приведем уравнения реакций α-фенилаланина с дегидрогеназой; NH3; T > Tпл.
Пример решения задачи 36
Решение
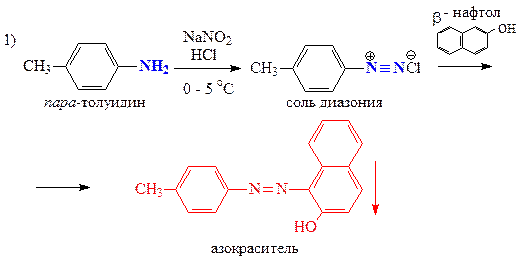
С помощью качественных проб и реакций отличите между собой три вещества пара-толуидин (А), дипропиламин (Б) и валин (В).
А — пара-толуидин — первичный ароматический амин

Б — пропандиамин — первичный алифатический амин
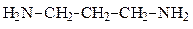
В — валин — алифатическая a-аминокислота
Составим план эксперимента в виде таблицы:
| Опыт | Реагент | Наблюдаемый результат и вывод | |
| Пробирка 1 | Пробирка 2 | Пробирка 3 | |
| Н2О NaNO2+HCl, 0-5 °C + β-нафтол нингидрин | Не растворяется Гомогенный раствор Красно-оранжевое окрашивание — первичная ароматическая аминогруппа Без изменений | Растворяется рН > 8 — сильное основание Выделение газа — первичная алифатическая аминогруппа — Без изменений | Растворяется рН = 5 Выделение газа — первичная алифатическая аминогруппа — Фиолетовое окрашивание — a-аминокислота |
| Общий вывод | пара-толуидин | пропандиамин | валин |
Запишем уравнения соответствующих реакций:
Пример решения задачи 37
Установите строение соединения с молекулярной формулой А, которое соответствует приведенному описанию
| Вариант | Молекулярная формула соединения А | Описание свойств соединения А |
| Х | С6Н15N | а) в водном растворе имеет рН > 8; б) с H2SO4 образует соль; в) алкилируется, но не ацилируется; г) с азотистой кислотой при 0-5 °С заметно не реагирует; д) может существовать в виде энантиомеров |
Сделаем выводы о строении соединения из условия задачи
| Экспериментальный факт | Выводы о строении |
| С6Н15N а) в водном растворе имеет рН > 8; б) с H2SO4 образует соль; в) алкилируется, но не ацилируется; г) с азотистой кислотой при 0-5 °С заметно не реагирует; д) может существовать в виде энантиомеров | насыщенное алифатическое азотсодержащее соединение а) сильные основные свойства — алифатический амин; б) амин; в) алкилируются все амины, но если не ацилируется, значит третичный амин; г) третичный алифатический амин; д) содержит асимметрический С-атом (хиральный центр) |
Искомое вещество является третичным алифатическим амином, содержащим хиральный центр (*):
а) в водном растворе имеет рН > 8:
д) может существовать в виде энантиомеров:
Пример решения задачи 38
Пептиды — это природные или синтетические соединения, молекулы которых построены чаще всего из остатков α-аминокислот, соединённых в цепь пептидными (амидными) связями —C(O)NH-.
Полипептиды состоят из сотен аминокислот, олигопептиды — из небольшого числа аминокислот (от 10 до 50), и простые пептиды до 10.
Решение
Из соответствующих аминокислот (табл. 53) постройте формулу трипептида Gly-Val-Pro. Обозначьте пептидные связи, назовите образованный трипептид.
Перечислм, качественные реакции, которые могут протекать для полученного трипептида:
а) выделение газа при добавлении NaHCO3 — качественная реакция на карбоксильную группу;
б) моментальное выделение газа при добавлении HNO2 при 0-5 °С — качественная реакция на первичную алифатическую аминогруппу;
в) фиолетовое окрашивание при взаимодействии с нингидрином (нингидриновая реакция) — качественная реакция на a-аминокислоты;
г) биуретовая реакция — возникновение синей или розово-фиолетовой окраски при взаимодействии с Сu(OH)2 — качественная реакция на a-аминокислоты и пептидные связи.
- Качественные реакции аминокислот уравнения реакций
- Кислотно-основное равновесие в водных растворах
- 1. Взаимодействие внутри молекулы – образование внутренних солей (биполярных ионов)
- 2. Взаимодействие с основаниями и кислотами
- 3. Внутримолекулярное взаимодействие функциональных групп ε-аминокапроновой кислоты, в результате которого образуется ε-капролактам (полупродукт для получения капрона).
- 4. Межмолекулярное взаимодействие α-аминокислот – образование пептидов (р. поликонденсации)
- 5. Качественные реакции!
- ЦВЕТНЫЕ И ИМЕННЫЕ КАЧЕСТВЕННЫЕ РЕАКЦИИ НА БЕЛКИ
- История химии в школьном курсе
- 📽️ Видео
Видео:Качественные реакции на белки и аминокислоты биохимияСкачать

Качественные реакции аминокислот уравнения реакций
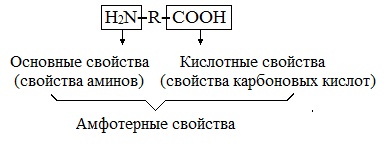
Аминокислоты являются амфотерными соединениями, для них характерны кислотно-основные свойства. Это обусловлено наличием в их молекулах функциональных групп кислотного (-СООН) и основного (-NH2) характера.
Кислотно-основное равновесие в водных растворах
В водных растворах и твердом состоянии аминокислоты существуют в виде внутренних солей.
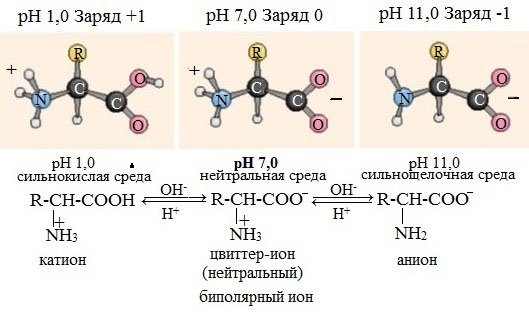
Ионизация молекул аминокислот в водных растворах зависит от кислотного или щелочного характера среды:
В кислой среде молекулы аминокислот представляю собой катион. В щелочной среде молекулы аминокислот представляют собой анион. В нейтральной среде аминокислоты представляют собой цвиттер-ион или биполярный ион.
Аминокислоты в твердом состоянии всегда существуют в виде биполярного, двухзарядного иона — цвиттер-иона.
Водные растворы аминокислот в кислой и щелочной среде проводят электрический ток.
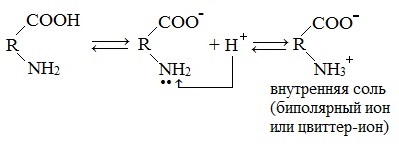
1. Взаимодействие внутри молекулы – образование внутренних солей (биполярных ионов)
Молекулы аминокислот существуют в виде внутренних солей, которые образуются за счет переноса протона от карбоксила к аминогруппе.
Карбоксильная группа аминокислоты отщепляет ион водорода, который затем присоединяется к аминогруппе той же молекулы по месту неподеленной электронной пары азота. В результате действие функциональных групп нейтрализуется, образуется так называемая внутренняя соль.
Водные растворы аминокислот в зависимости от количества функциональных групп имеют нейтральную, кислую или щелочную среду.
Аминокислоты с одной карбоксильной группой и одной аминогруппой имеют нейтральную реакцию.
Видеоопыт «Свойства аминоуксусной кислоты»
а) моноаминомонокарбоновые кислоты (нейтральные кислоты)
Внутримолекулярная нейтрализация — образуется биполярный цвиттер-ион.
Водные растворы моноаминомонокарбоновых кислот нейтральны (рН≈7).
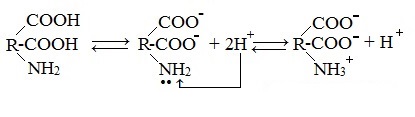
б) моноаминодикарбоновые кислоты (кислые аминокислоты)
Водные растворы моноаминодикарбоновых кислот имеют рН + .
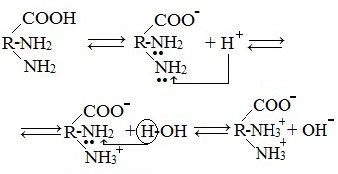
в) диаминомонокарбоновые кислоты (основные аминокислоты)
Водные растворы диаминомонокарбоновых кислот имеют рН>7 (щелочная среда), так как в результате образования внутренних солей этих кислот в растворе появляется избыток гидроксид-ионов ОН — .
2. Взаимодействие с основаниями и кислотами
Аминокислоты как амфотерные соединения образуют соли как с кислотами (по группе NH2), так и со щелочами (по группе СООН).
Как кислота (участвует карбоксильная группа)
Как карбоновые кислоты α-аминокислоты образуют функциональные производные: соли, сложные эфиры, амиды.
а) взаимодействие с основаниями
б) взаимодействие со спиртами (р. этерификации)
Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир. Сложные эфиры аминокислот не имеют биполярной структуры и являются летучими соединениями.
в) взаимодействие с аммиаком
Как основание (участвует аминогруппа)
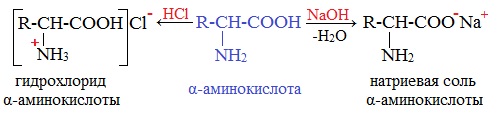
а) взаимодействие с сильными кислотами
Подобно аминам, аминокислоты реагируют с сильными кислотами с образованием солей аммония:
б) взаимодействие с азотистой кислотой (р. дезаминирования)
Подобно первичным аминам, аминокислоты реагируют с азотистой кислотой, при этом аминогруппа превращается в гидроксогруппу, а аминокислота – в гидроксикислоту:
Измерение объёма выделившегося азота позволяет определить количество аминокислоты (метод Ван-Слайка).
3. Внутримолекулярное взаимодействие функциональных групп ε-аминокапроновой кислоты, в результате которого образуется ε-капролактам (полупродукт для получения капрона).
4. Межмолекулярное взаимодействие α-аминокислот – образование пептидов (р. поликонденсации)
При взаимодействии карбоксильной группы одной молекулы аминокислоты и аминогруппы другой молекулы аминокислоты образуются пептиды. При взаимодействии двух α-аминокислот образуется дипептид.
Межмолекулярная реакция с участием трех α-аминокислот приводит к образованию трипептида и т.д.
Важнейшие природные полимеры – белки (протеины) – относятся к полипептидам, т.е представляют собой продукт поликонденсации a-аминокислот.
5. Качественные реакции!
а) нингидриновая реакция
Все аминокислоты окисляются нингидрином с образованием продуктов сине-фиолетового цвета:
Иминокислота пролин дает с нингидрином желтое окрашивание.
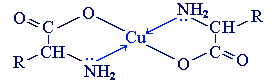
б) с ионами тяжелых металлов α-аминокислоты образуют внутрикомплексные соли. Комплексы меди (II), имеющие глубокую синюю окраску, используются для обнаружения α-аминокислот.
Видеоопыт «Образование медной соли аминоуксусной кислоты»
Видео:Мастер-класс по изучению качественных реакций на белки и отдельные аминокислоты.Скачать

ЦВЕТНЫЕ И ИМЕННЫЕ КАЧЕСТВЕННЫЕ РЕАКЦИИ НА БЕЛКИ
История химии в школьном курсе
РЕАКЦИЯ ПИОТРОВСКОГО (БИУРЕТОВАЯ РЕАКЦИЯ)
В белках аминокислоты связаны друг с другом по типу полипептидов и дикетопиперазинов. Образование полипептидов из аминокислот происходит путем отщепления молекулы воды от аминогруппы одной молекулы аминокислоты и карбоксильной группы другой молекулы:
Образующаяся группа –С(О)–NН– называется пептидной группой, связь С–N, соединяющая остатки млекул аминокислот, – пептидной связью.
При взаимодействии дипептида с новой молекулой аминокислоты получается трипептид и т. д.
Дикетопиперазины образуются при взаимодействии двух молекул аминокислот с отщеплением двух молекул воды:
Дикетопиперазины были выделены из белков Н.Д.Зелинским и В.С.Садиковым в 1923 г.
Наличие в белке повторяющихся пептидных групп подтверждается тем, что белки дают фиолетовое окрашивание при действии небольшого количества раствора медного купороса в присутствии щелочи (биуретовая реакция).
Описание опыта. 2–3 мл раствора белка нагревают с 2–3 мл 20%-го раствора едкого кали или натра и несколькими каплями раствора медного купороса. Появляется фиолетовое окрашивание вследствие образования комплексных соединений меди с белками.
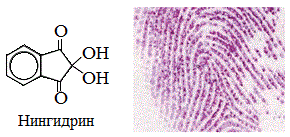
- РЕАКЦИЯ РУЭМАННА (НИНГИДРИНОВАЯ РЕАКЦИЯ (1911))
a -Аминокислоты реагируют с нингидрином, образуя сине-фиолетовый комплекс (пурпур Руэманна), интенсивность окраски которого пропорциональна количеству аминокислоты.
Реакция идет по схеме:
Реакция с нингидрином используется для визуального обнаружения a -аминокислот на хроматограммах (на бумаге, в тонком слое), а также для колориметрического определения концентрации аминокислот по интенсивности окраски продукта реакции.
Описание опыта. В пробирку наливают 1 мл 1%-го раствора глицина и 0,5 мл 1%-го раствора нингидрина. Содержимое пробирки осторожно нагревают до появления сине-фиолетового окрашивания.
- Реакция Сакагучи
Эта реакция на аминокислоту аргинин основана на взаимодействии аргинина с a -нафтолом в присутствии окислителя. Ее механизм еще полностью не выяснен. По-видимому, реакция осуществляется по следующему уравнению:
Поскольку производные хинониминов (в данном случае нафтохинона), у которых водород иминогруппы –NH– замещен на алкильный или арильный радикал, всегда окрашены в желто-красные тона, то, по-видимому, оранжево-красный цвет раствора при проведении реакции Сакагучи объясняется возникновением именно производного нафтохинонимина. Не исключена, однако, вероятность образования еще более сложного соединения за счет дальнейшего окисления оставшихся NH-групп аргининового остатка и бензольного ядра a -нафтола:
Описание опыта. В пробирку наливают 2 мл 0,01%-го раствора аргинина, затем добавляют 2 мл 10%-го раствора едкого натра и несколько капель 0,2% спиртового раствора a -нафтола. Содержимое пробирки хорошо перемешивают, приливают 0,5 мл раствора гипобромита и вновь перемешивают. Немедленно добавляют 1 мл 40%-го раствора мочевины для стабилизации быстро развивающегося оранжево-красного окрашивания.
- РЕАКЦИЯ ФОЛЯ
Это реакция на цистеин и цистин. При щелочном гидролизе «слабосвязанная сера» в цистеине и цистине достаточно легко отщепляется, в результате чего образуется сероводород, который, реагируя со щелочью, дает сульфиды натрия или калия. При добавлении ацетата свинца(II) образуется осадок сульфида свинца(II) серо-черного цвета.
Описание опыта. В пробирку наливают 1 мл раствора цистина, прибавляют 0,5 мл 20%-го раствора гидроксида натрия. Смесь нагревают до кипения, а затем добавляют 0,5 мл раствора ацетата свинца(II). Наблюдается выпадение серо-черного осадка сульфида свинца(II):
- РЕАКЦИЯ С ФОРМАЛЬДЕГИДОМ
При взаимодействии a -аминокислот с формальдегидом образуются относительно устойчивые карбиноламины – N-метилольные производные, содержащие свободную карбоксильную группу, которую затем титруют щелочью:
Эта реакция лежит в основе количественного определения a -аминокислот методом формального титрования (метод Сёренсена).
Описание опыта. В пробирку наливают 5 капель 1%-го раствора глицина и прибавляют 1 каплю индикатора метилового красного. Раствор окрашивается в желтый цвет (нейтральная среда). К полученной смеси добавляют равный объем 40%-го раствора формальдегида (формалин). Появляется красное окрашивание (кислая среда):
- РЕАКЦИЯ Циммермана
Это реакция на аминокислоту глицин.
Описание опыта. К 2 мл 0,1%-го раствора глицина, доведенного добавлением 10%-го раствора щелочи до рН = 8, приливают 0,5 мл водного раствора о-фталевого диальдегида. Реакционная смесь начинает медленно окрашиваться в ярко-зеленый цвет. Через несколько минут выпадает зеленый осадок.
- ОБРАЗОВАНИЕ КОМПЛЕКСОВ С МЕТАЛЛАМИ
a -Аминокислоты образуют с катионами тяжелых металлов внутрикомплексные соли. Со свежеприготовленным гидроксидом меди(II) все a -аминокислоты в мягких условиях дают хорошо кристаллизующиеся внутрикомплексные (хелатные) соли меди(II) синего цвета:
В таких солях ион меди координационными связями соединен с аминогруппами.
Описание опыта. В пробирку наливают 3 мл 3%-го раствора сульфата меди(II), добавляют несколько капель 10%-го раствора гидроксида натрия до образования голубого осадка. К полученному осадку гидроксида меди(II) приливают 0,5 мл концентрированного раствора глицина. При этом образуется темно-синий раствор глицината меди:
- КСАНТОПРОТЕИНОВАЯ РЕАКЦИЯ
Эта реакция используется для обнаружения a -аминокислот, содержащих ароматические радикалы. Тирозин, триптофан, фенилаланин при взаимодействии с концентрированной азотной кислотой образуют нитропроизводные, имеющие желтую окраску. В щелочной среде нитропроизводные этих a -аминокислот дают соли, окрашенные в оранжевый цвет.
Описание опыта. В пробирку наливают 1 мл раствора тирозина и добавляют 0,5 мл концентрированной азотной кислоты. Смесь нагревают до появления желтой окраски. После охлаждения добавляют 1–2 мл 20%-го раствора гидроксида натрия до появления оранжевой окраски раствора:
- ОСАЖДЕНИЕ БЕЛКА СОЛЯМИ ТЯЖеЛЫХ МЕТАЛЛОВ
Описание опыта. В две пробирки наливают по 1–2 мл раствора белка и медленно, при встряхивании, добавляют по каплям в одну пробирку насыщенный раствор сульфата меди, а в другую – 20%-й раствор ацетата свинца. Образуются осадки труднорастворимых солеобразных соединений белка. Опыт иллюстрирует применение белка как противоядия при отравлении солями тяжелых металлов.
- Открытие аминного азота в белках
Описание опыта. В сухую пробирку помещают немного сухого белка, например желатины. Прибавляют пятикратное количество натронной извести (смесь едкого натра и гидроксида кальция), перемешивают встряхиванием и подогревают. Выделяется аммиак, вызывающий посинение розовой лакмусовой бумажки, смоченной водой. Одновременно ощущается запах жженого волоса, что всегда наблюдается при сжигании белковых веществ.
- Открытие серы в белках
Описание опыта. В пробирку наливают около
0,5 мл раствора уксуснокислого свинца и прибавляют раствор едкого кали до растворения образовавшегося осадка гидроксида свинца. В другую пробирку наливают
2–3 мл раствора белка и приливают такой же объем полученного раствора плюмбита. Нагревают смесь до кипения в течение 2–3 мин. Появление темного окрашивания указывает на образование сульфида свинца.
- РЕАКЦИЯ НА ПРИСУТСТВИЕ СЕРОСОДЕРЖАЩИХ a -АМИНОКИСЛОТ В БЕЛКЕ
Качественной реакцией на серосодержащие a -аминокислоты является реакция Фоля. Белки, содержащие остатки цистеина или цистина, также дают эту реакцию.
Описание опыта. В пробирку наливают 10 капель раствора яичного белка и вдвое больший объем 20%-го раствора гидроксида натрия. Содержимое пробирки нагревают до кипения (1–2 мин). К полученному щелочному раствору добавляют 5 капель раствора ацетата свинца(II) и вновь кипятят реакционную смесь. Наблюдается появление серо-черного осадка.
- РЕАКЦИЯ НА ТРИПТОФАН
Триптофан, реагируя в кислой среде с альдегидами, образует окрашенные продукты конденсации. Например, с глиоксиловой кислотой (являющейся примесью к концентрированной уксусной кислоте) реакция протекает по уравнению:
По аналогичной схеме протекает и реакция триптофана с формальдегидом.
В ходе проведенного исследования мы выявили по литературным источникам имеющуюся информацию о цветных качественных реакциях на белковые аминокислоты; выполнили ряд перечисленных реакций и составили базу данных. Эта база может быть использована в школьной практике как в теоретическом плане, так и в практическом, т. к. мы приводим краткие, но подробные описания выполнения всех опытов.
Из предложенных 18 качественных реакций каждая практически осуществима в школьном курсе химии и имеет важное практическое значение. Сопровождение реакций химическими уравнениями конкретизирует и углубляет знания по биологической и органической химии, особенно знания учащихся специализированных биологических и химических классов.
Использованная литература
Ермаков А.Н., Арасимович В.В., Смирнова-Иконникова М.И., Мирри И.К. Методы биохимического исследования растений. М.,1952, 520 с.
Полянская А.С., Шевелева А.О. Методическая разработка по лабораторным работам: «Аминокислоты» и «Белки». Л., 1976, 37 с.
Пустовалова Л.М. Практикум по биохимии. 1999, 541 с.
Руководство к практическим занятиям по органической химии. Под ред. В.М.Родионова. М., 1954, 111 с.
Соловьев Н.А. Лабораторные работы по биологической химии. Методическая разработка. СПб., 1996, 70 с.
Филиппович Ю.Б., Егорова Т.А., Севастьянова Г.А. Практикум по общей биохимии. М., 1982, 311 с.
З.Саитов, С.В.Телешов, Б.Харитонцев,
секция «Юный химик» РХО им. Д.И.Менделеева (г. Тобольск)
📽️ Видео
Качественные реакции на белки в сравнении с реакциями на аминокислоты. Химический опытСкачать

Биохимия. Качественные реакции для определения белков, аминокислот и углеводов (С. Смирнов)Скачать

Реакция Фоля на цистеин и цистинСкачать

Качественные реакции на белкиСкачать

Опыты по химии. Цветные реакции белка: биуретовая; ксантопротеиноваяСкачать

Нингидриновая реакцияСкачать

Качественные реакции на катионы. 9 класс.Скачать

НШ | Химия. Химические свойства белков и качественные реакции на белкиСкачать

Ксантопротеиновая реакцияСкачать

Аминокислоты. Получение. Все 6 реакций ЕГЭ.Скачать

Видеоурок «Качественные реакции в химии»Скачать

качественные реакции на белокСкачать

108. Химические свойства аминокислотСкачать

ЛЕКЦИЯ 4. АМИНОКИСЛОТЫ, БЕЛКИСкачать

Аминокислоты. Реакции декарбоксилирования. БиохимияСкачать

Опыты по химии. Аминокислоты: агрегатное состояние; отношение к воде; отношение к индикаторуСкачать

Ninhydrin Reaction (Нингидриновая реакция на α-аминокислоты)Скачать

10 класс Качественные реакции на белкиСкачать