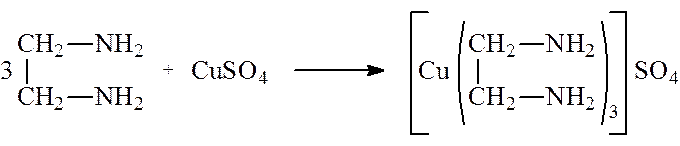В соответствии с ГФ Х издания я провела следующие реакции:
1. Мурексидная проба;
2. Реакция с хлоридом кобальта;
3. Реакция определения этилендиамина.
Я анализировала эуфиллин четырех производителей.
1. Производитель ФГУП «НПО» «Микроген» Минздрава России.
— Мурексидная проба: 1 мл эуфиллина я поместила в фарфоровую чашку, прибавила 10 капель пергидроля, 10 капель соляной кислоты разведенной, затем выпаривала на водяной бане досуха. Остаток смочила двумя каплями гидроксида аммония, появилось пурпурно-красное окрашивание.
 |
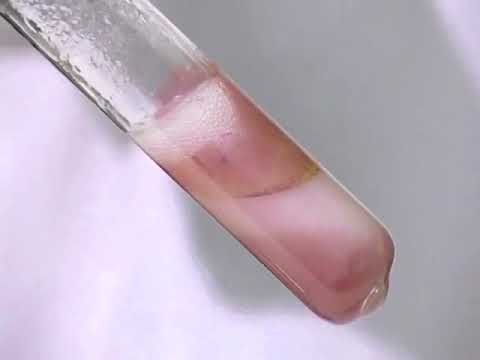
— Реакция с хлоридом кобальта: 1 мл препарата встряхивала 2 минуты с 2 мл 0,1н раствора гидроксида натрия. К полученному раствору прибавила 3 капли раствора хлорида кобальта. Появился осадок бело-розового цвета.
— Определение этиледиамина: к 1 мл препарата прибавила 4 мл воды. К 3 мл этого раствора прибавила 5 капель сульфата меди. Появилось фиолетовое окрашивание.
2. Производитель: ФГУП «Армавирская биофабрика.
— Мурексидная проба: 1 мл эуфиллина я поместила в фарфоровую чашку, прибавила 10 капель пергидроля, 10 капель соляной кислоты разведенной, затем выпаривала на водяной бане досуха. Остаток смочила двумя каплями гидроксида аммония, появилось пурпурно-красное окрашивание.
— Реакция с хлоридом кобальта: 1 мл препарата встряхивала 2 минуты с 2 мл 0,1н раствора гидроксида натрия. К полученному раствору прибавила 3 капли раствора хлорида кобальта. Появился осадок бело-розового цвета.
— Определение этиледиамина: к 1 мл препарата прибавила 4 мл воды. К 3 мл этого раствора прибавила 5 капель сульфата меди. Появилось фиолетовое окрашивание.
3. Производитель: Шаньдун Шэнлу Фармасьютикал Китай.
— Реакция с хлоридом кобальта: 1 мл препарата встряхивала 2 минуты с 2 мл 0,1н раствора гидроксида натрия. К полученному раствору прибавила 3 капли раствора хлорида кобальта. Появился осадок бело-розового цвета.
— Определение этиледиамина: к 1 мл препарата прибавила 4 мл воды. К 3 мл этого раствора прибавила 5 капель сульфата меди. Появилось фиолетовое окрашивание.
4. Производитель: ОАО «Дальхимфарм» г. Хабары.
— Мурексидная проба: 1 мл эуфиллина я поместила в фарфоровую чашку, прибавила 10 капель пергидроля, 10 капель соляной кислоты разведенной, затем выпаривала на водяной бане досуха. Остаток смочила двумя каплями гидроксида аммония, появилось пурпурно-красное окрашивание.
— Реакция с хлоридом кобальта: 1 мл препарата встряхивала 2 минуты с 2 мл 0,1н раствора гидроксида натрия. К полученному раствору прибавила 3 капли раствора хлорида кобальта. Появился осадок бело-розового цвета.
— Определение этилендиамина: к 1 мл препарата прибавила 4 мл воды. К 3 мл этого раствора прибавила 5 капель сульфата меди. Появилось фиолетовое окрашивание.
После проведения качественных реакций можно сделать вывод, что эуфиллин соответствует требованиям ГФ Х издания.
Видео:Кобальт. Химические и физические свойства. ПолучениеСкачать

КАЧЕСТВЕННЫЕ РЕАКЦИИ ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ
Антипирин в своем составе содержит ядро пиразолона. С азотистой кислотой антипирин дает изумрудно – зеленое окрашивание. Эта реакция обусловлена тем, что атом водорода у четвертого атома пиразольного кольца, вообще отличающийся большой подвижностью, легко замещается нитрозогруппой, т.е. происходит нитрозирование антипирина:
| |
 |
|
|
|
|
|
|
|
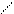
|
|
|
|
|
Эту реакцию используют в аналитической химии и в фарманализе для определения нитритов.
С раствором хлорида железа (III) антипирин дает красное окрашивание, которое обусловлено образованием окрашенного в красный цвет комплексного соединения антипирина с хлоридом железа (III) – ферропирина.
Никотиновая кислота ( пиридин – 3 –карбоновая кислота ) является провитамином РР.
Качественную реакцию на никотиновую кислоту проводят при кипячении с раствором СиSО4, выпадает осадок интенсивно – синего цвета никотинат меди (II)
 |
 |
|

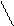
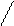
|
|
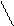
|
2 + СuSО4 → + Н2SО4,


|
|
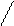
|

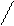

|
+ СuSO4 + 2NH4SCN → Cu (SCN)2 +
тетраникотинатмеди (II) роданид
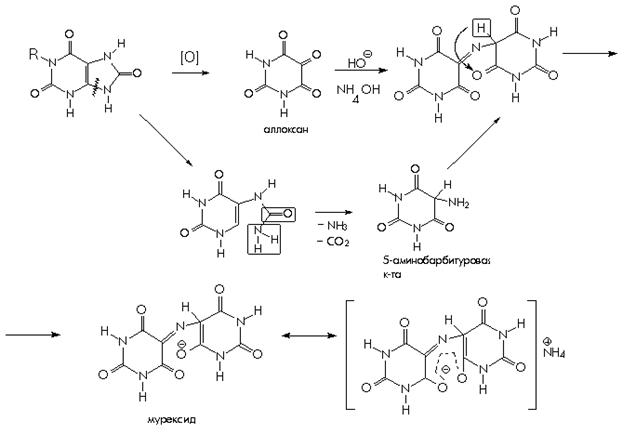
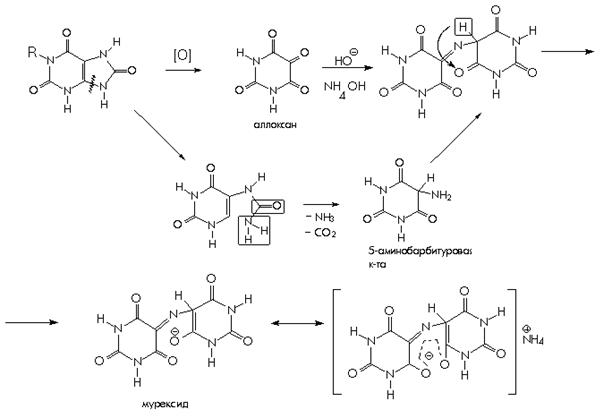
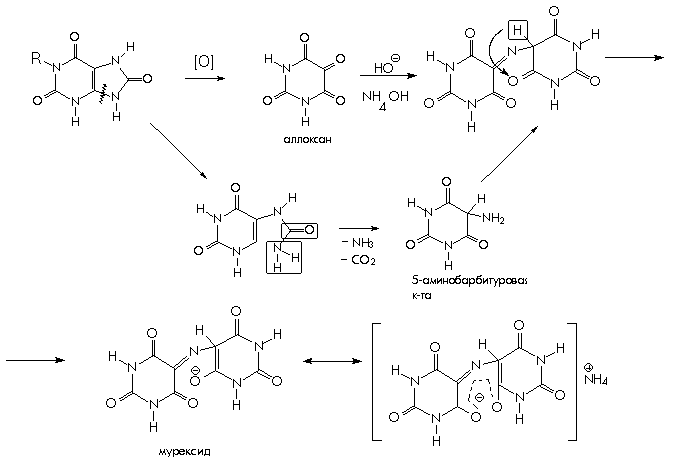
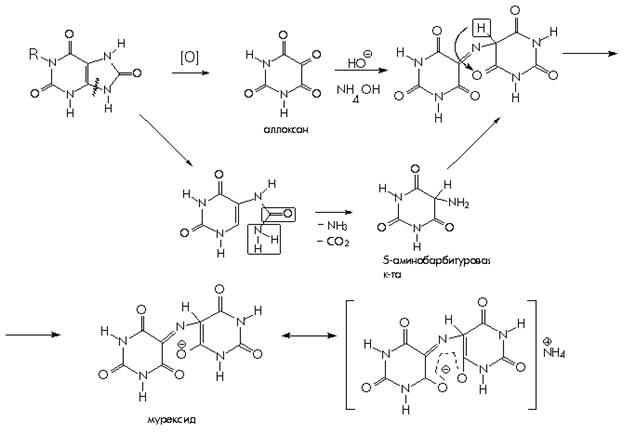
Из пуриновых производных рассмотрим качественные реакции на теобромин, теофиллин, кофеин. Общей качественной реакцией для обнаружения ксантинов является мурексидная проба. Эта реакция достаточно сложна, она основана на окислении ксантинов азотной кислотой. Продукт окисления при взаимодействии с аммиаком образует аммониевую соль пурпуровой кислоты, называемую мурескидом, пурпурно – красного цвета.
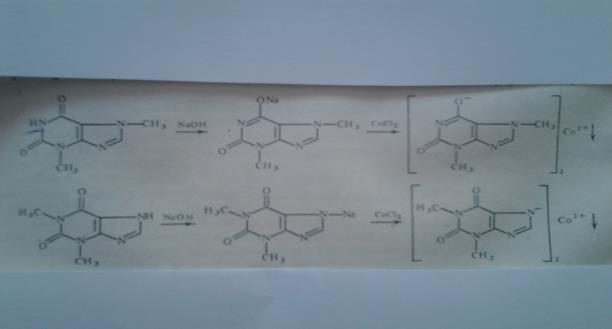
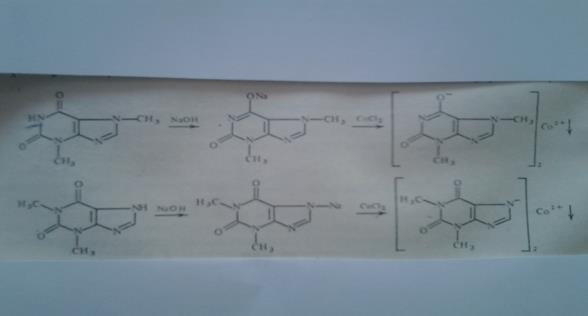
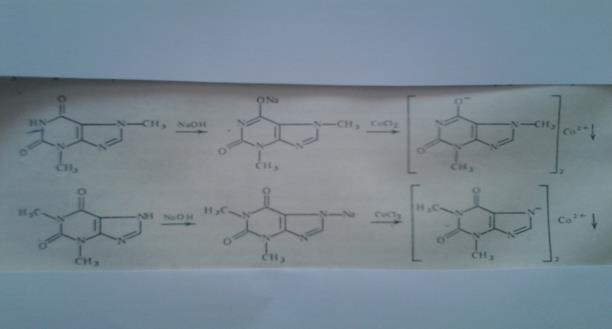
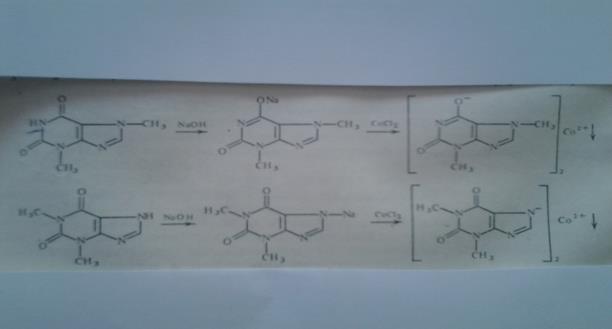
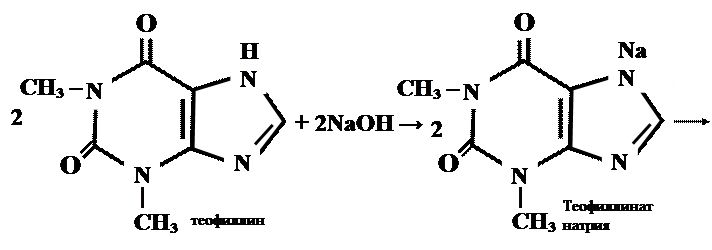
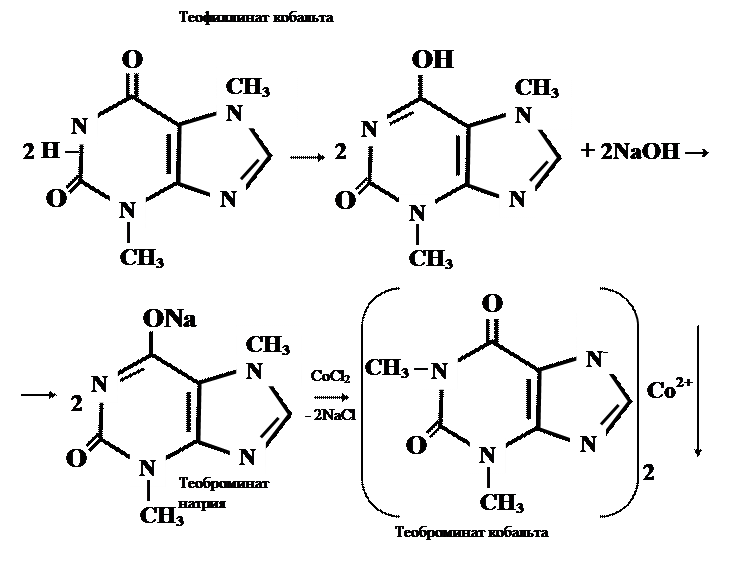
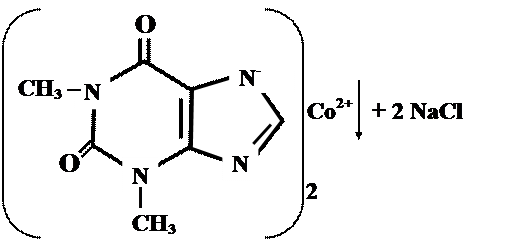
Реакции солеобразования используются в качественном анализе метилированных ксантинов. Теофиллин и теобромин в щелочной среде образуют с хлоридом кобальта (11) нерастворимые соли соответственно серо – голубого или розоватого цвета.
 |
 |
Кофеин, у которого метилированы все атомы азота, кислотных свойств не проявляет и не вступает во взаимодействие с хлоридом кобальта (11). Благодаря своим основным свойствам кофеин образует с танином — природным веществом кислотного характера – нерастворимую соль белого цвета таннат кофеина.
+ танин → таннат кофеина ↓
1.Н.А.Тюкавкина, Ю.И.Бауков «Биоорганическая химия», Москва, ДРОФА, 2004г.
2.Л.М.Пустовалова «Органическая химия», Ростов-на-Дону, «ФЕНИКС», 2005г.
3.Е.В.Барклвский, С.В.Ткачев «Аналитическая химия», Минск, «Вышэйшая школа» 2004г.
4. «Качественный анализ анионов», методическое пособие по самостоятельной внеаудиторной подготовке студентов заочного и очного факультетов, Пермь – 2007г.
5. «ХИМИЯ», Научное издательство «Большая Российская энциклопедия», Москва, 1998г.
6.Б.Н.Степаненко «Органическая химия», изд-во «Медицина», Москва, 1980г.
Видео:Качественная реакция на ион трехвалентного железаСкачать

Качественная реакция на теофиллин с хлоридом кобальта 2 уравнение
Методы качественного определения пуриновых алкалоидов
Общие способы идентификации
1. Мурексидная проба. Общегрупповая реакция на пурины, основанная на окислительно-гибролитическом разложении веществ группы ксантина до производных пиримидина. Для проведения реакции препарат нагревают на водяной бане с окислителем(H2O2, Br2, HNO3) в кислой сореде. Затем добавляют раствор аммиака – появляется пурпурно-красное окрашивание.
На примере мочевой кислоты:
Для мочевой кислоты нагревание производят с концентрированной азотной кислотой. В случае метилированных производных ксантина вместо азотной кислоты применяют раствор перекиси водорода в солянокислой среде.
2. Электрофильное замещение после щелочного гидролиза. При значении pH свыше 9 происходит разложение кофеина до кофеиндикарбоновой кислоты, которая разлагается до кофеидина и соответствующего карбоната.
В сернокислой среде кофеин может разлогаться до муравьиной кислоты. Теофиллидин, полученный в такой же реакции с теофиллином, может быть идентифицирован по образованию азокрасителя.
3. Реакция с реактивом Вагнера.
При нагревании в 0,5-1,0 мл воды, прибавляют 1-2 капли раствора йода 0,1 моль/л, 1-2 капли разведенной хлористоводородной кислоты и наблюдают оранжево-красный или кирпично-красный осадок.
4. Реакция с танином.
К навеске препарата прибавляют по каплям 0,1% раствор танина и наблюдают беловатый или желтоватый аморфный осадок, растворимый в избытке реактива.
5. Реакция с хлоридом ртути(II). Общая для кофеина, теобромина, теофиллина реакция с хлоридом ртути(II); образуется белый кристаллический осадок, представляющий собой комплексное соединение, включающее оба вещества в эквимолярном соотношении.
Частные способы идентификации
1. Определяют Тпл. (234° — 239°С), ИК-спектральные характеристики.
2. Реакция с ацетилацетоном и диметиламинобензальдегидом. Раствор субстанции в смеси ацетилацетона и раствора натрия гидроксида разведенного нагревают на водяной бане, охлаждают и прибавляют раствор диметиламинобензальдегида и еще раз нагревают. Охлаждают и прибавляют воду — появляется интенсивное синее окрашивание:
3. Реакция с раствором калия йодида йодированным в присутствии кислоты хлористоводородной разведенной — появляется коричневый осадок, который растворяется при добавлении раствора натрия гидроксида.
4. Потеря в массе при высушивании не должна превышать 0,5 % — в отличие от кофеина моногидрата.
1. Остаток бензойной кислоты в кофеин-бензоате натрия определяют по осадку телесного цвета в реакции с хлоридом железа(III).
2. Препарат подкисляют уксусной кислотой, если нужно, фильтруют, прибавляют цинк-уранил-ацетат – образуется желтый кристаллический осадок.
3. Препарат внесенный в пламя, окрашевает его в желтый цвет.
1. Реакция его натриевой соли, полученной при взаимодействии щелочи с избытком теобромина (используется фильтрат) с раствором CоCl2 — появляется быстро исчезающее интенсивное фиолетовое окрашивание и образуется осадок серовато — голубого цвета:
2. Реакция натриевой соли теобромина с раствором AgNО3 – образуется коричневая густая желатинообразная масса (серебрянная соль), которая разжижается при нагревании до 60-80°С и снова застывает при охлаждении.
Теофиллин:1. Со щелочным раствором нитропруссида натрия — образуется зеленое
окрашивание, исчезающее при добавлении избытка кислоты.
🔍 Видео
Качественная реакция на фенол (С ХЛОРИДОМ ЖЕЛЕЗА 3)Скачать

Магнетит - Fe3O4. Реакция Сульфата Железа(2), Хлорида Железа(3) и Гидроксида Натрия.Скачать

Качественная реакция ионов хрома(III) со щелочью. Получение и свойства гидроксида хромаСкачать

Реакция замещения меди железом в растворе сульфата или хлорида меди IIСкачать

Качественная реакция на сульфат- и карбонат-ионы.Скачать

Качественная реакция на этанолСкачать

Обнаружение Танинов (Дубильных Веществ) В Чае.Скачать

Качественная реакция ионов алюминия с гидрофосфатом натрияСкачать

Реакция Роданида Калия и Сульфата Меди. Роданид Меди - Cu(CNS)2. Реакция CuSO4, KSCN.Скачать

Качественные реакции для обнаружения этанола, фенола и многоатомных спиртовСкачать

Получение хлорида железа 3Скачать

Получил ХЛОРАТ калия из поваренной солиСкачать

Качественные реакции на органические соединенияСкачать
42. Зависимость скорости реакции тиосульфата натрия с серной кислотой от концентрации реагентовСкачать

Роданит калия и хлорид железа |||Скачать

Качественные реакции на двойную связьСкачать

Fe + 2HCl → FeCl2 + H2 | Реакция взаимодействия железа и хлороводородаСкачать

Стандартизация раствора натрия тиосульфата по калия дихроматуСкачать