- Презентация к уроку
- Правила ТБ при работе в кабинете химии
- Что такое сода пищевая
- Домашнее задание
- Гидрокарбонат натрия: формула, состав, применение
- Отличие кислой соли от средней
- Физические свойства пищевой соды
- Безопасность пищевой соды для человека
- Гидрокарбонат натрия: формула соединения
- Строение вещества
- Растворимость питьевой соды в воде
- Реакция обмена с другими солями
- Взаимодействие питьевой соды с кислотами
- Получение пищевой соды
- Где используется гидрокарбонат натрия? Применение пищевой соды в медицине
- Использование пищевой соды в быту
- Карбонат натрия: способы получения и химические свойства
- Способ получения
- Качественная реакция
- Химические свойства
- 📺 Видео
Презентация к уроку
Загрузить презентацию (315 кБ)
Цель урока: формировать у обучающихся:
- знания о соде, как о химическом веществе, формулы соды, качественные реакции на соду;
- умения анализировать, сравнивать и рассуждать;
- умение оценивать свою деятельность;
- коммуникативные навыки, слушать друг друга, работать в коллективе, высказывать свою точку зрения и аргументировать ее.
Правила ТБ при работе в кабинете химии
1. К проведению эксперимента приступать только с разрешения учителя.
2. Внимательно читать этикетку на емкости с веществом.
3. Брать только то количество, которое требуется.
4. Не направлять к лицу отверстие пробки во время нагревания жидкости.
5. Нюхать химические вещества, не наклоняясь над пробиркой, а направляя к себе воздух рукой.
6. Никакие вещества нельзя пробовать на вкус.
Решение задачи на установление молекулярной формулы соды.
Найдите химическую формулу вещества, в состав которого входит 27,4 % натрия, 1,2 % водорода, 14,3 % углерода и 57,1 % кислорода.
Дайте название неизвестному веществу.
К какому классу соединений относится это вещество?
Что такое сода пищевая
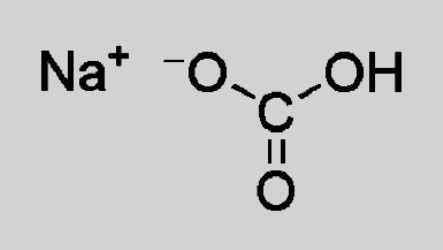
Из энциклопедии по химии: Пищевая сода – это химическое вещество в виде щелочи. На языке химии пищевая сода записывается так — NaHCO3 (гидрокарбонат натрия). Другое её название – бикарбонат натрия, кислая соль угольной кислоты.
Из толкового словаря Ожегова С.И.: Сода — белое щелочное кристаллическое вещество. От слова «сода» образуются прилагательные: содовый, содовая, содовое.
Например, содовая вода (газированная вода с раствором питьевой соды).
Домашнее задание
Уровень А: Поиск информации: «Методы получение соды».
Уровень Б: Поиск информации: «Химические свойства соды».
Уровень В: Написать уравнения реакции соды с:
- с металлами;
- с кислотами;
- термического разложения соды.
Видео:Реакция соды и лимонной кислоты (Citric Acid & Soda)Скачать

Гидрокарбонат натрия: формула, состав, применение
Пищевая, или питьевая сода, — широко известное в медицине, кулинарии и бытовом потреблении соединение. Это кислая соль, молекула которой образована положительно заряженными ионами натрия и водорода, анионом кислотного остатка угольной кислоты. Химическое название соды — бикарбонат или гидрокарбонат натрия. Формула соединения по системе Хилла: CHNaO3 (брутто-формула).
Видео:7 ПРОСТЫХ ХИМИЧЕСКИХ ОПЫТОВ ДЛЯ ДОМА!Скачать

Отличие кислой соли от средней
Угольная кислота образуют две группы солей — карбонаты (средние) и гидрокарбонаты (кислые). Тривиальное название карбонатов — соды — появилось еще в древности. Следует различать среднюю и кислую соли по названиям, формулам и свойствам.
Na2CO3 — карбонат натрия, динатриевая соль угольной кислоты, кальцинированная стиральная сода. Служит сырьем для получения стекла, бумаги, мыла, используется как моющее средство.
NaHCO3 — натрия гидрокарбонат. Состав подсказывает, что вещество является мононатриевой солью угольной кислоты. Это соединение отличается наличием двух разных положительных ионов — Na + и Н + . Внешне кристаллические белые вещества похожи, их трудно отличить друг от друга.
Вещество NaHCO3 считается питьевой содой не потому, что употребляется внутрь для утоления жажды. Хотя с помощью этого вещества можно приготовить шипучий напиток. Раствор этого гидрокарбоната принимают внутрь при повышенной кислотности желудочного сока. При этом происходит нейтрализация избытка протонов Н + , которые раздражают стенки желудка, вызывают боль и жжение.
Видео:Химический видео Опыт Сода+ Уксус. Уравнение реакций. Простой опыт по ХИМИИ.Скачать

Физические свойства пищевой соды
Бикарбонат — это белые моноклинные кристаллы. В составе этого соединения присутствуют атомы натрия (Na), водорода (Н), углерода (С) и кислорода. Плотность вещества составляет 2,16 г/см3. Температура плавления — 50–60 °С. Натрия гидрокарбонат — порошок молочно-белого цвета — твердое мелкокристаллическое соединение, растворимое в воде. Питьевая сода не горит, а при нагревании свыше 70 °С разлагается на карбонат натрия, углекислый газ и воду. В производственных условиях чаще применяется гранулированный бикарбонат.
Видео:ДЕЙСТВИЕ СОДЫ НА ОРГАНИЗМ || СОДА при изжоге, для поддержания pH. Ацидоз и алкалоз, ощелачиваниеСкачать

Безопасность пищевой соды для человека
Соединение не обладает запахом, его вкус — горько-соленый. Однако не рекомендуется нюхать и пробовать вещество на вкус. Вдыхание гидрокарбоната натрия может вызвать чихание и кашель. Одно из применений основано на способности пищевой соды нейтрализовать пахнущие вещества. Порошком можно обработать спортивную обувь, чтобы избавиться от неприятного запаха.
Питьевая сода (гидрокарбонат натрия) — безвредное вещество при контакте с кожей, но в твердом виде может вызвать раздражение слизистой оболочки глаз и пищевода. В низких концентрациях раствор не токсичен, его можно принимать внутрь.
Видео:Что будет, если пить соду по утрам каждый день?Скачать

Гидрокарбонат натрия: формула соединения
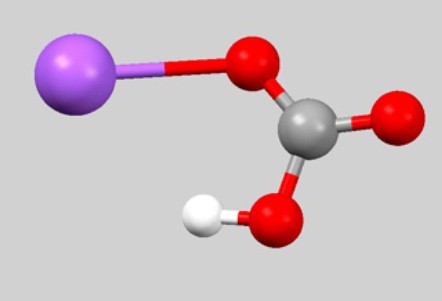
Брутто-формула CHNaO3 редко встречается в уравнениях химических реакций. Дело в том, что она не отображает связь между частицами, которые образуют гидрокарбонат натрия. Формула, обычно используемая для характеристики физических и химических свойств вещества, — NaHCO3. Взаимное расположение атомов отражает шаро-стержневая модель молекулы:
Если узнать из периодической системы значения атомных масс натрия, кислорода, углерода и водорода. то можно подсчитать молярную массу вещества гидрокарбонат натрия (формула NaHCO3):
Ar(Na) — 23;
Ar(O) — 16;
Ar(C) — 12;
Ar(H) — 1;
М (CHNaO3) = 84 г/моль.
Видео:Пищевая сода опасна! (русская озвучка)Скачать

Строение вещества
Гидрокарбонат натрия — ионное соединение. В состав кристаллической решетки входит катион натрия Na + , замещающий в угольной кислоте один атом водорода. Состав и заряд аниона — НСО3 – . При растворении происходит частичная диссоциация на ионы, которые образуют гидрокарбонат натрия. Формула, отражающая структурные особенности, выглядит так:
Видео:Эксперимент с уксусом и содой.Скачать

Растворимость питьевой соды в воде
В 100 г воды растворяется 7,8 г гидрокарбоната натрия. Вещество подвергается гидролизу:
NaHCO3 = Na + + НСО3 – ;
Н2О ↔ Н + + ОН – ;
НСО3 – + Н + = Н2О + СО2↑.
При суммировании уравнений выясняется, что в растворе накапливают гидроксид-ионы (слабощелочная реакция). Жидкость окрашивает фенолфталеин в розовый цвет. Окраска универсальных индикаторов в виде бумажных полосок в растворе соды меняется с желто-оранжевой на серую или синюю.
Видео:Качественная реакция на углекислый газСкачать

Реакция обмена с другими солями
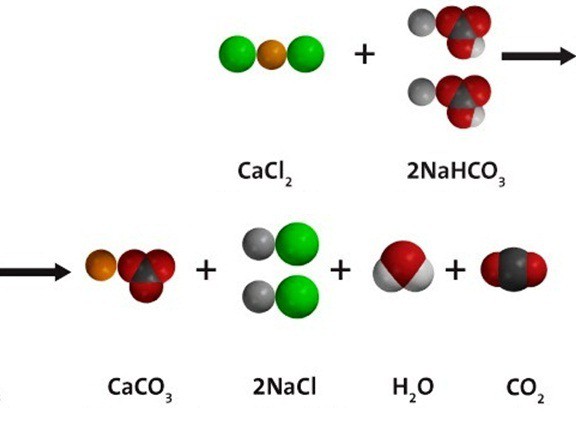
Водный раствор гидрокарбоната натрия вступает в реакции ионного обмена с другими солями при условии, что одно из вновь получившихся веществ — нерастворимое; либо образуется газ, который удаляется из сферы реакции. При взаимодействии с хлоридом кальция, как показано на схеме ниже по тексту, получается и белый осадок сарбоната кальция, и углекислый газ. В растворе остаются ионы натрия и хлора. Молекулярное уравнение реакции:
Видео:Опыт с уксусом и содойСкачать

Взаимодействие питьевой соды с кислотами
Гидрокарбонат натрия взаимодействует с кислотами. Реакция ионного обмена сопровождается образованием соли и слабой угольной кислоты. В момент получения она разлагается на воду и углекислый газ (улетучивается).
Стенки желудка человека вырабатывают соляную кислоту, существующую в виде ионов
Н + и Cl – . Если принимать внутрь натрия гидрокарбонат, реакции происходят в растворе желудочного сока с участием ионов:
NaHCO3 = Na + + НСО3 – ;
HCl = Н + + Cl – ;
Н2О ↔ Н+ + ОН – ;
НСО3 – + Н + = Н2О + СО2↑.
Врачи не рекомендуют постоянно использовать при повышенной кислотности желудка гидрокарбонат натрия. Инструкция к препаратам перечисляет различные побочные действия ежедневного и длительного приема питьевой соды:
- повышение давления крови;
- отрыжка, тошнота и рвота;
- тревожность, плохой сон;
- снижение аппетита;
- боли в животе.
Видео:Самые красивые химические реакции - образование Сu(OH)₂Скачать

Получение пищевой соды
В лаборатории бикарбонат натрия можно получить из кальцинированной соды. Такой же метод применялся раньше в химическом производстве. Современный промышленный способ основан на взаимодействии аммиака с углекислым газом и слабой растворимости питьевой соды в холодной воде. Через раствор хлорида натрия пропускают аммиак и диоксид углерода (углекислый газ). Образуются хлорид аммония и раствор гидрокарбоната натрия. При охлаждении растворимость питьевой соды понижается, тогда вещество легко отделяется с помощью фильтрования.
Видео:Нужно ли гасить СОДУ кипятком? Что происходит с содой при нагреве выше 60°C? Научное обоснование!Скачать

Где используется гидрокарбонат натрия? Применение пищевой соды в медицине
Многим известно, что атомы металлического натрия энергично взаимодействуют с водой, даже ее парами в воздухе. Реакция начинается активно и сопровождается выделением большого количества теплоты (горением). В отличие от атомов, ионы натрия — стабильные частицы, не наносящие вреда живому организму. Наоборот, они принимают активное участие в регуляции его функций.
Как используется неядовитое для человека и полезное во многих отношениях вещество — гидрокарбонат натрия? Применение основано на физических и химических свойствах питьевой соды. Важнейшие направления — бытовое потребление, пищевая промышленность, здравоохранение, народная медицина, получение напитков.
Среди основных свойств бикарбоната натрия — нейтрализация повышенной кислотности желудочного сока, кратковременное устранение болевого синдрома при гиперацидности желудочного сока, язвенной болезни желудка и 12-перстной кишки. Антисептическое действие раствора питьевой соды применяется при лечении боли в горле, кашля, интоксикации, морской болезни. Промывают им полости рта и носа, слизистые оболочки глаз.
Широко используются разные лекарственные формы бикарбоната натрия, например порошки, которые растворяют и применяют для инфузий. Назначают растворы для приема пациентами внутрь, промывают ожоги кислотами. Для изготовления таблеток и ректальных суппозиториев также используется гидрокарбонат натрия. Инструкция к препаратам содержит подробное описание фармакологического действия, показаний. Список противопоказаний очень короткий — индивидуальная непереносимость вещества.
Видео:Надо ли "гасить" соду кипятком и другие вопросы.Скачать

Использование пищевой соды в быту
Гидрокарбонат натрия — это «скорая помощь» при изжоге и отравлении. С помощью питьевой соды в домашних условиях отбеливают зубы, уменьшают воспаление при угревой болезни, протирают кожу для удаления избытка жирного секрета. Бикарбонат натрия смягчает воду, помогает очистить загрязнения с разных поверхностей.
При ручной стирке вещей из шерстяного трикотажа можно добавить в воду питьевую соду. Это вещество освежает цвет ткани и удаляет запах пота. Нередко при глажении изделий из шелка появляются желтые подпалины от утюга. В таком случае поможет кашица из питьевой соды и воды. Вещества надо как можно быстрее смешать и нанести на пятно. Когда кашица подсохнет, ее следует почистить щеткой, а изделие прополоскать в холодной воде.
В реакции с уксусной кислотой получается ацетат натрия и бурно выделяется углекислый газ, вспенивающий всю массу: NaHCO3 + СН3СООН = Na + + СН3СОО – + Н2О + СО2↑. Этот процесс идет всякий раз, когда при изготовлении шипучих напитков и кондитерских изделий питьевую соду «гасят» уксусом.
Вкус выпечки будет нежнее, если использовать не магазинный синтетический уксус, а сок лимона. На крайний случай можно заменить его смесью 1/2 ч. л. порошка лимонной кислоты и 1 ст. л. воды. Питьевая сода с кислотой добавляется в тесто в числе последних ингредиентов, чтобы можно было сразу ставить выпечку в духовку. Кроме бикарбоната натрия, иногда в качестве разрыхлителя используется гидрокарбонат аммония.
Видео:ВСЕ качественные реакции в ЕГЭ за 4 часа | Химия ЕГЭ | УмскулСкачать

Карбонат натрия: способы получения и химические свойства
Карбонат натрия Na2CO3 — соль щелочного металла натрия и угольной кислоты. Белое вещество, плавится без разложения, при дальнейшем нагревании разлагается.
Относительная молекулярная масса Mr = 105,99; относительная плотность для тв. и ж. состояния d = 2,539; tпл = 851º C;
Видео:СОДА ПО НЕУМЫВАКИНУ. ПЬЮ 14 ДНЕЙ. ВОТ ТАКИЕ ИЗМЕНЕНИЯСкачать

Способ получения
1. Карбонат натрия можно получить путем взаимодействия оксида натрия и углекислого газа:
2. В результате взаимодействия концентрированного раствора гидроксида натрия и углекислого газа образуется карбонат натрия и вода:
3. При взаимодействии гидрокарбоната натрия и концентрированного раствора гидроксида натрия образуется карбонат натрия и вода:
Видео:Карбонат натрия из пищевой содыСкачать

Качественная реакция
Качественная реакция на карбонат натрия — взаимодействие его с раствором сильных кислот. В результате реакции происходит бурное выделение углекислого газа, образование которого можно проверить, если пропустить его через известковую воду, которая мутнеет из-за образования осадка:
1. При взаимодействии с хлороводородной кислотой, карбонат натрия образует хлорид натрия, углекислый газ и воду:
2. Взаимодействуя с серной кислотой, карбонат натрия образует углекислый газ и воду, а также сульфат натрия:
Видео:Отрыжка, тошнота, понос после ПИТЬЯ СОДЫ. Как не навредить себе?Скачать

Химические свойства
1. Карбонат натрия может реагировать с простыми веществами :
1.1. Карбонат натрия при 900–1000º C реагирует с углеродом . При этом образуется натрий и угарный газ:
Na2CO3 + 2C(кокс) = Na + 3CO
1.2. С хлором концентрированный и горячий раствор карбоната натрия реагирует с образованием хлорида натрия, хлората натрия и углекислого газа:
2. Карбонат натрия вступает в реакцию со многими сложными веществами :
2.1. Насыщенный карбонат натрия реагирует при 30–40º C с водой и углекислым газом, образуя осадок гидрокарбоната натрия:
2.2. Карбонат натрия может реагировать с насыщенным гидроксидом кальция с образованием гидроксида натрия и карбоната кальция:
2.3. При взаимодействии с разбавленной хлороводородной кислотой карбонат натрия образует хлорид натрия, углекислый газ и воду:
2.4. Карбонат натрия реагирует с разбавленной плавиковой кислотой . Взаимодействие карбоната натрия с плавиковой кислотой приводит к образованию фторида натрия, воды и углекислого газа:
2.5. Концентрированный раствор карбоната натрия взаимодействует с оксидом серы . При этом образуются карбонат натрия и углекислый газ:
📺 Видео
ГИДРОКСИД НАТРИЯ | NaOH | Химические свойства ГИДРОКСИДА НАТРИЯ | Качественные реакции | ХимияСкачать

Химия с содойСкачать

Качественная реакция на водуСкачать

ПОЧЕМУ НЕЛЬЗЯ ЕСТЬ ПИЩЕВУЮ СОДУ?Скачать