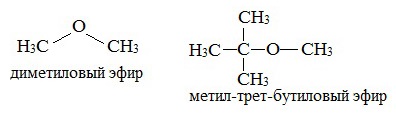
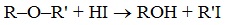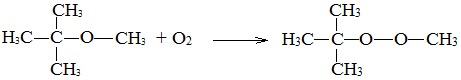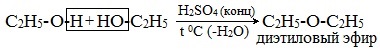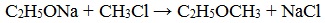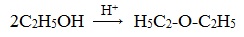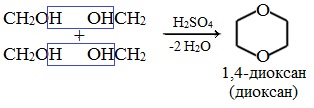Простыми эфирами называют органические вещества, в которых два углеводородных радикала связаны атомом кислорода: R’–O–R», где R’ и R» — различные или одинаковые радикалы.
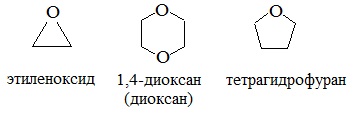
Простые эфиры могут быть предельными, непредельными, циклическими, ароматическими.
предельные
непредельные
ароматические
циклические
Простые эфиры рассматриваются как производные спиртов. Названия этих соединений строятся из названий радикалов (в порядке возрастания молекулярной массы) и слова «эфир». Например, CH3-O-CH3 — диметиловый эфир; C2H5-O-CH3 — метилэтиловый эфир.
Физические свойства
Два первых простейших представителя – диметиловый и метилэтиловый эфиры – при обычных условиях газы, все остальные – жидкости.
Диэтиловый эфир (C2H5-O-C2H5)– бесцветная легкокипящая прозрачная жидкость (t кип. 35,5 °С), малорастворимая в воде. С этиловым спиртом смешивается в любых отношениях. Температура воспламенения – 9,4°С, образует с воздухом взрывоопасную смесь. Вызывает набухание резин. Широко применяется в качестве растворителя, в медицине (ингаляционный наркоз), вызывает привыкание человека, ядовит.
Диоксан (т. кип. 101°С) — хороший растворитель, смешивается как с водой, так и с углеводородами. За эти качества его назвали «органической водой». Достаточно токсичен. Значительно более опасны галогенсодержащие дибензопроизводные диоксана: диоксин (2,3,7,8-тетрахлордибензо-п-диоксин).
Простые эфиры имеют более низкие температуры кипения и плавления, чем изомерные им спирты. Эфиры практически не смешиваются с водой. Это объясняется тем, что простые эфиры не образуют водородных связей, т.к. в их молекулах отсутствуют полярные связи О-Н.
Простые эфиры хорошо растворяют многие органические вещества и поэтому часто используются как растворители.
Эфиры имеют приятный запах.
Химические свойства
Простые эфиры — малоактивные соединения, они значительно менее реакционноспособны, чем спирты.
1.Расщепление простых эфиров HJ и HBr
Простые эфиры разлагаются под действием концентрированных иодоводородной или бромоводородной кислот:
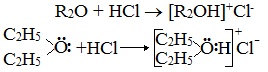
2. Образование комплексных соединений
Образование нестойких солей оксония (подобных солям аммония) в результате взаимодействия с сильными кислотами:
3. Окисление эфиров, образование перекисей
Несмотря на относительную химическую инертность, эфиры легко образуют при хранении на воздухе перекиси:
Перекиси являются причиной взрывов в конце перегонки эфиров, поэтому эфиры тщательно очищают от перекисей перед перегонкой и применением.
Получение
1. Межмолекулярная дегидратация спиртов
Симметричные простые эфиры R–O–R получают при межмолекулярной дегидратации спиртов:
При этом в одной молекуле спирта разрывается связь О-Н, а в другой — связь С-О. Реакцию можно рассматривать как нуклеофильное замещение группы HО – (в одной молекуле спирта) на группу RO – (от другой молекулы):
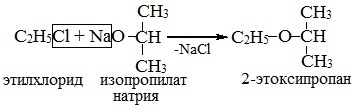
2. Взаимодействие галогенпроизводных с алкоголятами (реакция Вильямсона)
Эфиры несимметричного строения R–O–R’ образуются при взаимодействии алкоголята и галогенуглеводорода. Например, метилэтиловый эфир можно получить из этилата натрия и хлорметана:
В этой реакции происходит нуклеофильное замещение галогена (Cl – ) на алкоксигруппу (CH3O – ):
3. Дегидратация спиртов в присутствии ионов водорода как катализаторов
4. Получение гетероцикических кислородсодержащих соединений (циклические простые эфиры) этиленоксид (эпоксид) 
Применение
Вследствие относительной химической инертности, эфиры часто применяются в качестве органических растворителей (диэтиловый эфир, тетрагидрофуран, диоксан).
Эфиры с разветвленными алкильными радикалами (например, метил-трет-бутиловый эфир) используются в последнее время в качестве антидетонационных добавок в моторные топлива (бензины), заменяя чрезвычайно вредный тетраэтилсвинец (ТЭС) — Pb (CH3CH2)4.
Простые эфиры фенолов и нафтолов имеют своеобразные запахи и применяются в парфюмерии.
Видео:Простые эфиры. Получение. Все 4 реакции ЕГЭ.Скачать

Качественные реакции органических соединений
Качественные реакции органических соединений
Таблица. Качественные реакции на органические вещества
| Органическое вещество | Реактив | Наблюдаемая реакция | |||||||||||||||
| Алкены, алкины, алкадиены (этилен, ацетилен, дивинил и др.) | Бромная вода, Br2 (р-р) | Обесцвечивание раствора (видеоопыт реакция этилена с бромной водой, ацетилен с бромной) | |||||||||||||||
| Алкены, алкины, алкадиены (этилен, ацетилен, дивинил и др.) | Перманганат калия KMnO4 | Обесцвечивание раствора (видеоопыт) | |||||||||||||||
| Алкины с тройной связью на конце цепи (ацетилен С2Н2, пропин и др.) | Аммиачный раствор оксида серебра, [Ag(NH3)2]OH | Выпадение осадка соли серебра (видеоопыт) | |||||||||||||||
| Многоатомные спирты (этиленгликоль, глицерин и др.) | Свежеосажденный гидроксид меди (II) Сu(OH)2 | Образование ярко-синего раствора комплекса (видеоопыт) | |||||||||||||||
| Фенолы (С6Н5ОН — фенол и др.) | Бромная вода, Br2 (р-р) | Выпадение белого осадка | |||||||||||||||
| Раствор хлорида железа (III) FeCl3 | Образование фиолетового раствора | ||||||||||||||||
| Альдегиды (СН2О — муравьиный альдегид и др.) + муравьиная кислота НСООН + глюкоза (и другие углеводы-альдозы) Видео:Простые эфиры. Химические свойства. Все 3 реакции ЕГЭ.Скачать  4.1.5. Качественные реакции органических соединений.
|