» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Лимонная кислота (ФС.2.1.0024.15)
ФАРМАКОПЕЙНАЯ СТАТЬЯ
ФС.2.1.0024.15 Лимонная кислота. Лимонной кислоты моногидрат – Acidum citricum
Взамен ФС 42-0008-00
2-Гидроксипропан-1,2,3-трикарбоновая кислота, моногидрат
Содержит не менее 99,5 % лимонной кислоты С6Н8О7 в пересчете на безводное вещество.
Описание. Прозрачные бесцветные кристаллы или белый или почти белый кристаллический порошок или бесцветные гранулы. Выветривается в сухом воздухе.
Растворимость. Очень легко растворима в воде, легко или очень легко растворима в спирте 96 %.
Подлинность. Субстанцию предварительно высушивают при температуре 100 – 105 °С в течение 2 ч.
1. ИК-спектр. Инфракрасный спектр поглощения субстанции, полученный в дисках с калия бромидом, в области частот от 4000 до 400 см -1 по положению полос поглощения должен соответствовать спектру стандартного образца лимонной кислоты.
2. Качественная реакция. 1 г субстанции растворяют в 10 мл воды; полученный раствор должен окрашивать бумагу конго красного в синий или зеленый цвет.
3. Качественная реакция. 0,05 г субстанции растворяют в 0,5 мл уксусного ангидрида и нагревают; через 20 – 40 с должно появиться розово-фиолетовое окрашивание, переходящее в карминово-красное при прибавлении 0,1 мл пиридина.
4. Качественная реакция. 0,5 г субстанции растворяют в 5 мл воды, нейтрализуют 1 М раствором натрия гидроксида (около 7 мл), прибавляют 10 мл 7,35 % раствора кальция хлорида и нагревают до кипения; появляется осадок белого цвета.
*Прозрачность раствора. Растворяют 20 г субстанции в свежепрокипяченной и охлажденной воде и разбавляют водой до 100 мл; полученный раствор (раствор 1) должен быть прозрачным (ОФС «Прозрачность и степень мутности жидкостей»).
50 г субстанции, предназначенной для производства лекарственных препаратов для парентерального применения, растворяют в свежепрокипяченной и охлажденной воде и разбавляют водой до 100 мл; полученный раствор (раствор 2) должен быть прозрачным(ОФС «Прозрачность и степень мутности жидкостей») .
*Цветность раствора. Окраска раствора 1, полученного в испытании на «Прозрачность раствора», не должна превышать эталоны сравнения Y7, BY7 или GY7 (ОФС «Степень окраски жидкостей»).
Для субстанции, предназначенной для производства лекарственных препаратов для парентерального применения, раствор 2, полученный в испытании на «Прозрачность раствора», должен быть бесцветным (ОФС «Степень окраски жидкостей») .
Легко обугливающиеся вещества. 1,0 г субстанции помещают в пробирку, прибавляют 10 мл серной кислоты концентрированной, тотчас нагревают на водяной бане при температуре (90 ± 1) °С точно в течение 60 мин и быстро охлаждают; окраска полученного раствора не должна превышать окраски раствора, состоящего из 1 мл красного раствора и 9 мл желтого раствора (ОФС «Степень окраски жидкостей», метод 1).
Щавелевая кислота. Не более 0,036 %. 0,80 г субстанции растворяют в 4 мл воды, прибавляют 3 мл хлористоводородной кислоты концентрированной, 1 г цинка гранулированного, кипятят в течение 1 мин и выдерживают в течение 2 мин. Надосадочную жидкость переносят в пробирку, содержащую 0,25 мл 1 % раствора фенилгидразина гидрохлорида, и нагревают до кипения. Раствор переносят в градуированный цилиндр вместимостью 25 мл, быстро охлаждают, прибавляют равный объем хлористоводородной кислоты концентрированной и 0,25 мл 5 % раствора калия феррицианида, перемешивают и выдерживают в течение 30 мин. Интенсивность розовой окраски полученного раствора не должна превышать интенсивность окраски эталонного раствора, приготовленного параллельно таким же образом с использованием 4 мл 0,01 % раствора щавелевой кислоты.
Сульфаты. Не более 0,015 % (ОФС «Сульфаты», метод 2). 2,0 г субстанции растворяют в воде и разбавляют водой до 30 мл.
*Алюминий. Не более 0,00002 % (ОФС «Алюминий»).
испытуемый раствор. 20,0 г субстанции растворяют в 100 мл воды.
Эталонный раствор. К 2 мл стандартного раствора алюминий-иона
(2 мкг/мл) прибавляют 10 мл ацетатного буферного раствора с рН 6,0 и 98 мл воды и перемешивают.
Контрольный раствор. К 10 мл ацетатного буферного раствора с рН 6,0 прибавляют 100 мл воды и перемешивают.
Тяжелые металлы. Не более 0,002 % (ОФС «Тяжёлые металлы»). 0,5 г субстанции растворяют в 10 мл воды.
Вода. От 7,5 % до 9,0 % (ОФС «Определение воды»). Около 0,5 г (точная навеска) субстанции растворяют в 20 мл метанола безводного.
Сульфатная зола. Не более 0,1 % (ОФС «Сульфатная зола»). Для определения используют около 1,0 г (точная навеска) субстанции.
Остаточные органические растворители. В соответствии с требованиями ОФС «Остаточные органические растворители».
*Бактериальные эндотоксины. Не более 0,5 ЕЭ на 1 мг субстанции (ОФС «Бактериальные эндотоксины»).
Микробиологическая чистота. В соответствии с требованиями ОФС «Микробиологическая чистота».
Количественное определение. Около 0,5 г (точная навеска) субстанции растворяют в 50 мл воды и титруют 1 М раствором натрия гидроксида до по-
явления слабо-розовой окраски (индикатор – 0,5 мл 1 % раствора фенолфталеина).
Параллельно проводят контрольный опыт.
1 мл 1 М раствора натрия гидроксида соответствует 64,05 мг лимонной кислоты С6Н8О7.
Хранение. В хорошо укупоренной упаковке.
*Контроль по показателям качества «Прозрачность раствора», «Цветность раствора», «Алюминий» и «Бактериальные эндотоксины» проводят в субстанциях, предназначенных для производства лекарственных препаратов для парентерального применения.
Видео:Щавелевая Кислота - КАЧЕСТВЕННАЯ РЕАКЦИЯСкачать

«Изучение свойств карбоновых кислот на примере лимонной кислоты»
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
«Актуальность создания школьных служб примирения/медиации в образовательных организациях»
Свидетельство и скидка на обучение каждому участнику
Муниципальное бюджетное общеобразовательное учреждение
Московского района г. Н. Новгорода
«Изучение свойств карбоновых кислот на примере лимонной кислоты»
Глава 1. Обзор литературы по теме исследования
1.1 Характеристика карбоновых кислот……………………………………………6
1.1.1 Номенклатура и изомерия карбоновых кислот……………………………..6
1.1.2 Химические и физические свойства Карбоновых кислот………………….7
1.1.3 Получение карбоновых кислот……………………………………………..10
1.2 Характеристика лимонной кислоты…………………………………………..11
1.2.1 Получение лимонной кислоты в промышленности……………………. 12
1.2.2 Особенные свойства лимонной кислоты и ее солей……………………. 13
1.2.3 Применение лимонной кислоты…………………………………………. 14
Глава 2. Материалы и методика исследования…………………………………. 17
Глава 3. Результаты и их обсуждение…………………………………………….19
Кислоты – необходимые для жизни человека химические соединения. Вместе с едой мы получаем растительные и животные белки, которые расщепляются на отдельные аминокислоты. Их них в каждом организме строятся свои белковые структуры, свои живые ткани. Органические кислоты в свободном виде поступают в человеческий организм с молочнокислыми продуктами, ягодами, фруктами, овощами. Некоторые из них являются витаминами, например, аскорбиновая, фолиевая, никотиновая и др. Молочная кислота образуется в мышцах при физической нагрузке.
Муравей впрыскивает в ранку при укусе яд, содержащий муравьиную кислоту, ее выделяют некоторые гусеницы, пчелы. Она содержится в стрекательных клетках медуз. Тропический паук стреляет во врагов струйкой жидкости, содержащей уксусную кислоту.
Лимонная кислота, в наибольшей концентрации, содержится в ряде растений, в ягодах, плодах цитрусовых, хвое, и недозрелых лимонах. Яблочная кислота — в незрелых яблоках, винограде, малине, рябине и других кислых растениях; муравьиная кислота обнаружена в хвое, крапиве, фруктах. Синильная кислота (сильнейший яд) содержится в небольших количествах в косточках слив, вишен или миндаля; винная кислота — в кислом соке многих фруктов (например, в винограде). Аскорбиновой кислотой наиболее богаты плоды свежего шиповника, чёрной смородины и облепихи; фолиевая кислота в значимых количествах содержится в зелёных листовых овощах, в некоторых цитрусовых, в бобовых.
Лимонная кислота широко используется как вкусовая добавка, улучшает энергетический обмен, что способствует ускорению метаболизма.
Предмет исследования: физико-химические свойства лимонной кислоты.
Цель исследования : исследовать физические и химические свойства лимонной кислоты, как представителя карбоновых кислот..
• Провести анализ литературных источников по составу, свойствам карбоновых кислот, лимонной кислоты.
• Провести химический анализ физических и химических свойств лимонной кислоты.
• Изучить и дать сравнительную анализ физических и хических свойтсв лимонной кислоты.
Лимонная кислота всегда есть в человеческом организме. Ее производные — соли, выполняют важную роль при формировании костей, помогая регулировать размер кристаллов кальция. В биохимии соли данной кислоты имеют большое значение в качестве промежуточного звена в цикле трикарбоновых кислот, который имеет место при метаболизме у всех аэробных организмов. Обладает лимонная кислота и ценными лечебными свойствами. Она способствует очищению организма от вредных веществ, лишних солей, шлаков, положительно влияет на работу систем пищеварения, улучшает зрение, сжигает углеводы, проявляет ценные противоопухолевые свойства, повышает иммунитет. Лимонная кислота также способствует выведению токсинов через клетки кожи [1] .
С другой стороны, сухая лимонная кислота и её концентрированные растворы при попадании в глаза вызывают сильное раздражение, при контакте с кожей возможно слабое раздражение. При употреблении внутрь больших количеств лимонной кислоты возможны: раздражение слизистой оболочки желудка, кашель, боль, кровавая рвота. При вдыхании пыли сухой лимонной кислоты — раздражение дыхательных путей. Высокая концентрация данного вещества, применяемая наружу или внутрь, является причиной серьезных ожогов. Также лимонная кислота является разрушителем зубной эмали, вступая с ней в реакцию из-за нейтрализации кальция. Страдающим желудочно-кишечными заболеваниями не рекомендуется (а в некоторых случаях даже запрещено) употреблять продукты, имеющие в своем составе Е330. Также ограничить их употребление или исключить из своего меню следует лицам с повышенной кислотностью, так как поступление в организм лимонной кислоты вызовет ухудшения состояния здоровья, может стать причиной сильных желудочных болей.
Глава 1. Обзор литературы по теме исследования
1.1 Характеристика карбоновых кислот.
Карбоновые кислоты – органические вещества, молекулы которых содержат одну или несколько карбоксильных групп.
Общая формула одноосновных карбоновых кислот CnH2nO2 .
По количеству карбоксильных групп в молекуле карбоновые кислоты подразделяются на:
Ø Одноосновные — 1 карбоксильная группа
Ø Двухосновные — 2 карбоксильных группы
Ø Трехосновные — 3 карбоксильных группы
По типу углеродного радикала на:
Высшие карбоновые кислоты называют жирными кислотами [2].
1.1.1. Номенклатура и изомерия карбоновых кислот.
Названия карбоновых кислот формируются путем добавления суффикса «овая» к названию алкана с соответствующим числом атомов углерода и слова кислота: метановая кислота, этановая кислота, пропановая кислота, и т.д.
Многие карбоновые кислоты имеют тривиальные названия. Наиболее известные:
Ø Метановая — HCOOH — муравьиная кислота
Ø Этановая — CH3-COOH — уксусная кислота
Ø Пропановая — C2H5-COOH — пропионовая кислота
Ø Бутановая — C3H7-COOH — масляная кислота
Ø Пентановая — C4H9-COOH — валериановая кислота
Алгоритм составления названий карбоновых кислот:
1. Найдите главную углеродную цепь — это самая длинная цепь атомов углерода, включающая атом углерода карбоксильной группы.
2. Пронумеруйте атомы углерода в главной цепи, начиная с атома углерода карбоксильной группы.
3. Назовите соединение по алгоритму для углеводородов.
4. В конце названия допишите суффикс «-ов», окончание «-ая» и слово «кислота».
Для предельных карбоновых кислот характерна структурная изомерия: углеродного скелета, межклассовая изомерия со сложными эфирами.
Для непредельных карбоновых кислот характерна изомерия углеродного скелета, положения кратной связи и межклассовая изомерия.
1.1.2. Химические и физические свойства карбоновых кислот.
Первые три кислоты гомологического ряда (муравьиная, уксусная, пропионовая) — жидкости, хорошо растворимые в воде. Следующие представители — маслянистые жидкости, слабо растворимые в воде. Кислоты, начиная с каприновой С9Н19СООН, — твердые вещества, нерастворимые в воде, но растворимые в спирте, эфире.
Все жидкие кислоты отличаются своеобразным запахами.
Высокомолекулярные твердые кислоты запаха не имеют. С увеличением молекулярной массы кислот повышается их температура кипения и уменьшается плотность.
Для карбоновых кислот не характерны реакции присоединения. Карбоновые кислоты обладают более выраженными кислотными свойствами, чем спирты [3].
Ø Кислотные свойства
Карбоновые кислоты вступают в реакции с металлами, которые способны вытеснить водород (стоят левее водорода в ряду напряжений металлов) из кислоты. Реагируют также с основаниями, с солями более слабых кислот, например, угольной кислоты. Из-за высокой полярности связи O-H карбоновые кислоты в водном растворе заметно диссоциируют (точнее, обратимо с ней реагируют):
HCOOH 

Галогенирование происходит по типу замещения в радикале, который соединен с карбоксильной группой. Напомню, что наиболее легко замещается водород у третичного, чуть сложнее — у вторичного, и значительно сложнее — у первичного атома углерода.
Сила карбоновых кислот тем выше, чем меньше электронной плотности сосредоточено на атоме углерода в карбоксильной группе. Поэтому самая слабая из трех кислот — уксусная, чуть сильнее — хлоруксусная, за ней — дихлоруксусная и самая сильная — трихлоруксусная.
Ø Особые свойства муравьиной кислоты
Муравьиная кислота отличается от своих гомологов. За счет наличия у нее альдегидной группы, она, единственная из карбоновых кислот, способна вступать в реакцию серебряного зеркала:
CН3 НСООН + Аg2О → 2Аg + СО2 + Н2О
В такой реакции идет ее окисление до нестойкой угольной кислоты, которая распадается на углекислый газ и воду
Все органические вещества при горении распадаются на воду и углекислый газ:
CH3COOH + 2O2 
Ø Этерификация (реакция карбоновых кислот со спиртами, приводящая к образованию сложного эфира):
Таблица №1 (химические свойства).
Выделяется водород, образуются соли
Образуются соль и вода
С основаниями (нейтрализация)
Образуются соль и вода
Выделяются углекислый газ и вода
С солями слабых кислот
Образуется неорганическая кислота
С аммиаком или гидроксидом аммония
Образуется ацетат аммония. При взаимодействии с гидроксидом выделяется вода
Карбоновые кислоты меняют окраску индикаторов:
Рис. 1. Изменение окраски индикатора.
1.1.3. Получение карбоновых кислот.
Существует несколько способов получения карбоновых кислот:
Ø окисление спиртов – C2H5OH + O2 → CH3COOH + H2O (из этанола образуется уксусная кислота);
Ø окисление альдегидов – CH3COH + [O] → CH3COOH;
Ø карбонилирование спирта – CH3 + CO → CH3COOH;
Ø разложение щавелевой кислоты для получения муравьиной кислоты – C2H2O4 → HCOOH + CO2;
Ø взаимодействие солей с концентрированной серной кислотой – CH3COONa + H2SO4 → CH3COOH + NaHSO4 [4]
1.2 Характеристика лимонной кислоты
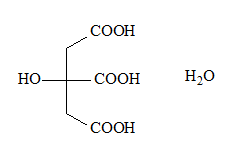
Формула лимонной кислоты:
Физические свойства лимонной кислоты.
- Кислая на вкус
- Твердая, кристалловидная белого цвета
- Хорошо растворима в воде, растворима в этиловом спирте, малорастворима в диэтиловом эфире
- Температура плавления 153°C
- Температура разложения = 175 °C.
- Молярная масса составляет 192,1 г/моль. Плотность — 1,665 г/см³
- Слабая кислота
Химические свойства лимонной кислоты
- Под действие серной кислоты лимонная кислота как α-гидроксикислота разлагается с образованием ацетондикарбоновой и муравьиной кислот.
- Взаимодействует с металлами
- Взаимодействует с основными оксидами
- Взаимодействует с основаниями
- Взаимодействует с солями
- Взаимодействует с аммиаком
- Подвергается электролитической диссоциации
- Проявляет общие для всех карбоновых кислот свойства. При нагревании выше 175 °C лимонная кислота переходит в аконитовую кислоту
- Лимонная кислота переходит в ангидриды итаконовой и цитраконовой кислот (теряется вода и углекислый газ и образование ацетона)
- В реакциях с сильными окислителями (перманганат калия, бертолетова соль) переходит в акриловую кислоту и этиленоксид .
- В водном растворе образует хелатные комплексы с ионами кальция , магния , меди , железа и др [5].
1.2.1. Получение лимонной кислоты в промышленности.
Около 60 лет назад лимонную кислоту выделяли преимущественно из плодов цитрусовых растений. В настоящее время основной путь промышленного производства — биосинтез из сахара или сахаристых веществ ( меласса ) промышленными штаммами плесневого гриба Aspergillus niger . Поскольку основным сырьем для получения лимонной кислоты является меласса, в которой содержится много железа, то на стадии пред-ферментации его осаждают при помощи желтой кровяной соли -K4[Fe(CN)6]. Известны два способа ферментации Aspergillus niger — поверхностный и глубинный. Первый из них реализуют на предприятиях малой и средней мощности в виде жидкофазной ферментации на жидкой среде (например, в ряде стран Европы и Америки) и в виде твердофазной ферментации (например, в Японии). Ныне Е330 получают новыми способами[6]. Среди них самыми популярными являются:
- с помощью плесневых грибов;
- из продуктов получения сахара;
- синтезирование.
Нахождение лимонной кислоты в природе.
Лимонная кислота в определённой концентрации содержится в большинстве прокариотов и почти во всех эукариотах (преимущественно в митохондриях).
В естественном виде лимонную кислоту содержат такие фрукты и ягоды, как: земляника, все цитрусовые, крыжовник, брусника, персики, лимоны в большом количестве (особенно несозревшие), ананасы, барбарис, хвойные, рябина, помидоры, клюква, абрикосы, гранаты, черная смородина, айва, вишня, китайский лимонник, малина, сливы, махорка и другие.
1.2.2. Особенные свойства лимонной кислоты и ее солей.
Лимонная кислота всегда есть в человеческом организме. Ее производные — соли, выполняют важную роль при формировании костей, помогая регулировать размер кристаллов кальция. В биохимии соли данной кислоты имеют большое значение в качестве промежуточного звена в цикле трикарбоновых кислот, который имеет место при метаболизме у всех аэробных организмов. Обладает лимонная кислота и ценными лечебными свойствами. Она способствует очищению организма от вредных веществ, лишних солей, шлаков, положительно влияет на работу систем пищеварения, улучшает зрение, сжигает углеводы, проявляет ценные противоопухолевые свойства, повышает иммунитет. Лимонная кислота также способствует выведению токсинов через клетки кожи [7] .
С другой стороны, сухая лимонная кислота и её концентрированные растворы при попадании в глаза вызывают сильное раздражение, при контакте с кожей возможно слабое раздражение. При употреблении внутрь больших количеств лимонной кислоты возможны: раздражение слизистой оболочки желудка, кашель, боль, кровавая рвота. При вдыхании пыли сухой лимонной кислоты — раздражение дыхательных путей. Высокая концентрация данного вещества, применяемая наружу или внутрь, является причиной серьезных ожогов. Также лимонная кислота является разрушителем зубной эмали, вступая с ней в реакцию из-за нейтрализации кальция. Страдающим желудочно-кишечными заболеваниями не рекомендуется (а в некоторых случаях даже запрещено) употреблять продукты, имеющие в своем составе Е330. Также ограничить их употребление или исключить из своего меню следует лицам с повышенной кислотностью, так как поступление в организм лимонной кислоты вызовет ухудшения состояния здоровья, может стать причиной сильных желудочных болей.
1.2.3. Применение лимонной кислоты.
- В кондитерской промышленности лимонная кислота используется как подкислитель и усилитель вкуса.
- В алкогольные и прохладительные газированные и негазированные напитки лимонная кислота добавляется для придания им ощущения свежести.
- Кроме того, она является синергистом, т. е. веществом, усиливающим действие антиоксидантов, таких, например, как аскорбиновая кислота.
- В консервной промышленности лимонная кислота используется как консервант вместо уксуса, который признан канцерогеном и применение которого в большинстве стран в пищевой промышленности резко ограничен.
- В масложировой промышленности лимонная кислота предохраняет продукцию от разлагающего действия находящихся в них следов тяжелых металлов, путем образования с ними комплексных соединений. Таким путем значительно снижается вероятность прогоркания жиров, маргаринов и животного масла.
- Применяется в медицине, в том числе в составе средств, улучшающих энергетический обмен (в цикле Кребса ).
- В косметике используется как регулятор кислотности , буфер , хелатирующий агент , для шипучих композиций (ванны).
- Применение в домашнем хозяйстве :
- Для продления времени стояния роз в воде, ее нужно обогатить сахаром и лимонной кислотой. Для вазы, в которую помещается пять литров воды нужно взять 1 г лимонной кислоты (1/8 чайной ложки) и стакан сахара, растворить в воде и поместить в этот раствор розы.
- Раствор для очищения утюга от накипи. Такой способ очистки применим для утюгов с возможностью подачи пара. Чтобы приготовить чистящий раствор, в стакане воды следует растворить столовую ложку лимонной кислоты. Этот раствор залить вместо воды в резервуар для подачи пара, подключить утюг к сети электропитания, установить отметку подачи пара на максимум и нажимая на кнопку подачи пара, постепенно очищать утюг. По окончанию проведения этой процедуры в резервуар для воды наливают чистую воду и повторяют процедуру несколько раз, с целью очистки парообразующих путей от следов лимонной кислоты.
- Раствор для очищения налет или потемнений на посуде из серебра, а также ювелирных украшениях, любые монеты, кулоны, перстни, браслеты и так далее [8].
- Раствор для очищения накипи на дне и стенках чайника. Очистить сантехнику и даже стены ванной комнаты можно при помощи порошка, полученного из Е 330. Желательно, чтобы фракции порошка были мелкими, а достигнуть этого можно, размолов средство в кофемолке (используя средства защиты дыхательных путей) или хотя бы измельчив скалкой на столе. Использовать так само, как и все чистящие порошки — нанеся небольшое количество на губку, постепенно очищать поверхность.
- Обладая легкими дезинфицирующими свойствами, Е 330 прекрасно подходит для очищения кухонных столов. Протирать стол слабым раствором этого вещества достаточно раз в неделю [9].
Глава 2. Материал и методика исследования
1. «Растворение лимонной кислоты в воде, определение ph среды раствора».
В стакан с водой насыпаем 5 грамм лимонной кислоты, перемешиваем. Делаем выводы о растворимости лимонной кислоты. Несколько капель раствора лимонной кислоты капаем на универсальную индикаторную бумагу. Отмечаем изменение цвета. Сравниваем цвет с эталонной шкалой ph .
2. «Взаимодействие раствора лимонной кислоты с металлами»
В пробирку присыпаем стружку магния и приливаем 2 мл раствора лимонной кислоты. Отмечаем признаки реакции.
3. «Взаимодействие раствора лимонной кислоты с оксидами металлов»
В пробирку насыпаем немного порошка оксида меди и приливаем раствор лимонной кислоты. Пробирку подогреваем. Отмечаем признаки химической реакции.
4.«Взаимодействие раствора лимонной кислоты с щелочью»
В пробирку приливаем раствор гидроксида натрия, добавляем несколько капель фенолфталеина. Отмечаем изменение окраски раствора. Приливаем в пробирку 2 мл раствор лимонной кислоты. Отмечаем изменение цвета раствора щелочи.
5.«Взаимодействие раствора лимонной кислоты с солями»
В пробирку добавляем несколько грамм порошка карбоната кальция и приливаем раствор лимонной кислоты. Отмечаем признаки химической реакции.
6. «Взаимодействие раствора лимонной кислоты с пищевой содой»
В стакан с водой насыпаем 3 грамма пищевой соды, размешивает до растворения. В пробирку приливаем 2 мл раствора лимонной кислоты, затем 2 мл раствора питьевой соды. Отмечаем признак реакции.
7. «Выявление биологической роли лимонной кислоты».
Разрезаем яблоко пополам. На одну половинку яблока наносим раствор лимонной кислоты, а вторую половинки оставляем непропитанной. Наблюдаю, что через некоторое время те половинки, которые не были смазаны раствором, темнеют.
8. «Осаждение белков молока лимонной кислотой».
В стакан с молоком насыпаем немного кристаллов лимонной кислоты. Перемешиваем, отмечаем появившийся творожистовидный осадок.
Видео:Лимонная кислота, цитраты и здоровье. Делаем средство от похмелья.Скачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. 🔍 ВидеоРеакция соды и лимонной кислоты (Citric Acid & Soda)Скачать  СНОСИТ РЖАВЧИНУ за ЧАС.лимонная кислотаСкачать  Качественные реакции на катионы. 9 класс.Скачать  Эксперимент с содой , лимонной кислотой и водой 🍚🍋🍋🍹Скачать  Качественная реакция на углекислый газСкачать  Лимонная кислота и другие средства против ржавчины. Что там с долей?Скачать  Лимонная кислота против накипи, ржавчины, стиральной машины.Скачать  ЛИМОННАЯ КИСЛОТА разъедает патрубки, сальники и алюминий? МИФ или РЕАЛЬНОСТЬ?Скачать  Домашняя газировка. Реакция раствора лимонной кислоты с раствором соды. #ХимияСкачать  лимонная кислота с перекисью водорода против ржавчиныСкачать  Почему лимонную кислоту делают не из лимонов?Скачать  Опыты по химии. Качественные реакции на нитрат-ион: взаимодействие нитрата с медью и серной кислотойСкачать  Качественные реакции в неорганике | ЕГЭ по ХИМИИ 2023Скачать  Реакция чая Piala На лимонную кислотуСкачать  Что нужно знать про лимонную кислоту? #shortsСкачать  Реакция. вода, соль, лимонная кислота, сода и медьСкачать  2 недели в лимонной кислотеСкачать  реакция лимонной кислоты на содуСкачать  |