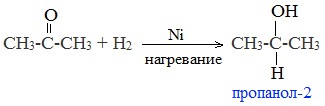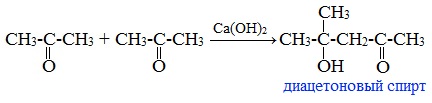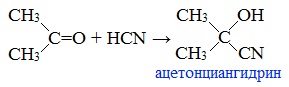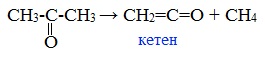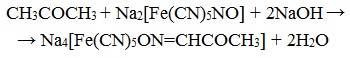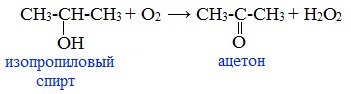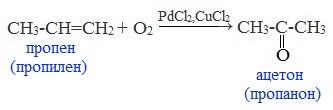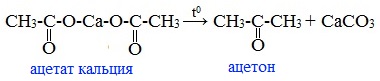Ацетон — простейший представитель насыщенных кетонов.
- Физические свойства
- Токсичность ацетона
- Химические свойства
- Получение
- Применение
- Лабораторная работа №9 Тема: Йодоформная проба (проба Либена) на ацетон
- Качественная реакция на альдегиды и кетоны
- Альдегиды и кетоны: химические свойства
- Получение альдегидов и кетонов
- Физические свойства и получение оксимов
- Методы синтеза
- Реакции присоединения к альдегидам и кетонам
- Полимеризация и поликонденсация альдегидов
- Оксосоединения. Альдегиды и кетоны
- 💥 Видео
Физические свойства
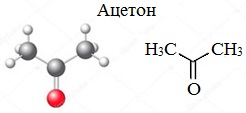
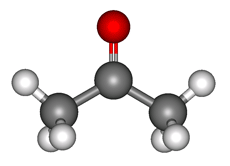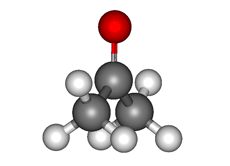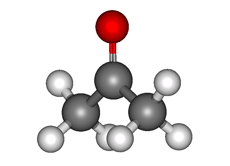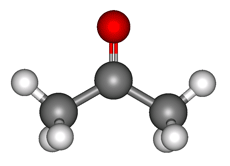
Ацетон (пропанон-2, диметилкетон) СН3-СО-СН3 — летучая бесцветная жидкость с характерным запахом и температурой кипения 56 0 С.

Он хорошо растворяет многие органические вещества (жиры, смолы, ацетилцеллюлозу, воск, резину и др.), поэтому является незаменимым растворителем в быту и в лакокрасочной промышленности.
Ацетон встречается в организме человека. Он является промежуточным продуктом обмена веществ. Незначительное количество ацетона, образующееся в организме человека в результате метаболических реакций, выводится вместе с мочой. У больных диабетом следы ацетона можно обнаружить в выдыхаемом воздухе.
Один из простейших и в то же время важнейших из кетонов — ацетон — впервые выявлен в 1595 году немецким химиком Андреасом Либавием в процессе сухой перегонки ацетата свинца. Однако точно определить его природу и химический состав удалось только в 1832 году Жану-Батисту Дюма и Юстусу фон Либиху. До 1914 года ацетон получали практически исключительно коксованием древесины.
Токсичность ацетона
Ацетон обладает возбуждающим и наркотическим действием, поражает центральную нервную систему. Ацетон способен накапливаться в организме, т.к. медленно выводится из организма. Он может поступать в организм с вдыхаемым воздухом, а также через пищевой канал и кожу.
После поступления ацетона в кровь часть его переходит в головной мозг, селезенку, печень, поджелудочную железу, почки, легкие и сердце. Содержание ацетона в указанных органах несколько меньшее, чем в крови.
При вдыхании паров ацетона происходит кислородное голодание мозга. Поэтому, в помещениях, в которых происходит испарение ацетона, создается опасность отравления при вдыхании его паров.
Химические свойства
Ацетон является одним из наиболее реакционноспособных кетонов.
Ацетон, как и все кетоны, не дает реакции «серебряного зеркала», не полимеризуется. В этом его отличие от альдегидов.
1. Гидрирование (восстановление)
При тех же условиях, что и формальдегид, ацетон присоединят водород:
Водород присоединяется вследствие разрыва двойной связи карбонильной группы.
2. Взаимодействие с гидросульфитом натрия
Ацетон один из немногих кетонов образует бисульфитное соединение:
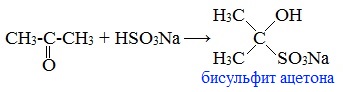
Под действием щелочей ацетон вступает в альдольную самоконденсацию, с образованием «ацетонового» (диацетонового) спирта:
4. Взаимодействие с синильной кислотой
Одной из наиболее важных реакций ацетона является присоединение к нему синильной кислоты с образованием ацетонциангидрина:
5. Пиролиз ацетона
При нагревании выше 500 0 C ацетон распадается на кетен и метан:
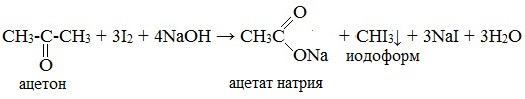
6. Галоформная реакция (иодоформная реакция, или проба Люголя)
Качественная реакция на ацетон!
При взаимодействии ацетона с избытком йода в щелочной среде образуется йодоформ – желтое вещество с характерным запахом:
Аналогичные реакции идут с хлором и бромом, но только реакция с йодом приводит к нерастворимому йодоформу.
7. Взаимодействие с нитропруссидом натрия
Качественная реакция на ацетон!
Ацетон с нитропруссидом натрия в щелочной среде дает интенсивно-красную окраску . При подкислении уксусной кислотой CH3COOH окраска переходит в красно-фиолетовую :
Йодоформная реакция и реакция с нитропруссидом натрия используются для обнаружения ацетона в моче при сахарном диабете.
Получение
Ацетон получают в больших количествах различными методами: при сухой перегонке дерева, разложением ацетата кальция, окислением пропена, «кумольным» способом, окислением изопропилового спирта, гидратацией ацетилена водяным паром.
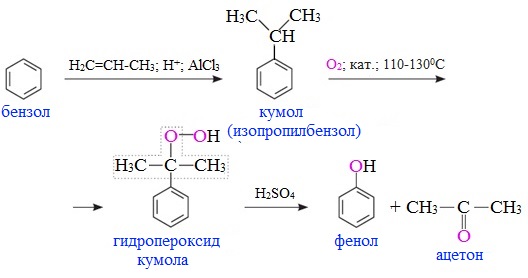
1.Кумольный способ
Данный способ получения фенола основан на окислении кумола (изопропилбензола). В качестве исходных продуктов используют бензол и пропилен.
Процесс протекает в три стадии. На первой стадии бензол алкилируется пропеном с получением кумола, на второй и третьей (реакция Удриса-Сергеева) полученный кумол окисляется кислородом воздуха до гидропероксида, который при действии серной кислоты разлагается на фенол и ацетон:
Окисление кумола — экономически выгодный метод, так как позволяет получить наряду с фенолом другой важный продукт — ацетон (на 1 кг фенола приходится 0,6 кг ацетона). В настоящее время этот метод наиболее широко используется в промышленности и позволяет производить более 80% синтетического фенола.
2. Окисление изопропилового спирта
Ацетон получают в больших количествах при окислении изопропилового спирта:
В качестве катализатора применяется медь, серебро, никель, платина и др. Воздух, насыщенный парами изопропилового спирта, пропускают над тонким слоем катализатора при температуре 400-650 0 С.
Если процесс окисления протекает в жидкой фазе, то, как побочный продукт образуется пероксид водорода:
3. Каталитическое окисление пропена кислородом воздуха
В промышленности ацетон получают прямым окислением пропена в жидкой фазе в присутствии катализатора — смеси PdCl2 и CuCl2 при температуре 100 0 C:
4. Брожение крахмала
Незначительное значение имеет метод брожения крахмала под действием бактерий с образованием ацетона и бутанола. Метод характеризуется малыми выходами.
5. Пиролиз ацетата кальция
Ацетон можно получить пиролизом ацетата кальция:
6. Гидратация ацетилена водяным паром
Реакция протекает при 400-460 0 С над катализатором, содержащим оксиды железа и марганца:
Применение
В качестве растворителя ацетон используется в производстве красок, лаков и олифы, резины, пластмасс, красителей, взрывчатых веществ, а также в фотографии.
Ацетон применяется в производство искусственного шелка и синтетической кожи, в производстве смазочных масел, бездымного пороха, кинопленки.
В химической промышленности ацетон является промежуточным химическим соединением при производстве многих химикатов, таких как кетен, уксусный ангидрид, бисфенол А, метилметакрилат, хлороформ, изофорон, йодоформ, витамин С.
Метилметакрилат применяется, главным образом, в виде листов пластика, порошков для литья и формовки, поверхностных покрытий, эмульсионных полимеров, волокон, чернил и пленок.
Метилметакрилат также применяется в производстве материалов, известных под названием плексигласа или люцита. Они используются в зубных протезах, твердых контактных линзах, и клеях.
Метилметакрилат – мономер для синтеза полиметилметакрилата («органическое сырье»).
Видео:Качественная реакция на йодСкачать

Лабораторная работа №9 Тема: Йодоформная проба (проба Либена) на ацетон
Лабораторная работа №9 Тема: Йодоформная проба (проба Либена) на ацетон
Лабораторная работа №9
Тема: Йодоформная проба (проба Либена) на ацетон
Цель: провести йодоформную реакцию с участием ацетона, составить уравнения реакций, сделать выводы, ознакомиться с данной пробой и её применением в фармакологи.
Реактивы и оборудование: раствора йода в калия йодиде, 10%-ный раствор натрия гидроксида, ацетон, пробирки.
В пробирку помещают 1 каплю раствора йода в калия йодиде и прибавляют до обесцвечивания по каплям 10%-ный раствор натрия гидроксида. После добавления в пробирку 1 капли ацетона наблюдают образование желтоватого осадка йодоформа и ощущают характерный запах:
Йодоформная проба положительна для уксусного альдегида и метилкетонов.
Вопросы для самостоятельной работы
Что такое лакриматоры? Как данная проба используется в медицинской практике? Какая ещё подобная проба используется с этой же целью? Опишите кратко (Проба Легаля). Одним из продуктов реакции является йодоформ. Как и для чего это вещество применяется в медицине?
Видео:Получение Йодоформа. Реакция Ацетона, Йода и Гидрооксида Натрия. Реакция C3H6O, I2 и NaOH.Скачать

Качественная реакция на альдегиды и кетоны
Видео:реакция крахмала с йодомСкачать

Альдегиды и кетоны: химические свойства
1. Гидратация алкинов (реакция Кучерова) (см. тему “Алкины”)
2. Окисление и дегидрирование первичных и вторичных спиртов (см. тему “Спирты”)
3. Пиролиз (декарбоксилирование) солей карбоновых кислот
Атомы углерода и кислорода в карбонильной группе находятся в sp2-гибридизации, группа имеет плоское строение.
Связь СО поляризована, электронная плотность смещена к атому кислорода.
Дефицит электронной плотности на атоме углерода карбонила (+d’) в кетонах меньше, чем в альдегидах (+d) из-за донорных эффектов двух алкильных групп. Следствием этого является снижение реакционной способности карбонильной группы в кетонах.
I. Реакции присоединения по карбонильной группе
1. Восстановление (гидрирование) – синтезпервичных и вторичных спиртов.
При восстановлении или гидрировании альдегидов получают первичные спирты, из кетонов образуются вторичные спирты.
б) восстановление боргидридом натрия (NaBH 4 ) и алюмогидридом лития (LiAlH 4 )
2. Присоединение HCN – образование циангидринов или нитрилов 2-оксикислот.
Реакция носит название циангидринного синтеза и используется при получении 2-окси- и 2-аминокислот (см. материалы 2-го семестра).
Механизм AdNu –нуклеофильное присоединение по карбонильной группе
Nu – −:С≡N (нитрил-анион)
В качестве реагента также можно использовать КСN в присутствии воды.
2. Присоединение NaHSO 3 (гидросульфита натрия) – образование бисульфитного производного (качественная реакция )
Механизм AdNu, Nu –атом серы за счет НПЭ:
Пространственно затрудненные (разветвленные) кетоны, например диизопропилкетон, не образуют бисульфитные производные.
Реакция может служить качественной, бисульфитные производные легко кристаллизуются. Эту реакцию также используют для выделения альдегидов (кетонов) из смеси с другими соединениями.
4. Присоединение реактивов Гриньяра – синтез спиртов всех типов.
а) из формальдегида получают первичные спирты
б) из других альдегидов получают вторичные спирты
в) из кетонов получают третичные спирты
Присоединение слабых нуклеофилов
Для присоединения слабых нуклеофилов необходим кислый катализ.
- Присоединение H 2 O , НХ Х=Cl, Br
Реакции с этими реагентами обратимы, продукты присоединения (аддукты) нестабильны.
Исключением являются аддукты воды и альдегидов (кетонов), имеющих акцепторные группы.
2. Присоединение спиртов – образование полуацеталей (полукеталей), ацеталей (кеталей).
Присоединение одной молекулы спирта к альдегиду приводит к синтезу полуацеталей, к кетону – полукеталей. При дальнейшем взаимодействии со второй молекулой спирта из полуцеталя образуется ацеталь, из полукеталя – кеталь. Полуацетали и полукетали содержат при одном атоме углерода гидроксильную и алкоксигруппы, у ацеталей и кеталей – при одном атоме углерода две алкоксигруппы.
Механизм образования полуацеталя и ацеталя приведен ниже:
II. Реакции присоединения-отщепления (реакции с азотистыми нуклеофилами).
Реакции с соединениями с общей формулой NH2 -X, где Х = H, OH, NH2, NH-C6 H5, NH-C(O)NH2, NH-C6 H3 (о, п-NO2 ) идут в два этапа, промежуточные аддукты нестабильны.
Общая схема реакции:
1.Реакция с аммиаком – образование иминов.
Альдимины нестойки и вступают в реакции циклизации:
При взаимодействии 6 молей формальдегида и 4 молей аммиака образуется уротропин (гексаметилентетрамин), впервые синтезированный А. М. Бутлеровым в 1859 году. Уротропин используется для лечения мочевыводящих путей, его комплекс с хлористым кальцием называется кальцексом и применятся в качестве антигриппозного средства.
2. Реакция с гидроксиламином — NH 2 OH – образование оксимов.
Реакция относится к качественным. Оксимы – кристаллические вещества, легко кристаллизуются.
3. Реакции с гидразином – NH 2 — NH 2, фенилгидразином — NH 2 — NH — C 6 H 5 и с 2,4-динитрофенилгидразином — NH 2 — NH — C 6 H 3 -2,4-(NO 2 )2 – образование гидразонов, фенилгидразонов и 2,4-динитрофенилгидразонов.
По аналогичной схеме образуются фенилгидразоны и 2,4-динитрофенилгидразоны:
2,4-Динитрофенилгидразоны особенно широко используются для идентификации альдегидов и кетонов.
Они обладают высокими температурами плавления, легко кристаллизуются, имеют четкие спектральные данные.
3. Реакция с семикарбазидом – NH 2 — NH — CONH 2 – образование семикарбазонов.
Все выше описанные реакции катализируются слабыми кислотами, в случае реакции с 2,4-динитрофенилгидразином реакция идет в присутствии концентрированной серной кислоты.
Механизм однотипен – нуклеофильное присоединение-отщепление и описан ниже в общем виде:
Х=H, OH, NH2, NH-C6 H5, NH-C(O)NH2
Получаемые имино-производные при кислом или щелочном гидролизе дают исходные альдегиды (кетоны).
III. Реакции с участием атомов водорода при a -углеродном атоме
Для альдегидов и кетонов, имеющих атомы водорода в a-положение характерно явление таутомерии.
Таутомерия – это процесс динамической изомеризации. Структурные изомеры (в данном случае таутомеры), взаимно превращаясь, находятся в состоянии динамического равновесия.
Как правило, при изомеризации происходит перенос протона, в этом случае таутомерию называют прототропной.
При наличии двух a-положений в кетонах возможно образование двух енолов.
Альдегиды и кетоны образуются через енолы при гидратации алкинов по реакции Кучерова (см. тему «Алкины»). Енолы или енолят-анионы являются промежуточными соединениями в реакциях галоидирования и конденсации карбонильных соединений.
1. Галоидирование карбонильных соединений (идет только по α-положению).
Хлорирование хлором идет без катализатора, результат зависит от количества хлора, можно получить моно, ди и трихлорпроизводные (для этаналя).
Хлорирование идет легко и без катализатора, в зависимости от количества реагента и строения соединения можно ввести от одного до трех атомов хлора.
При бромировании используют 1 моль реагента в присутствии щелочи.
в) Галоформное расщепление (изб. I 2, Cl 2 или Br 2, Na ОН (конц.))
Качественная реакция на наличие ацетильного фрагмента (СН3 СО) в карбонильных соединениях.
При реакции с йодом и бромом выпадает окрашенный осадок галоформа, обладающий специфическим запахом.
Галоформному расщеплению подвергаются ацетальдегид и метилалкилкетоны, при этом кроме галоформа в реакции образуются натриевые соли карбоновых кислот.
2. Реакции альдольной и кротоновой конденсации
Конденсация – это реакция, приводящая к усложнению углеводородного скелета.
В альдольной и кротоновой конденсациях участвуют две молекулы карбонильного соединения. Одна молекула – карбонильная компонента, реагирует с помощью карбонильной группы, другая – метиленовая компонента за счет атомов водорода α-положения.
а) Альдольная конденсация (реакция катализируется основаниями)
Альдоли способны при нагревании в щелочной среде отщеплять воду и превращаться в a,b — непредельные альдегиды (кетоны).
б) Кротоновая конденсация (в кислой среде при нагревании).
Протекает по механизму АdE.
В кислой среде при нагревании конденсация не останавливается на стадии образования альдоля. Происходит внутримолекулярная дегидратация альдоля до непредельного альдегида или кетона.
При участии в реакции пропаналя, бутаналя и других альдегидов получают альдегиды и кетоны, имеющие в положении С-2 алкильную группу.
1. Альдегиды окисляются в мягких условиях до карбоновых кислот, проявляя свойства восстановителей.
Реакции с растворами Толенса (реакция серебряного зеркала) и Фелинга относятся к качественным.
2. Кетоны окисляются деструктивно с расщеплением молекулы в жестких условиях после енолизации под действием KMnO4 и K2 Cr2 O7 в присутствии концентрированной серной кислоты (реакцию не описываем).
1. Окисление спиртов. Первичные спирты при окислении образуют альдегиды, которые затем легко окисляются до карбоновых кислот:
При окислении вторичных спиртов образуются кетоны:
Гидратация алкинов (реакция Кучерова). Присоединение воды к ацетилену в присутствии солей ртути (II) приводит к образованию ацетальдегида:
Кетоны получают при гидратации других гомологов ацетилена:
Окисление алкенов (катализаторы — хлориды Pd и Cu):
4. Кумольный способ получения ацетона и фенола (Кружалов, Сергеев, Немцов):
5. Реакция оксосинтеза:
Восстановление хлорангидридов карбоновых кислот:
Карбонильные соединения являются промежуточными продуктами окисления углеводородов до кислот.
Видео:ПОЛУЧЕНИЕ ОГНЯ ИЗ ЙОДА И АЛЮМИНИЯСкачать

Получение альдегидов и кетонов
Химические свойства альдегидов и кетонов. Электронная структура карбонильной группы определяет реакционную способность альдегидов и кетонов. Атом углерода карбонильной группы находится в состоянии sp2-гибридизации.
Валентный угол между δ- связями 1200. Неспаренный р- электрон углерода перекрывается с р- электроном кислорода и образует π- связь, которая располагается перпендикулярно плоскости молекулы альдегида.
Электронная плотность π- связи смещена к кислороду. Исходя из этого, типичными реакциями альдегидов и кетонов являются:
─ реакции нуклеофильного замещения (AdN);
─ реакции с участием атомов водорода в α- положении в карбонильной группе.
Реакции нуклеофильного присоединения.Реакции нуклеофильного присоединения протекают через стадию образования промежуточного комплекса, который характеризуется изменением типа гибридизации исходного альдегида.
Молекула принимает тип гибридизации, который будет в конечных продуктах реакции. Механизм реакции имеет вид:
1. Взаимодействие с синильной кислотой:
Кетоны в реакции AdN вступают труднее, чем альдегиды.
Это связано с пространственными препятствиями алкильных радикалов кетонов при образовании промежуточной структуры.
2. Присоединение гидросульфита натрия:
С гидросульфитом натрия вступают во взаимодействие только метилкетоны.
Реакции карбонильных соединений с гидросульфитом натрия используются для очистки продуктов от карбонильных соединений.
Взаимодействие с аммиаком:
Взаимодействие кетонов с аммиаком происходит иначе:
Взаимодействие с гидроксиламином. При взаимодействии карбонильных соединений с гидроксиламином образуются оксимы:
Эта реакция используется для количественного определения карбонильных соединений в реакционных смесях, различных продуктах. При этом используется солянокислый гидроксиламин (NH2-OH•HCl).
Взаимодействие альдегидов с гидразином:
Аналогично взаимодействуют кетоны.
6. Взаимодействие с фенилгидрозином:
7. Реакции гидрирования. При восстановлении альдегидов образуются первичные спирты. При восстановлении кетонов образуются вторичные спирты.
При восстановлении кетонов водородом в момент выделения возможно образование пинаконов.
Взаимодействие альдегидов со спиртами:
Реакции окисления. Окисление карбонильных соединений протекает в мягких условиях.
Альдегиды окисляются до карбоновых кислот. Кетоны окисляются до смеси кислот с разрывом углеводородной цепочки:
Реакции серебряного зеркала:
Реакции с участием α- водородных атомов. В альдегидах и кетонах атомы водорода в α- положении к углероду карбонильной группы очень подвижны и способны диссоциировать по типу кислоты.
Подвижность протонов в α- положении обусловлена акцепторным влиянием кислорода, снижающим электронную плотность на углероде в α- положении.
Структура ІІІ энергетически стабильна, так как стабилизирована резонансом.
Структура ІІІ является гибридом двух структур: І и ІІ.
1. Реакция бромирования:
Видео:Опыт с Йодом на содержанее крахмала. Качественная реакция на крахмалСкачать

Физические свойства и получение оксимов
Оксимы, производные альдегидов или кетонов (соответственно альдоксимы RCH=NOH или кетоксимы RR’C=NOH) – жидкости или низкоплавкие твердые вещества (табл. 1), хорошо растворимые во многих органических растворителях, плохо – в холодной воде.
Оксимы альдегидов и несимметричных кетонов существуют в виде двух стереоизомерных форм, например для бензальдоксима: син- (Е, рис. 1,а) и анти- (Z, рис. 1,б), которые могут существенно различаться по своим свойствам. Взаимные превращения стереоизомеров осуществляются при действии кислот или при облучении.
| Соединение | Мол.м. | Тпл., °С | Ткип., °С |
| Формальдоксим |
ИК спектры оксимов имеют 2 слабые полосы поглощения при 3650-3500 и 1690-1650 см -1, отвечающие валентным колебаниям О—Н и C=N связей соотв., и сильную полосу при 960-930 см -1 (валентные колебания N—О-связи).
Методы синтеза
Наиболее распространенным лабораторным методом оксимов является реакции альдегидов и кетонов с гидроксиламином
CH3COCH3 + NH2OH 
Другим широко используемым методом является изомеризация нитрозосоединений, образующихся in situ при нитрозировании некоторых алканов (например, циклогексана нитрозилхлоридом NOCl) или соединений с активированной метильной либо метиленовой группой:
PhCOCH3 + C5H11ONO 

Оксимы также могут быть синтезированы окислением первичных аминов:
RR1CH-NH2 + H2O2 
либо восстановлением нитросоединений:
RCH2NO2 + [H] 
Образование оксимов используют для выделения, идентификации и количеств.
определения карбонильных соединений. Некоторые оксимы – аналитические реагенты, например диметилглиоксим применяют для разделения и концентрирования Ni (II), Pd(II) и Re(IV), 1,2-диоксимы – для определения Ni, Co, Сu и платиновых металлов, 2,2′-фурилдиоксим [1,2-(2-фурил)этандион-диоксим] – для определения Pd в рудах, формальдоксим – реагент для фотометрия, определения Mn(III), Ce(IV), V(V) в щелочной среде.
Оксимы применяют для получения пестицидов (например, бутокарбоксим, бутоксикарбоксим), лекарственных препаратов (например, 2-пиридин-альдоксимметиодид), циклогексаноноксим используется в производстве капролактама.
Видео:Качественная реакция на ион трехвалентного железаСкачать

Реакции присоединения к альдегидам и кетонам
Первая группа свойств реакции присоединения. В карбонильной группе между углеродом и кислородом присутствует двойная связь, которая, как вы помните, состоит из сигма-связи и пи-связи.
В реакциях присоединения пи-связь рвется и образуются две сигма связи одна с углеродом, вторая с кислородом. На углероде сосредоточен частичный положительный заряд, на кислороде частичный отрицательный. Поэтому к углероду присоединяется отрицательно заряженная частица реагента, анион, а к кислород положительно заряженная часть молекулы.
Первое свойство гидрирование, присоединение водорода.
Реакция проходит при нагревании.
Применяется уже известный вам катализатор гидрирования никель. Из альдегидов получаются первичные спирты, из кетонов вторичные.
У вторичных спиртов гидроксогруппа связана со вторичным атомом углерода.
Второе свойство гидратация, присоединение воды. Эта реакция возможна только для формальдегида и ацетальдегида. Кетоны совсем не реагируют с водой.
Все реакции присоединения идут таким образом, что плюс идет к минусу, а минус к плюсу.
Как вы помните из видео про спирты, наличие двух гидроксогрупп у одного атома почти невозможная ситуация, такие вещества крайне неустойчивы.
Так вот конкретно два этих случая гидрат формальдегида и уксусного альдегида возможны, хотя и существуют только в растворе.
Сами реакции знать не обязательно. Скорее всего, вопрос на экзамене может звучать как констатация факта, допустим, с водой реагируют и перечислены вещества. Среди их перечня которых могут быть метаналь или этаналь.
Третье свойство присоединение синильной кислоты.
Снова плюс идет к минусу, а минус к плюсу.
Получаются вещества, называемые гидроксинитрилами. Опять же, сама реакция встречается нечасто, но знать об этом свойстве нужно.
Четвертое свойство присоединение спиртов.
Здесь снова не нужно знать наизусть уравнение реакции, просто надо понимать, что такое взаимодействие возможно.
Как обычно в реакциях присоединения к карбонильной группе плюс к минусу, а минус к плюсу.
Пятое свойство реакция с гидросульфитом натрия.
И снова, реакция довольно сложная, выучить ее вряд ли получится, но это одна из качественных реакций на альдегиды, потому что полученная натриевая соль выпадает в осадок.
То есть по факту вы должны знать, что альдегиды реагируют с гидросульфитом натрия, этого будет достаточно.
На этом закончим с первой группой реакций. Вторая группа реакции полимеризации и поликонденсации.
Полимеризация и поликонденсация альдегидов
С полимеризацией вы знакомы: полиэтилен, бутадиеновый и изопреновый каучуки, поливинилхлорид это продукты объединения множества молекул (мономеров) в одну большую, в единую полимерную цепь.
То есть получается один продукт. При поликонденсации происходит то же самое, но помимо полимера получаются еще низкомолекулярные продукты, например, вода. То есть получается два продукта.
Итак, шестое свойство полимеризация.
Кетоны в эти реакции не вступают, промышленное значение имеет только полимеризация формальдегида.
Пи-связь рвется и образуются две сигма связи с соседними мономерами. Получается полиформальдегид, называемый также параформ. Вероятнее всего, вопрос на экзамене может звучать так: в реакции полимеризации вступают вещества.
И приведен список веществ, среди которых может быть в формальдегид.
Седьмое свойство поликонденсация.
Видео:Качественная реакция на альдегиды с гидроксидом медиСкачать

Оксосоединения. Альдегиды и кетоны
Еще раз: при поликонденсации помимо полимера получается еще низкомолекулярное соединение, например, вода. Формальдегид вступает в такую реакцию с фенолом. Для наглядности сначала запишем уравнение с двумя молекулами фенола.
💥 Видео
Качественная реакция на йодСкачать

Йод - САМЫЙ КРАСОЧНЫЙ ЭЛЕМЕНТ НА ЗЕМЛЕ!Скачать

Химическая реакция йода и алюминия.Скачать

133. Качественная реакция на йод.wmvСкачать

Качественная реакция на хлорид, бромид, йодид ион.Скачать

Качественные реакции на катионы. 9 класс.Скачать

КАЧЕСТВЕННАЯ РЕАКЦИЯ НА КРАХМАЛ. Реакция обесцвечивания. Starch quality reaction. Йод + крахмал.Скачать

Качественная Реакция На Крахмал.Скачать

Всё про окислительно-восстановительные реакции | ТурбоЕГЭ по химииСкачать

Опыты по химии. Взаимодействие (реакция) йода с алюминиемСкачать

Йод, крахмал и синий цвет/ ХимХопСкачать

ФИОЛЕТОВЫЙ ДЫМ из ЙОДА.Реакция АЛЮМИНИЯ и ЙОДА.Reaction of aluminum and iodine.Скачать

125 Качественная реакция на йодСкачать