- Положение в периодической системе химических элементов
- Электронное строение меди
- Физические свойства
- Нахождение в природе
- Способы получения меди
- Качественные реакции на ионы меди (II)
- Химические свойства меди
- Оксид меди (II)
- Способы получения оксида меди (II)
- Химические свойства оксида меди (II)
- Оксид меди (I)
- Способы получения оксида меди (I)
- Химические свойства оксида меди (I)
- Гидроксид меди (II)
- Способы получения гидроксида меди (II)
- Химические свойства
- Соли меди
- Соли меди (I)
- Соли меди (II)
- Медь и соединения меди
- Химия, Биология, подготовка к ГИА и ЕГЭ
- Уравнения качественных реакций неорганической химии.
- Качественные реакции на ионы некоторых металлов
- 🌟 Видео
Положение в периодической системе химических элементов
Медь расположена в 11 группе (или в побочной подгруппе II группы в короткопериодной ПСХЭ) и в четвертом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение меди
Электронная конфигурация меди в основном состоянии :
+29Cu 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 1s 

3s 


У атома меди уже в основном энергетическом состоянии происходит провал (проскок) электрона с 4s-подуровня на 3d-подуровень.
Физические свойства
Медь – твердый металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). Медь относительно легко поддается механической обработке. В природе встречается в том числе в чистом виде и широко применяется в различных отраслях науки, техники и производства.
Изображение с портала zen.yandex.com/media/id/5d426107ae56cc00ad977411/uralskaia-boginia-liubvi-5d6bcceda660d700b075a12d
Температура плавления 1083,4 о С, температура кипения 2567 о С, плотность меди 8,92 г/см 3 .
Медь — ценный металл в сфере вторичной переработки. Сдав лом меди в пункт приема, Вы можете получить хорошее денежное вознаграждение. Подробнее про прием лома меди.
Нахождение в природе
Медь встречается в земной коре (0,0047-0,0055 масс.%), в речной и морской воде. В природе медь встречается как в соединениях, так и в самородном виде. В промышленности используют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4. Также распространены и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2 (OH) 2 CO 3 . Иногда медь встречается в самородном виде, масса которых может достигать 400 тонн .
Способы получения меди
Медь получают из медных руд и минералов. Основные методы получения меди — электролиз, пирометаллургический и гидрометаллургический.
- Гидрометаллургический метод: р астворение медных минералов в разбавленных растворах серной кислоты, с последующим вытеснением металлическим железом.
Например , вытеснение меди из сульфата железом:
CuSO4 + Fe = Cu + FeSO4
- Пирометаллургический метод : получение меди из сульфидных руд. Это сложный процесс, который включает большое количество реакций. Основные стадии процесса:
1) Обжиг сульфидов:
2CuS + 3O2 = 2CuO + 2SO2
2) восстановление меди из оксида, например, водородом:
CuO + H2 = Cu + H2O
- Электролиз растворов солей меди:
Качественные реакции на ионы меди (II)
Качественная реакция на ионы меди +2 – взаимодействие солей меди (II) с щелочами . При этом образуется голубой осадок гидроксида меди(II).
Например , сульфат меди (II) взаимодействует с гидроксидом натрия:
Соли меди (II) окрашивают пламя в зеленый цвет.
Химические свойства меди
В соединениях медь может проявлять степени окисления +1 и +2.
1. Медь — химически малоактивный металл. При нагревании медь может реагировать с некоторыми неметаллами: кислородом, серой, галогенами.
1.1. При нагревании медь реагирует с достаточно сильными окислителями , например , с кислородом , образуя CuО, Cu2О в зависимости от условий:
2Cu + О2 → 2CuО
1.2. Медь реагирует с серой с образованием сульфида меди (II):
Cu + S → CuS
1.3. Медь взаимодействует с галогенами . При этом образуются галогениды меди (II):
Но, обратите внимание:
2Cu + I2 = 2CuI
1.4. С азотом, углеродом и кремнием медь не реагирует:
Cu + N2 ≠
Cu + C ≠
Cu + Si ≠
1.5. Медь не взаимодействует с водородом.
1.6. Медь взаимодействует с кислородом с образованием оксида:
2Cu + O2 → 2CuO
2. Медь взаимодействует и со сложными веществами:
2.1. Медь в сухом воздухе и при комнатной температуре не окисляется, но во влажном воздухе, в присутствии оксида углерода (IV) покрывается зеленым налетом карбоната гидроксомеди (II):
2.2. В ряду напряжений медь находится правее водорода и поэтому не может вытеснить водород из растворов минеральных кислот (разбавленной серной кислоты и др.).
Например , медь не реагирует с разбавленной серной кислотой :
2.3. При этом медь реагирует при нагревании с концентрированной серной кислотой . При нагревании реакция идет, образуются оксид серы (IV), сульфат меди (II) и вода:
2.4. Медь реагирует даже при обычных условиях с азотной кислотой .
С концентрированной азотной кислотой:
С разбавленной азотной кислотой:
Реакция меди с азотной кислотой
2.5. Растворы щелочей на медь практически не действуют.
2.6. Медь вытесняет металлы, стоящие правее в ряду напряжений, из растворов их солей .
Например , медь реагирует с нитратом ртути (II) с образованием нитрата меди (II) и ртути:
Hg(NO 3 ) 2 + Cu = Cu(NO 3 ) 2 + Hg
2.7. Медь окисляется оксидом азота (IV) и солями железа (III)
2Cu + NO2 = Cu2O + NO
Оксид меди (II)
Оксид меди (II) CuO – твердое кристаллическое вещество черного цвета.
Способы получения оксида меди (II)
Оксид меди (II) можно получить различными методами :
1. Термическим разложением гидроксида меди (II) при 200°С :
2. В лаборатории оксид меди (II) получают окислением меди при нагревании на воздухе при 400–500°С:
2Cu + O2 2CuO
3. В лаборатории оксид меди (II) также получают прокаливанием солей (CuOH)2CO3, Cu(NO3)2:
Химические свойства оксида меди (II)
Оксид меди (II) – основный оксид (при этом у него есть слабо выраженные амфотерные свойства) . При этом он является довольно сильным окислителем.
1. При взаимодействии оксида меди (II) с сильными и растворимыми кислотами образуются соли.
Например , оксид меди (II) взаимодействует с соляной кислотой:
СuO + 2HBr = CuBr2 + H2O
CuO + 2HCl = CuCl2 + H2O
2. Оксид меди (II) вступает в реакцию с кислотными оксидами.
Например , оксид меди (II) взаимодействует с оксидом серы (VI) с образованием сульфата меди (II):
3. Оксид меди (II) не взаимодействует с водой.
4. В окислительно-восстановительных реакциях соединения меди (II) проявляют окислительные свойства:
Например , оксид меди (II) окисляет аммиак :
3CuO + 2NH3 → 3Cu + N2 + 3H2O
Оксид меди (II) можно восстановить углеродом, водородом или угарным газом при нагревании:
СuO + C → Cu + CO
Более активные металлы вытесняют медь из оксида.
Например , алюминий восстанавливает оксид меди (II):
3CuO + 2Al = 3Cu + Al2O3
Оксид меди (I)
Оксид меди (I) Cu2O – твердое кристаллическое вещество коричнево-красного цвета.
Способы получения оксида меди (I)
В лаборатории оксид меди (I) получают восстановлением свежеосажденного гидроксида меди (II), например, альдегидами или глюкозой:
Химические свойства оксида меди (I)
1. Оксид меди (I) обладает основными свойствами.
При действии на оксид меди (I) галогеноводородных кислот получают галогениды меди (I) и воду:
Например , соляная кислота с оксидом меди (I) образует хлорид меди (I):
Cu2O + 2HCl = 2CuCl↓ + H2O
2. При растворении Cu2O в концентрированной серной, азотной кислотах образуются только соли меди (II):
3. Устойчивыми соединениями меди (I) являются нерастворимые соединения (CuCl, Cu2S) или комплексные соединения [Cu(NH3)2] + . Последние получают растворением в концентрированном растворе аммиака оксида меди (I), хлорида меди (I):
Аммиачные растворы солей меди (I) взаимодействуют с ацетиленом :
СH ≡ CH + 2[Cu(NH3)2]Cl → СuC ≡ CCu + 2NH4Cl
4. В окислительно-восстановительных реакциях соединения меди (I) проявляют окислительно-восстановительную двойственность:
Например , при взаимодействии с угарным газом, более активными металлами или водородом оксид меди (II) проявляет свойства окислителя :
Cu2O + CO = 2Cu + CO2
А под действием окислителей, например, кислорода — свойства восстановителя :
Гидроксид меди (II)
Способы получения гидроксида меди (II)
1. Гидроксид меди (II) можно получить действием раствора щелочи на соли меди (II).
Например , хлорид меди (II) реагирует с водным раствором гидроксида натрия с образованием гидроксида меди (II) и хлорида натрия:
CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl
Химические свойства
Гидроксид меди (II) Сu(OН)2 проявляет слабо выраженные амфотерные свойства (с преобладанием основных ).
1. Взаимодействует с кислотами .
Например , взаимодействует с бромоводородной кислотой с образованием бромида меди (II) и воды:
2. Гидроксид меди (II) легко взаимодействует с раствором аммиака , образуя сине-фиолетовое комплексное соединение:
3. При взаимодействии гидроксида меди (II) с концентрированными (более 40%) растворами щелочей образуется комплексное соединение:
Но этой реакции в ЕГЭ по химии пока нет!
4. При нагревании гидроксид меди (II) разлагается :
Соли меди
Соли меди (I)
В окислительно-восстановительных реакциях соединения меди (I) проявляют окислительно-восстановительную двойственность . Как восстановители они реагируют с окислителями.
Например , хлорид меди (I) окисляется концентрированной азотной кислотой :
Также хлорид меди (I) реагирует с хлором :
2CuCl + Cl2 = 2CuCl2
Хлорид меди (I) окисляется кислородом в присутствии соляной кислоты:
4CuCl + O2 + 4HCl = 4CuCl2 + 2H2O
Прочие галогениды меди (I) также легко окисляются другими сильными окислителями:
Иодид меди (I) реагирует с концентрированной серной кислотой :
Сульфид меди (I) реагирует с азотной кислотой. При этом образуются различные продукты окисления серы на холоде и при нагревании:
Для соединений меди (I) возможна реакция диспропорционирования :
2CuCl = Cu + CuCl2
Комплексные соединения типа [Cu(NH3)2] + получают растворением в концентрированном растворе аммиака :
Соли меди (II)
В окислительно-восстановительных реакциях соединения меди (II) проявляют окислительные свойства.
Например , соли меди (II) окисляют иодиды и сульфиты :
2CuCl2 + 4KI = 2CuI + I2 + 4KCl
Бромиды и иодиды меди (II) можно окислить перманганатом калия :
Соли меди (II) также окисляют сульфиты :
Более активные металлы вытесняют медь из солей.
Например , сульфат меди (II) реагирует с железом :
CuSO4 + Fe = FeSO4 + Cu
Сульфид меди (II) можно окислить концентрированной азотной кислотой . При нагревании возможно образование сульфата меди (II):
Еще одна форма этой реакции:
CuS + 10HNO 3( конц .) = Cu(NO 3 ) 2 + H 2 SO 4 + 8NO 2 ↑ + 4H 2 O
При горении сульфида меди (II) образуется оксид меди (II) и диоксид серы:
2CuS + 3O2 2CuO + 2SO2↑
Соли меди (II) вступают в обменные реакции, как и все соли.
Например , растворимые соли меди (II) реагируют с сульфидами:
CuBr2 + Na2S = CuS↓ + 2NaBr
При взаимодействии солей меди (II) с щелочами образуется голубой осадок гидроксида меди (II):
CuSO 4 + 2NaOH = Cu(OH) 2 ↓ + Na 2 SO 4
Электролиз раствора нитрата меди (II):
Некоторые соли меди при нагревании разлагаются , например , нитрат меди (II):
Основный карбонат меди разлагается на оксид меди (II), углекислый газ и воду:
При взаимодействии солей меди (II) с избытком аммиака образуются аммиачные комплексы:
При смешивании растворов солей меди (II) и карбонатов происходит гидролиз и по катиону слабого основания, и по аниону слабой кислоты:
Видео:Качественная реакция на ион меди (II) I ЕГЭ по химииСкачать

Медь и соединения меди
1) Через раствор хлорида меди (II) с помощью графитовых электродов пропускали постоянный электрический ток. Выделившийся на катоде продукт электролиза растворили в концентрированной азотной кислоте. Образовавшийся при этом газ собрали и пропустили через раствор гидроксида натрия. Выделившийся на аноде газообразный продукт электролиза пропустили через горячий раствор гидроксида натрия. Напишите уравнения описанных реакций.
2) Вещество, полученное на катоде при электролизе расплава хлорида меди (II), реагирует с серой. Полученный продукт обработали концентрированной азотной кислотой, и выделившийся газ пропустили через раствор гидроксида бария. Напишите уравнения описанных реакций.
3) Неизвестная соль бесцветна и окрашивает пламя в желтый цвет. При легком нагревании этой соли с концентрированной серной кислотой отгоняется жидкость, в которой растворяется медь; последнее превращение сопровождается выделением бурого газа и образованием соли меди. При термическом распаде обеих солей одним из продуктов разложения является кислород. Напишите уравнения описанных реакций.
4) При взаимодействии раствора соли А со щелочью было получено студенистое нерастворимое в воде вещество голубого цвета, которое растворили в бесцветной жидкости Б с образованием раствора синего цвета. Твердый продукт, оставшийся после осторожного выпаривания раствора, прокалили; при этом выделились два газа, один из которых бурого цвета, а второй входит в состав атмосферного воздуха, и осталось твердое вещество черного цвета, которое растворяется в жидкости Б с образованием вещества А. Напишите уравнения описанных реакций.
5) Медную стружку растворили в разбавленной азотной кислоте, и раствор нейтрализовали едким кали. Выделившееся вещество голубого цвета отделили, прокалили (цвет вещества изменился на черный), смешали с коксом и повторно прокалили. Напишите уравнения описанных реакций.
6) В раствор нитрата ртути (II) добавили медную стружку. После окончания реакции раствор профильтровали, и фильтрат по каплям прибавляли к раствору, содержащему едкий натр и гидроксид аммония. При этом наблюдали кратковременное образование осадка, который растворился с образованием раствора ярко-синего цвета. При добавлении в полученный раствор избытка раствора серной кислоты происходило изменение цвета. Напишите уравнения описанных реакций.
7) Оксид меди (I) обработали концентрированной азотной кислотой, раствор осторожно выпарили и твердый остаток прокалили. Газообразные продукты реакции пропустили через большое количество воды и в образовавшийся раствор добавили магниевую стружку, в результате выделился газ, используемый в медицине. Напишите уравнения описанных реакций.
8) Твердое вещество, образующееся при нагревании малахита, нагрели в атмосфере водорода. Продукт реакции обработали концентрированной серной кислотой, внесли в раствор хлорида натрия, содержащий медные опилки, в результате образовался осадок. Напишите уравнения описанных реакций.
9) Соль, полученную при растворении меди в разбавленной азотной кислоте, подвергли электролизу, используя графитовые электроды. Вещество, выделившееся на аноде, ввели во взаимодействие с натрием, а полученный продукт реакции поместили в сосуд с углекислым газом. Напишите уравнения описанных реакций.
10) Твердый продукт термического разложения малахита растворили при нагревании в концентрированной азотной кислоте. Раствор осторожно выпарили, и твердый остаток прокалили, получив вещество черного цвета, которое нагрели в избытке аммиака (газ). Напишите уравнения описанных реакций.
11) К порошкообразному веществу черного цвета добавили раствор разбавленной серной кислоты и нагрели. В полученный раствор голубого цвета приливали раствор едкого натра до прекращения выделения осадка. Осадок отфильтровали и нагрели. Продукт реакции нагревали в атмосфере водорода, в результате чего получилось вещество красного цвета. Напишите уравнения описанных реакций.
12) Неизвестное вещество красного цвета нагрели в хлоре, и продукт реакции растворили в воде. В полученный раствор добавили щелочь, выпавший осадок голубого цвета отфильтровали и прокалили. При нагревании продукта прокаливании, который имеет черный цвет, с коксом было получено исходное вещество красного цвета. Напишите уравнения описанных реакций.
13) Раствор, полученный при взаимодействии меди с концентрированной азотной кислотой, выпарили и осадок прокалили. Газообразные продукты полностью поглощены водой, а над твердым остатком пропустили водород. Напишите уравнения описанных реакций.
14) Черный порошок, который образовался при сжигании металла красного цвета в избытке воздуха, растворили в 10%-серной кислоте. В полученный раствор добавили щелочь, и выпавший осадок голубого цвета отделили и растворили в избытке раствора аммиака. Напишите уравнения описанных реакций.
15) Вещество черного цвета получили, прокаливая осадок, который образуется при взаимодействии гидроксида натрия и сульфата меди (II). При нагревании этого вещества с углем получают металл красного цвета, который растворяется в концентрированной серной кислоте. Напишите уравнения описанных реакций.
16) Металлическую медь обработали при нагревании йодом. Полученный продукт растворили в концентрированной серной кислоте при нагревании. Образовавшийся раствор обработали раствором гидроксидом калия. Выпавший осадок прокалили. Напишите уравнения описанных реакций.
17) К раствору хлорида меди (II) добавили избыток раствора соды. Выпавший осадок прокалили, а полученный продукт нагрели в атмосфере водорода. Полученный порошок растворили в разбавленной азотной кислоте. Напишите уравнения описанных реакций.
18) Медь растворили в разбавленной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем – его полное растворение с образованием темно-синего раствора. Полученный раствор обработали серной кислотой до появления характерной голубой окраски солей меди. Напишите уравнения описанных реакций.
19) Медь растворили в концентрированной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем – его полное растворение с образованием темно-синего раствора. Полученный раствор обработали избытком соляной кислоты. Напишите уравнения описанных реакций.
20) Газ, полученный при взаимодействии железных опилок с раствором соляной кислоты, пропустили над нагретым оксидом меди (II) до полного восстановления металла. полученный металл растворили в концентрированной азотной кислоте. Образовавшийся раствор подвергли электролизу с инертными электродами. Напишите уравнения описанных реакций.
21) Йод поместили в пробирку с концентрированной горячей азотной кислотой. Выделившийся газ пропустили через воду в присутствии кислорода. В полученный раствор добавили гидроксид меди (II). Образовавшийся раствор выпарили и сухой твердый остаток прокалили. Напишите уравнения описанных реакций.
22) Оранжевый оксид меди поместили в концентрированную серную кислоту и нагрели. К полученному голубому раствору прилили избыток раствора гидроксида калия. выпавший синий осадок отфильтровали, просушили и прокалили. Полученное при этом твердое черное вещество в стеклянную трубку, нагрели и пропустили над ним аммиак. Напишите уравнения описанных реакций.
23) Оксид меди (II) обработали раствором серной кислоты. При электролизе образующегося раствора на инертном аноде выделяется газ. Газ смешали с оксидом азота (IV) и поглотили с водой. К разбавленному раствору полученной кислоты добавили магний, в результате чего в растворе образовалось две соли, а выделение газообразного продукта не происходило. Напишите уравнения описанных реакций.
24) Оксид меди (II) нагрели в токе угарного газа. Полученное вещество сожгли в атмосфере хлора. Продукт реакции растворили в в воде. Полученный раствор разделили на две части. К одной части добавили раствор иодида калия, ко второй – раствор нитрата серебра. И в том, и в другом случае наблюдали образование осадка. Напишите уравнения описанных реакций.
25) Нитрат меди (II) прокалили, образовавшееся твердое вещество растворили в разбавленной серной кислоте. Раствор полученной соли подвергли электролизу. Выделившееся на катоде вещество растворили в концентрированной азотной кислоте. Растворение протекает с выделением бурого газа. Напишите уравнения описанных реакций.
26) Щавелевую кислоту нагрели с небольшим количеством концентрированной серной кислоты. Выделившийся газ пропустили через раствор гидроксида кальция. В котором выпал осадок. Часть газа не поглотилась, его пропустили над твердым веществом черного цвета, полученным при прокаливании нитрата меди (II). В результате образовалось твердое вещество темно-красного цвета. Напишите уравнения описанных реакций.
27) Концентрированная серная кислота прореагировала с медью. Выделившийся при газ полностью поглотили избытком раствора гидроксида калия. Продукт окисления меди смешали с расчетным количеством гидроксида натрия до прекращения выпадения осадка. Последний растворили в избытке соляной кислоты. Напишите уравнения описанных реакций.
Видео:Качественная реакция на ион двухвалентной медиСкачать

Химия, Биология, подготовка к ГИА и ЕГЭ
Материал для задания 37 ЕГЭ (по-старому С2 ЕГЭ), для олимпиад, да и вообще для тех, кому нужны нормальные знания по химии
Автор статьи — Саид Лутфуллин
В статье приведены многие реакции, которые встречаются в ЕГЭ. Формулировки описания реакций тоже как в ЕГЭ, поэтому не удивляйтесь если встретите что-то вроде «…осадок растворяется в кислотах…», конечно же, он не растворяется, он реагирует с кислотой. Растворение – это немного другой процесс, но господа составители из ФИПИ со мной не согласны и упорно применяют в таких случаях именно этот термин.
Видео:Качественная реакция на ионы меди (II) №2Скачать

Уравнения качественных реакций неорганической химии.
(кликните на название категории, чтобы перейти в соответствующий раздел)
I. Элементы IA-группы (щелочные металлы)
– легкие металлы, настолько пластичные, что их можно разрезать ножом. Из-за чрезвычайной активности, на воздухе легко окисляются (некоторые со взрывом), поэтому их хранят в керосине, кроме лития. Литий хранить в керосине невозможно из-за физических свойств. Этот металл легче керосина, поэтому всплывает в нем. Литий хранят в вазелине или еще в чем-нибудь таком инертном и вязком.
Почти все соли щелочных металлов растворимы в воде.
Поэтому обнаружение их катионов выпадением осадка невозможно. Для определения катионов металлов используют метод пирохимического анализа.
Этот метод основан на способности ионов металлов, входящих в состав летучих солей, окрашивать пламя горелки в определенный цвет.
1) Li +
Окрашивает пламя горелки в карминово-красный цвет
Помимо этого, литий – один единственный щелочной металл, катион которого можно обнаружить с помощью осадка. Катион лития с фосфат-ионом дает белый осадок:
Сокращенное ионное уравнение:
3Li + + PO4 3- → Li3PO4↓
2) Na +
Окрашивает пламя горелки в желтый цвет.
3) K +
Окрашивает пламя горелки в фиолетовый цвет.
4) Rb +
Окрашивает пламя горелки в розово-фиолетовый цвет.
5) Cs +
Окрашивает пламя горелки в голубовато-фиолетовый цвет.
II. Щелочноземельные металлы (подгруппа кальция)
– металлы серого цвета. Твердые, ножом не режутся. На воздухе ведут себя спокойно: покрываются оксидной пленкой.
Определить катионы щелочноземельных металлов можно как с помощью выпадения осадка, так и с помощью пирохимического метода:
1. Ca 2+
Образует белый осадок с карбонат-ионом : CaCl 2 + K 2 CO 3 → CaCO 3 ↓ + 2 KCl
Сокращенное ионное уравнение: Ca 2+ + CO 3 2- → CaCO 3 ↓
Образуется карбонат кальция – мел. Так же карбонат кальция – составная часть накипи. Иногда можно встретить формулировку: «…белый осадок, растворимый в кислотах с выделением газа (без цвета, вкуса, запаха)…». Имеется в виду реакция карбонатов с кислотами:
Катион кальция окрашивает пламя горелки в оранжево-красный цвет .
2. Sr 2+
Образует белый нерастворимый в кислотах осадок с сульфат-ионом : SrCl 2 + K 2 SO 4 → SrSO 4 ↓ + 2 KCl
Сокращенное ионное уравнение: Sr 2+ + SO 4 2- → SrSO 4 ↓
Окрашивает пламя горелки в темно-красный цвет .
3. Ba 2+
Образует белый нерастворимый в кислотах осадок с сульфат-ионом : BaCl 2 + K 2 SO 4 → BaSO 4 ↓ + 2 KCl
Сокращенное ионное уравнение: Ba 2+ + SO 4 2- → BaSO 4 ↓
Катионы бария окрашивают пламя горелки в зеленый цвет
4. Mg 2+
Определяется, как и кальций, карбонат-ионами .
Карбонат магния – белый осадок: Mg ( NO 3 ) 2 + K 2 CO 3 → MgCO 3 ↓ + 2 KNO 3
Сокращенное ионное уравнение: Mg 2+ + CO 3 2- → MgCO 3 ↓
III. Be 0 (Be 2+ ), Zn 0 (Zn 2+ ), Al 0 (Al 3+ )
эти три металла объединяют амфотерные свойства. Поэтому если в задании встречается следующая формулировка: «…металл, растворимый в раствор е щелочи…», «…металл, который растворяется и в щелочах, и кислотах…» или «…металл, растворяющийся в щелочи с выделением горючего газа, легче воздуха…» , то имеют в виду один из этих трех металлов.
Ионы этих металлов в растворах тоже определяют добавлением щелочи.
Выпадает белый студенистый осадок (гидроксид металла), который в избытке щелочи растворяется (гидроксиды алюминия, цинка и бериллия реагируют со щелочами, образуя растворимые гидроксоалюминаты, гидроксоцинкаты и гидроксобериллаты соответственно):
BeCl 2 + 2 KOH → Be ( OH ) 2 ↓ + 2 KCl
(образование осадка) сокращенное ионное уравнение:
Be 2+ + 2 OH — → Be ( OH ) 2 ↓ Be ( OH ) 2 + 2 KOH → K 2 [ Be ( OH ) 4 ] (растворение осадка)
ZnCl 2 + 2 KOH → Zn ( OH ) 2 ↓ + 2 KCl (образование осадка)
сокращенное ионное уравнение: Zn 2+ + 2 OH — → Zn ( OH ) 2 ↓
Zn ( OH ) 2 + 2 KOH → K 2 [ Zn ( OH ) 4 ] (растворение осадка)
AlCl 3 + 3 KOH → Al ( OH ) 3 ↓ + 3 KOH (образование осадка)
сокращенное ионное уравнение:
Al 3+ + 3 OH — → Al ( OH ) 3 ↓
Al ( OH ) 3 + KOH → K [ Al ( OH ) 4 ] (растворение осадка)
Оксиды этих металлов, как и гидроксиды, растворяются в кислотах и щелочах, рассмотрим на примере оксида алюминия:
У гидроксида цинка есть характерная особенность: он растворяется в NH 3 (водн.)
Ион Zn 2+ с S 2+ образует белый осадок . Который растворяется в кислотах с выделением газа с запахом тухлых яиц – сероводорода (про него подробнее ниже, в разделе сера):
ZnSO 4 + K 2 S → ZnS ↓ + K 2 SO 4 (образование осадка)
Сокращенное ионное уравнение:
ZnS + H 2 SO 4 → ZnSO 4 + H 2 S ↑ (растворение осадка с выделением сероводорода)
Медь – пластичный розовато-красный металл.
Хороший проводник электрического тока.
Не вытесняет из кислот водород.
Реагирует только с кислотами-окислителями (азотной и концентрированной серной):
Оксид меди – CuO – черный – основный.
Растворяется в кислотах, окрашивая раствор в голубой цвет: CuO + 2HCl → CuCl 2 + H 2 O
Cu 2+
Летучие соли меди окрашивают пламя горелки в зеленый цвет. Соединения меди имеют голубоватую окраску , это можно использовать как диагностический признак.
В растворе ионы меди можно обнаружить добавлением щелочи выпадает растворимый в кислотах, голубой осадок, который используется в нескольких качественных реакциях органической химии.
Сокращенное ионное уравнение:
Осадок Cu ( OH ) 2 растворяется в избытке NH 3 (водн.) образуя интенсивно синий раствор:
Если нагреть осадок Cu ( OH ) 2 , то он почернеет. Потому что гидроксид меди( II ) – нерастворимое основание и разлагается:
Голубой – это фирменный цвет соединений меди, и если в задании ЕГЭ написано про этот цвет, то 90% вероятности, что говорят про соединение меди.
Серебро – мягкий благородный металл. Цвет серебристый.
Оксид серебра Ag 2 O- черный – основный.
Ag +
Катион серебра с хлорид-ионом дает белый творожистый осадок : AgNO 3 + KCl → AgCl ↓ + KNO 3
сокращенное ионное уравнение: Ag + + Cl — → AgCl ↓
Осадок хлорида серебра (и остальные галогениды) , как и гидроксида меди, растворяется в NH 3 * H 2 O
Еще одна особенность серебра, которая позволяет определить его ионы в растворе, – это его гидроксид, который нестабилен и быстро разлагается в водном растворе.
При добавлении к раствору соли серебра щелочи , выпадает черный осадок оксида серебра :
AgNO 3 + KOH → KNO 3 + AgOH
можно (и грамотнее) записать сразу:
То есть при добавлении к соли серебра щелочи выпадает черный осадок . Осадок оксида серебра , как и галогениды этого металла, растворяются в NH 3 (водн.) :
[ Ag ( NH 3 ) 2 ] OH – гидроксид диамминсеребра( I ) известен как раствор Толленса.
Он используется в качественной реакции на альдегиды (реакция серебряного зеркала).
Оксид серебра как основный гидроксид растворяется в кислотах (само собой, в тех, с которыми серебро может образовать растворимую соль):
Железо – серебристо-белый пластичный металл.
Обладает магнитными свойствами.
Вытесняет из растворов кислот водород (кроме азотной). Обратите внимание, что при взаимодействии с кислотами-неокислителями, и слабыми окислителями железо приобретает степень окисления +2, а при взаимодействии с сильными окислителями оно приобретет степень окисления +3:
2 Fe + 3 Cl 2 ( t )→ 2 FeCl 3
Катион Fe 3+
При добавлении к раствору, содержащему ионы трехвалентного железа , выпадает бурый осадок гидроксида железа ( III ):
Сокращенное ионное уравнение:
Оксид и гидроксид железа( III ) – амфотерные соединения, поэтому они растворяются в щелочах и кислотах:
Катион Fe 2+ с гидроксид ионом тоже образует осадок, только зеленоватого цвета .
Сокращенное ионное уравнение: Fe 2+ + 2 OH — → Fe ( OH ) 2 ↓
Оксид и гидроксид железа( II ) – основные.
В щелочах не растворяются. Осадок со временем буреет (меняет степень окисления с 2+ на +3):
На ионы железы есть еще две похожие канонические качественные реакции. Образуется одно и то же вещество: берлинская лазурь, или турнбулева синь.
Раньше считали, что это два разных вещества, в книжках писали: «не путайте», а потом оказалось, что это не так.
Ион Fe 2+ определяется добавлением красной кровяной соли (гексацианоферрат (III) калия):
4Fe 2+ + 3 [Fe III (CN) 6 ] 3− → Fe III 4 [Fe II (CN) 6 ] 3 ↓
Ион Fe 3+ определяется добавлением желтой кровяной соли (гексацианоферрат (II) калия):
4Fe 3+ + 3 [Fe II (CN) 6 ] 4− → Fe III 4 [Fe II (CN) 6 ] 3 ↓
Не очень активный, так как покрывается оксидной пленкой.
Название элемента переводится с греческого «цвет», потому что соединения хрома, как правило, окрашены. Простое вещество хром ведет себя как типичный металл, со щелочами не реагирует.
Реагирует с кислотами. Кислоты-неокислители ( в том числе разбавленная серная кислота) и вообще слабые окислители переводят хром в степень окисления +2:
Cr + S (t)→ CrS C окислителями приобретает степень окисления +3:
В общем тут все как у железа. Правило простое и вполне логичное.
С азотной и концентрированной серной кислотой не реагирует, так как пассивируется.
Проявляет несколько устойчивых степеней окисления.
Степень окисления +2
В этих соединениях хром проявляет сильные восстановительные свойства.
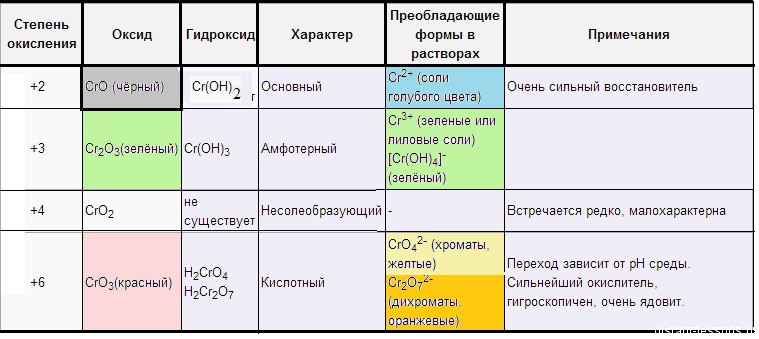
Оксид хрома ( II ) – CrO (основный) – черный.
Растворы солей Cr 2+ голубые . Если обработать черный оксид хрома( II ) соляной кислотой, образуется голубой раствор :
Если к раствору соли двухвалентного хрома добавить щелочь выпадет желтый осадок гидроксида хрома( II ), (осадок на воздухе зеленеет, об этом чуть позже):
Сокращенное ионное уравнение:
Гидроксид хрома( II ) основный,
поэтому он не растворяется в щелочах, зато прекрасно растворяется в кислотах, образуя все тот же синий раствор:
Степень окисления +3.
Оксид хрома( III ) – Cr 2 O 3 (амфотерный) – зеленый .
Как амфотерный оксид Cr 2 O 3 растворяется в кислотах и щелочах:
Соли трехвалентного хрома могут быть разного цвета (от фиолетового до темно-зеленого). Поэтому визуально опознать соль трехвалентного хрома со 100% уверенностью нельзя. Наличие катионов Cr 3+ в растворе определяется добавлением щелочи .
Cr 3+ с гидроксид-ионами образует зеленый осадок гидроксида хрома( III ) :
Сокращенное ионное уравнение:
Cr 3+ + 3 OH — → Cr ( OH ) 3 ↓
Выпавший осадок – гидроксид хрома( III ) амфотерный, поэтому растворяется в кислотах и щелочах, с образованием зеленых солей – гидроксохроматов :
Если оставить на некоторое время на воздухе желтый осадок гидроксида хрома( II ) , то он позеленеет . Cr +2 окисляется до Cr +3 ,
образуется зеленый гидроксид хрома( III ) :
Если подействовать на соединение хрома (+3) сильным окислителем, то произойдет смена окраски. Она станет желтой. Хром окислится до +6
Степень окисления +6.
В этих соединениях хром проявляет сильные окислительные свойства.
Оксид хрома( VI ) – CrO 3 (кислотный) – красный .
Окисляет многие органические соединения. Этот процесс описывают как «растворение [оксида хрома VI ] в спиртах (альдегидах, эфирах)»
Оксид кислотный, поэтому в кислотах не растворяется, растворяется в щелочах, с образованием хроматов:
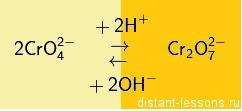
Хроматы – это соли хромовой кислоты ( H 2 CrO 4 ). Они желтого цвета. Кроме хромовой (хром +6) образует дихромовую кислоту ( H 2 Cr 2 O 7 ), ее соли – бихроматы (дихроматы) оранжевые .
Хроматы и бихроматы переходят друг в друга при изменении кислотности среды (с щелочной на кислую и наоборот):
То есть в кислой среде более устойчивы бихроматы, в щелочной хроматы.
Хроматы и бихроматы так же являются сильнейшими окислителями.
При добавлении к раствору хромата катионов бария выпадает желтый осадок хромата бария BaCrO 4 :
Сокращенное ионное уравнение: Ва 2+ + СrO 4 2- → BaCr O 4 ↓
Полученный хромат бария растворяется в сильных неорганических кислотах. Потому что, как уже говорилось ранее, в кислой среде хроматы не устойчивы и переходят в бихроматы:
2 BaCrO 4 + 2 H + → 2 Ba 2+ + Cr 2 O 7 2- + H 2 O
Компактная таблица цветов соединения хрома, приведена у нас в статье “Хром”:
Как и хром малоактивен за счет пассивации.
Реагируя с кислотами (даже с кислотами-окислителями), окисляется до +2:
Mn + HCl → MnCl2 + H2↑
Mn + 2H2SO4(конц.) → MnSO4 + SO2↑ + 2H2O
В более агрессивных средах с кислотами-окислителями процесс окисления идет глубже: до +4 и +7.
Кислородом окисляется до +4 (там конечно есть другие варианты с другими температурами, но мы их рассматривать не будем):
Галогены (кроме фтора) до +2:
Mn + Cl2 (t)→ MnCl2
Проявляет различные степени окисления.
Степень окисления 2+.
Степень окисления 2+. Оксид марганца( II ) – MnO (основный) зеленого цвета .
На воздухе очень быстро окисляется до темно-бурого MnO 2 :
Соли, содержащие катион Mn 2+ как правило имеют бледный светло-розовый цвет .
Катион Mn 2+ обнаруживают гидроксид-ионами, с которыми он образует розовато-белый осадок гидроксида марганца( II ), который окисляется на воздухе и буреет (превращается в бурый оксид марганца( II )):
MnCl 2 + 2 KOH → Mn ( OH ) 2 ↓ + 2 KCl
Сокращенное ионное уравнение:
Mn 2+ + 2 OH — → Mn ( OH ) 2 ↓
Степень окисления 4+. Оксид марганца( IV ) – MnO 2 (амфотерный) т емно-бурый – одно из самых устойчивых и встречаемых соединений марганца.
Mn +4 O 2 + 4 HCl → Mn +2 Cl 2 + Cl 2 ↑ + 2 H 2 O
Степень окисления +6. Оксид марганца( VII ) – Mn 2 O 7 (кислотный) зелено-бурая жидкость.
Очень не стабильное и агрессивное вещество, может спонтанно взорваться. Сильный окислитель.
Оксиду марганца( VII ) соответствует марганцевая кислота HMnO 4 .
Она существует только в водном растворе, который как и растворы ее солей (перманганатов) имеет фиолетово-малиновую окраску .
Перманганаты так же являются сильными окислителями.
В ЕГЭ часто встречаются реакции окисления органических веществ перманганатом калия – это классика:
Приведенное выше уравнение – это качественная реакция на кратные связи – обесцвечивание раствора перманганата и выпадение темно-бурого осадка.
Это весьма необычное вещество. Может быть, трудно представить, но среди всех простых веществ есть только два, которые при нормальных условиях находятся в жидком агрегатном состоянии. Это бром и ртуть.
В нормальных условиях ртуть – серебристо-белая жидкость, с высокой плотностью, поэтому она тонет в воде.
Сама по себе металлическая ртуть вреда не представляет, а вот ее пары и соединения (в особенности органические) чрезвычайно ядовиты.
Качественная реакция на Hg 2+ : при добавлении к раствору соли ртути( II ) щелочи выпадает оранжевый осадок ОКСИДА ртути , гидроксид не образуется, его не существует:
NH 4 + – ион аммония
Если добавить к раствору аммония (иногда нужно нагреть) щелочь образуется нестабильный гидроксид аммония, который разлагается. В ыделяется аммиак – газ с реким запахом (запах нашатырного спирта) :
Можно записать сразу: NH 4 NO 3 + KOH → NH 3 ↑ + H 2 O + KNO 3
Сокращенное ионное уравнение: NH 4 + + NO 3 — → NH 3 ↑ + H 2 O
Выделившийся газ (аммиак) может быть поглощен растворами кислот, с образованием солей аммония: NH 3 + HCl → NH 4 Cl
H +
– частица, в которую превращается атом водорода, отдав электрон.
Получается протон, понятное дело, такая частица в воде не существует.
Частица эта прикреплена по донорно-акцепторному механизму к атому кислорода в молекуле воды, получается ион гидроксония: H 3 O + .
О чем свидетельствует наличие в растворе такого иона?
Конечно же о том, что среда раствора кислая.
А для определения кислотности используют индикаторы.
Рассмотрим несколько индикаторов: лакмус фиолетовый , метиловый оранжевый , фенолфталеин .
Лучше учить названия индикаторов именно так, ведь в таких названиях заключена информации о цвете индикатора в нейтральной среде:
метиловый оранжевый – оранжевый,
| Индикатор | Цвет в кислой среде pH | Цвет в нейтральной среде pH = 7 Цвет в щелочной среде pH > 7 | |
| Лакмус фиолетовый | Красный | Фиолетовый | Синий |
| Метиловый оранжевый | Красный | Оранжевый | Желтый |
| Фенолфталеин | Нет (бесцветный) | Нет (бесцветный) | Малиновый |
Существует несколько мнемонических правил для запоминания цветов индикаторов:
Фенолфталеиновый в щелочах малиновый, но несмотря на это в кислотах он без цвета.
В кислотах лакмус красный – цвет такой прекрасный, а в щелочах он синий как январский иней, а в нейтральной среде фиолетовый, как нигде. (Этот стишок сочинили когда-то мы с товарищем. Хоть он не совсем складный и мы так и не можем объяснить, с чего бы это иней, который обычно белый, в январе вдруг станет синим, стишок как-то по-особенному запал в мою память, всегда им пользуюсь)
Кислота – начинается на букву К, как и слово «кислый» — помогает вспомнить цвет лакмуса и метилоранжа в кислотах.
– элементы VIIA -группы( F , Cl , Br , I ), типичные неметаллы.
Пойдем по порядку:
Фтор – F 2 – желтый газ с легким зеленым отливом. Самый электроотрицательный неметалл, поэтому с кислородом образует не оксид фтора, а фторид кислорода: OF 2 степень окисления кислорода в нем равна +2. Чрезвычайно активное вещество, реагирует со всем, с чем не лень. И большинство реакций протекает бурно, взрывообразно.
Фторид-ионы ( F — ) в растворе определяются добавлением катионов кальция ( Ca 2+ ), наблюдается выпадение белого осадка :
2 KF + CaCl 2 → 2 KCl + CaF 2 ↓
Сокращенное ионное уравнение: Ca 2+ + 2 F — → CaF 2 ↓
- Хлор – Cl 2 – зеленый газ, с характерным резким запахом, сильный яд, тяжелее воздуха (при химической атаке стелется по земле):
Хлорид-ионы ( Cl — ) в растворе определяются добавлением катионов серебра ( Ag + ), наблюдается выпадение белого творожистого осадка (об этой реакции говорилось ранее в разделе серебро):
KCl + AgNO 3 → AgCl ↓ + KNO 3
Сокращенное ионное уравнение: Ag + + Cl — → AgCl ↓
- Бром – Br 2 – красно-бурая летучая жидкость, имеющая очень резкий неприятный запах.
Бромд-ионы ( Br — ) в растворе определяются добавлением катионов серебра ( Ag + ), наблюдается выпадение слегка желтоватого осадка :
KBr + AgNO 3 → AgBr ↓ + KNO 3
Сокращенное ионное уравнение: Ag + + Br — → AgBr ↓
- Иод – I 2 – летучие черно-серые с фиолетовым отливом кристаллы. Пары фиолетовые, имеют характерный запах.
Иодид-ионы ( I — ) в растворе определяются добавлением катионов серебра ( Ag + ), наблюдается выпадение желтоватого осадка (цвет интенсивнее, чем у бромида серебра) :
Сокращенное ионное уравнение: Ag + + I — → AgI ↓
Осадки-галогениды не растворяются в разбавленных кислотах.
Простое вещество сера – хрупкие желтые кристаллы.
Сера может проявлять различные степени окисления:
Степень окисления -2:
в сульфИД-ионе ( S 2- ) и гидросульфИД-ионе ( HS — ).
СульфИДы (и гидросульфИДы) – это соли сероводородной кислоты, которая является слабым электролитом. Поэтому сильные кислоты вытесняют ее из растворов солей. Выделяется H 2 S – сероводород, газ с неприятным запахом тухлых яиц :
K 2 S + 2HCl → 2KCl + H 2 S↑
Сокращенное ионное уравнение: 2 H + + S 2- → H 2 S ↑
Выделившийся газ ( H 2 S ) на воздухе сгорает синим пламенем (не в смысле, что выделился и сразу сгорел, а если начать сжигать):
Так же сероводород ( H 2 S ) может быть поглощен растворами щелочей: H 2 S + 2 NaOH →
Сероводород является хорошим восстановителем, так как сера в нем в низшей степени окисления.
Еще одна особенность ионов S
2- позволяет легко определить их в растворе. Ионы S 2- образуют осадки со многими тяжелыми металлами:
- Классическая реакция с ионами Pb2+ . Образуется черный осадок сульфида серы :
- С ионами Cu 2+ , Fe 2+ , Ni 2+ , Cu 2+ , Pb 2+ , Hg 2+ , Ag + и ионами многих других металлов тоже образуются осадки черного цвета .
- С ионом Zn 2+ образуется белый осадок (один из немногих нечерных нерастворимых сульфидов):
Так как сера в сульфид-ионе в низшей степени окисления, она может окислиться. При действии сильных окислителей на сульфиды они окисляются до сульфатов (как правило). Классическая ЕГЭ-шная реакция, цитата из С2: «…черный осадок побелел после обработки его пероксидом водорода… ». Речь идет о
черном осадке сульфида свинца ( PbS ). Пероксид водорода H 2 O 2 (сильный окислитель) превращает черный сульфид свинца в белый (тоже нерастворимый) сульфат свинца ( PbSO 4 ):
Степень окисления + 4:
встречается в оксиде серы ( IV ) (сернистом газе – SO 2 ), в соответствующей этому оксиду кислоте – сернистой ( H 2 SO 3 , существующей только в растворе) и в солях сернистой кислоты – сульфИТах и гидросульфИТах.
Сернистый газ ( SO 2 ) – бесцветный газ с резким запахом (по легендам – запахом ада). Его можно почувствовать чиркнув спичку. Образуется при сжигании серы, сероводородов, сульфидов, серосодержащих органических веществ. Классическое школьное уточнение: « обесцвечивает раствор фуксина и фиолетовые чернила », при этом совсем не обязательно знать, что такое фуксин, и какие реакции протекают. Просто хорошо бы запомнить эту формулировку.
Так как является кислотным оксидом, реагирует с растворами щелочей. (формулировка из задания ЕГЭ: «…выделившийся газ с резким запахом был поглощен раствором щелочи…» ). Образуются соли сернистой кислоты – сульфиты:
СульфИТ-ионы и гидросульфИТ-ионы в растворе можно обнаружить добавлением сильной кислоты. При этом из раствора сульфита (гидросульфита) вытесняется сернистая кислота: H 2 SO 3 , которая не стабильная, поэтому быстро разлагается на воду и соответствующий оксид ( SO 2 ). То есть, если совсем коротко: при действии на сульфиты и гидросульфиты кислот выделяется SO 2 – газ с резким запахом (обесцвечивающий раствор фуксина и фиолетовые чернила):
Можно (и грамотнее) записать сразу:
Степень окисления +6
встречается в серном ангидриде (оксиде серы( VI ) – SO 3 ), в соответствующей ему серной кислоте ( H 2 SO 4 ) и в ее солях, сульфАТах.
Серный ангидрид ( SO 3 ) и серная кислота( H 2 SO 4 ) содержат серу в высшей степени окисления, поэтому являются сильными окислителями.
Сульфаты в растворе определяются добавлением катионов бария ( Ba 2+ ). Сульфат-ион с катионом бария образует белый осадок ( нерастворимый в кислотах ):
Сокращенное ионное уравнение: Ва 2+ + S O 4 2- → BaS O 4 ↓
CO 3 2-
– карбонат-ион и HCO 3 — – гидрокарбонат-ион
являются анионом слабой, нестабильной, существующей только в растворе, угольной кислоты. Поэтому она легко вытесняется сильными кислотами из растворов солей (карбонатов и гидрокарбонатов).
Вытесняется и тут же распадается на воду и углекислый газ.
При действии кислот на карбонаты выделяется бесцветный газ без вкуса и запаха :
Можно (и грамотнее) записать сразу: K 2 CO 3 + 2 HCl → 2 KCl + CO 2 ↑ + H 2 O
Эта качественная реакция вам хорошо известна, вы наверняка проводили ее у себя дома. Добавим уксус к соде, и как раз будет выделяться газ, в чем можно убедиться если поднести спичку, она погаснет, так как CO 2 не поддерживает горения:
Выделившийся углекислый газ может быть поглощен раствором щелочи:
В связи со способностью поглощаться щелочами для описания углекислого газа часто встречается следующая формулировка: «… газ, при пропускании его через известковую воду, вызвал ее помутнение… ». Известковая вода – это профильтрованный раствор гидроксида кальция (гидроксид кальция полностью не растворяется в воде, образуется взвесь, и чтобы получить прозрачный раствор – его фильтруют, для очищения от не растворившихся частиц гидроксида кальция). При взаимодействии гидроксида кальция с углекислым газом образуется нерастворимый карбонат кальция, который и обеспечивает мутность:
PO 4 3-
– анион ортофосфорной кислоты (H 3 PO 4 ). В растворе его можно определить добавлением катионов серебра , при этом выпадает интенсивно-желтый осадок :
Сокращенное ионное уравнение: 3 Ag + + PO 4 3- → Ag 3 PO 4 ↓
SiO 3 2-
– анион кремниевой кислоты ( H 2 SiO 3 ) , которая являясь слабым электролитом, вытесняется из растворов ее солей. Кроме того, кремниевая кислота малорастврима в воде, поэтому в момент вытеснения ее из раствора соли, появляется гелеобразный осадок – это и будет H 2 SiO 3 :
Кремниевая кислота настолько слабая, что вытесняется даже угольной:
– оксид азота ( VI ).
Ядовитый газ с неприятным запахом бурого цвета.
В ЕГЭ его обычно именно так и обзывают – бурый газ .
Химически очень активное вещество:
- при взаимодействии не очень активных металлов с HNO 3 концентрированной;
- при разложении нитратов этих металлов.
В реакции с водой диспропорционируется, образуя азотную и азотистую кислоты:
Похожая реакция диспропорционирования происходит при растворении NO 2 в щелочах (образуются не кислоты, а соли этих кислот, нитраты и нитриты соответственно):
В присутствии избытка кислорода реакция идет без образования азотистой кислоты (диспропорционирования не происходит):
OH —
Наличие в растворе ионов OH — указывает на щелочную реакцию среды ( pH >7).
Определить pH можно с помощью индикаторов.
Окраски индикаторов в разных средах указаны в пункте про ион H + . Щелочную среду имеют не только щелочи, но и растворы аммиака и аминов, растворы солей, образованных сильными основаниями и слабыми кислотами.
Если нужно определить щелочь, то к раствору надо добавить соль металла, образующего слабое основание. Щелочь с такой солью даст осадок гидроксида металла:
CuCl 2 + 2NaOH → Cu(OH) 2 ↓ + 2NaCl
Видео:Качественная реакция на ион трехвалентного железаСкачать

Качественные реакции на ионы некоторых металлов
Ионы Ва 2+
Ва 2+ + SO4 2- → Ва SO4↓- белый осадок, который нерастворим ни в воде, ни в кислотах, ни в щелочах. Этой же реакцией распознают соли серной кислоты, т.е. ион SO4 2- .
Ионы Fe 3+
Образуется темно-синий осадок «берлинской лазури» состава Fe4[Fe(NC)6]3↓ или КFe[Fe(NC)6] в зависимости от концентраций растворов.
б) FeCI3 + 6 КNCS → K3[Fe(NCS)6] + 3KCI
р-р кроваво-красный цвет
Ионы Fe 2+ :
Образуется синий осадок «турнбулевой сини»
Ионы Ag + :AgNO3 + HCI → AgCI↓+ HNO3
Образуется белый осадок AgCI↓, нерастворимый в кислотах, но растворим в растворе аммиака AgCI +2NH3→ [Ag(NH3)2]CI
Ионы Cu 2+ :
1.Соли меди (Cu 2+ ) окрашивают раствор в голубой цвет:
Образует вишневый осадок.
Рассмотрим химические свойства некоторых металлов
Химия железа
При нагревании Fe реагирует с неметаллами: О2, N2, Hal, C, S. Оно реагирует с водой и воздухом, образуя ржавчину Fe2O3·H2O: с водяным паром в результате реакции получается оксид Fe (П,Ш), Fe3O4:
Оксиды также получаются при нагревании Fe на воздухе.
Железо реагирует с разбавленными растворами H2SO4 и НСI, образуя соли Fe 2+ и водород. С разбавленной азотной кислотой железо образует нитрат железа (Ш) и NO. Концентрированная азотная кислота пассивирует Fe.
Медь. Медь – малоактивный металл.Основными рудами являются: медный колчедан CuFeS2 и медный блеск CuS. Руду прокаливают с кремнеземом в присутствии воздуха. При этом получается сульфид меди и силикат железа:
Полученный сульфид Cu2S переводят в металлическую медь прокаливанием в печи: Cu2S (тв) + О2 (г) → 2Cu(тв) + SO2(г)
Медь очищают электролизом. Из меди, обладающей хорошей теплопроводностью, изготавливают кухонную посуду. Высокая электропроводность меди делает ее исключительно превосходным материалом для изготовления электрических проводов и кабелей. Медь устойчива к коррозии и из нее изготавливают детали водяных насосов. Широкое применение нашли сплавы меди: (Cu, Zn), бронза (Cu,Sn), сплав для чеканки монет (Cu,Ni).
Химические свойства меди
Медь реагирует с О2, S, На1 и кислотами окислителями.
Соединения меди
Cu2O (кр) Получение
Восстановление Cu 2+ в щелочном растворе альдегидом или SO2
· проба на альдегиды
· с НС1 (конц) →[CuС12] — (водн)
· кислотами →соли Cu 2+
CuO: Оксид меди (П) – черного цвета
· получение: прокаливание нитрата, карбоната меди
· Сu (OH)2 –голубого цвета, который растворяется в NH3→[Cu(NH3)4] 2+
· Соли получают:
· Нагреванием CuO с разбавленными кислотами
· Нагревание CuO с НаI (исключая йод)
· Пропусканием H2S через раствор солей Cu 2+ (водн) или добавление к раствору S 2-.
Цинк
Цинк выделяют из цинковой обманки или карбоната Zn.
Zn и Zn 2+ имеют заполненную d-орбиталь, поэтому его соединения бесцветны. Неспособность d-электронов принимать участие в металлической связи определяет низкие по сравнению с другими переходными металлами температуры кипения и плавления цинка.
Zn похож на переходные металлыпо своей способности к комплексообразованию иона Zn (П) — [Zn (Н2О)6] 2- . Он также взаимодействует с щелочами, образуя соли тетрагидроксоцинкат иона — [Zn(ОН)4] 2- , выделяя при этом водород:
Zn (тв) + 2ОН — (водн) + 2Н2О (ж) → [ Zn (ОН)4] 2- (водн) + Н2(г)
Zn используют в качестве гальванического покрытия железа и стали, а также при выплавки бронзы (Cu, Zn).
Оксид ZnО (бел.) Получение, некоторые свойства.Получают прокаливанием ZnСО3, Zn(NO3)2 или Zn(ОН)2. Амфотерен. При нагревании желтеет, теряя некоторое количество кислорода, который при охлаждении присоединяется обратно; образование вакансий в кристаллической решетке приводит в этом и в некоторых других случаях к появлению окраски;
Гидроксид Zn(ОН)2 — добавление ОН — (водн)к растворам солейсопровождается появлением желеобразного осадка: амфотерен.
Хлорид цинка ZnCI2·2H2O Действием соляной кислоты на Zn, ZnО или ZnСО3; попытки получить бесцветные соли из кристаллогидрата приводит к образованию Zn(ОН)С1; Добавление НСО3 — (водн) к раствору солей Zn 2+ ведет к осаждению основного карбоната [ZnСО3·2 Zn(ОН)2].
Задачи с решениями
ЗАДАЧА 1.КОНЦЕНТРИРОВАННЫЕ РАСТВОРЫ KMnO4 ВЫЗЫВАЮТ ОЖОГИ СЛИЗИСТОЙ ОБОЛОЧКИ ПОЛОСТИ РТА, ПИЩЕВОДА, ЖЕЛУДКА. В КАЧЕСТВЕ «ПРОТИВОЯДИЯ» ПРИ ТАКИХ ОЖОГАХ ИСПОЛЬЗУЮТ РАСТВОР, В 1 л КОТОРОГО СОДЕРЖИТСЯ 50 мл 3%-ного РАСТВОРА ПЕРОКСИДА ВОДОРОДА И 100 мл СТОЛОВОГО УКСУСА (3%-ный ВОДНЫЙ РАСТВОР УКСУСНОЙ КИСЛОТЫ). РАССЧИТАЙТЕ ОБЪЕМ ГАЗА (Н.У.), КОТОРЫЙ ВЫДЕЛЯЕТСЯ ПРИ ОБРАБОТКЕ 1,58 г KMnO4 ИЗБЫТКОМ ТАКОГО РАСТВОРА.
Решение
1.Химизм процесса выражается уравнением
Ионы Mn 2+ менее опасны в сравнении с ионами MnO4 — .
2. По уравнению: ν (О2)=2,5· ν (KMnO4), где
ν (KMnO4)= m (KMnO4)/ М (KMnO4)= 1,58 г / 158 г/моль =0,01 моль
3. V (O2) = Vm· ν (О2) =22, 4 /моль· 0,025 моль= 0, 56 л
Ответ: V (O2) (н.у.) = 0, 56 л.
ЗАДАЧА 2.ДОПУСТИМО ЛИ ОДНОВРЕМЕННОЕ ВВЕДЕНИЕ ВНУТРЬ БОЛЬНОМУ FeSO4 и NaNO3, УЧИТЫВАЯ, ЧТО СРЕДА В ЖЕЛУДКЕ КИСЛАЯ?
Решение
φ 0 Fe 3+ /Fe 2+ =+0,77 B; φ 0 NO2 — /NO =+0,99 B.
Так как φ 0 NO2 — /NO > φ 0 Fe 3+ /Fe 2+, то окислитель NO2 — ,а восстановитель Fe 2+ .
2Fe 2+ -2e →2Fe 3+ │1
2Fe 2+ +2 NO2 — + 4H + →2Fe 3+ + 2 NO +2H2O
Ответ: FeSO4 и NaNO2 в кислой среде взаимодействуют, поэтому их одновременное введение недопустимо.
ЗАДАЧА 3.ЖЕЛЕЗНУЮ ПЛАСТИНКУ МАССОЙ 5,2 г ВЫДЕРЖИВАЛИ В РАСТВОРЕ, СОДЕРЖАЩЕМ 1,6 г CuSO4. ЧЕМУ СТАЛА РАВНА МАССА ПЛАСТИНКИ ПОСЛЕ ОКОНЧАНИЯ РЕАКЦИИ?
Решение
Согласно положению в ряду напряжений железо вытесняет медь из раствора соли: Fe + CuSO4 →Cu↓+ FeSO4
M (CuSO4) = 160 г/моль
Количество меди, выделившейся на железной пластинке равно:
ν (Cu)= ν CuSO4=m (CuSO4) / M (CuSO4) =1,6/ 160 = 0,01моль
ν Fe= m (Fe) / А (Fe)= 5,2 /56 =0,093 моль
CuSO4 находится в недостатке по уравнению реакции ν Fe = ν Cu, следовательно в реакцию вступило 0, 01 моль Fe и образовалось 0, 01 моль Cu.
Масса пластинки после реакции равна:
m =5, 2 + m (Cu) — m (Fe)=5,2 +0,01·64 – 0,01·56 = 5,28 (г)
Ответ: масса пластинки равна 5,28 (г).
ТЕСТОВЫЙ КОНТРОЛЬ ПО ТЕМЕ d-МЕТАЛЛЫ
1.ПИРИТ ЖЕЛЕЗА (П) ИМЕЕТ ФОРМУЛУ:
Правильный ответ: 3)
2.ВЫСШУЮ СТЕПЕНЬ ОКИСЛЕНИЯ МАРГАНЕЦ ПРОЯВЛЯЕТ В:
Правильный ответ: 3)
3.РЕАКЦИЯ ГИДРОЛИЗА ПО ПЕРВОЙ СТУПЕНИ FeCI3:
4) не гидролизуется
Правильный ответ: 1)
4.СОКРАЩЕННОЕ ИОННОЕ УРАВНЕНИЕ FE 2+ + 2ОН — → FE(ОН)2 СООТВЕТСТВУЕТ ВЗАИМОДЕЙСТВИЮ:
5.ИОН CU 2+ ИМЕЕТ ЭЛЕКТРОННУЮ ФОРМУЛУ:
2) 3d 10 4S 1 4P 0
3) 3d 9 4S 0 4P 0
Правильный ответ: 3)
6.К.Ч. Fe 2+ В ГЕМОГЛОБИНЕ
Правильный ответ: 4)
7.КАКОМУ ИОНУ СООТВЕТСТВУЕТ ФОРМУЛА: 1S 2 2S 2 2P 6 3S 2 3P 6 3d 6
8.УКАЖИТЕ СУММУ КОЭФФИЦИЕНТОВ ПЕРЕД ФОРМУЛАМИ, ВСЕХ ВЕЩЕСТВ В ОВР, ПРОТЕКАЮЩЕЙ ПО РЕАКЦИИ:
9.УКАЗАТЬ СТЕПЕНЬ ОКИСЛЕНИЯ ЦИНКА В К2 [Zn(OH)4]:
Правильный ответ: 2)
10. ИОН Mn 7+ В ПРИСУТСТВИИ ОКИСЛИТЕЛЯ В КИСЛОЙ СРЕДЕ ОКРАШИВАЕТСЯ В:
4) образует осадок
Правильный ответ: 3)
Химия d-элементов
d-элементы располагаются в подгруппах периодической таблицы. Из элементов наибольшее значение имеют . Они отличаются друг от друга заполнением орбиталей и называются переходными элементами.
В вышей степени окисления входят в состав атомов кислородах кислот, в низшей – ведут себя как катионы и т.д. Катионы средней степени окисления образуют амфотерные соединения.
В водных растворах многие переходные элементы с низшей степенью окрашены, причем цветом обладают ионы, имеющие недостроенную 18-электроную оболочку . Ионы переходных элементов обладают высокой способностью и комплексообразованию. Они образуют много цветных соединений, широко используемых в качественном анализе.
Переходные элементы легко вступают в реакции окисления- восстановления, которые часто являются характерными качествами реакциями.
Значимость изучаемых элементов
Элементы имеют важное значение в медицине, так как входят в состав многих медицинских препаратов. Соединения хрома и используется при провидении анализа и синтеза лекарственных препаратов.
Соединения железа – железо восстановленное, глицерофосфатом лактат , сульфат аскорбинат, ферроцен, ферковен, феррум-лек – являются ценными средствами для лечений заболеваний крови.
Из соединений марганца как дезинфицирующее средство применяют.
Препараты, содержащие кобальт – витамин В12 (цианокобаламин), коамид,ферковен- способствуют кроветворению.
Препараты меди-сульфат и цитрат используют как вяжущие, антисептические и прижигающие средства, в малых дозах соли меди входят в состав средств, улучшающих кроветворение.
Соединение серебра- протаргол, колларгол – антисептические вяжущие средства, обладает прижигающим действием. Из соединений цинка — применяют в растворах в качестве антисептического средства, оказывает высушивающее и дезинфицирующее действие (используется в мазях).
Соединение ртути – дихлорид,оксидцианид , дииодит, амидохлорид , оксид и многохлорид ртути – активные антисептики и противовоспалительные средства.
Соединения ртути ядовиты и требуют при работе с ними осторожности.
Кадмий и никель входят в составе многих реактивов для фармацевтического анализа.
Лабораторная работа
«Химические свойства d-элементов».
Хром
Химические свойства гидроокиси хрома Cr(OH)3
Опыт 1. В пробирку налить 2-5 капель соли хрома III и добавить по каплям 2э раствора NaOH до выпадения серо-зеленого осадка Cr(OH)3. Доказать амфотерность полученного соединения, написать реакции происходящие при этом.
Опыт 2. а) Окисление трехвалентного хрома перекисью водорода
К 3-5 каплям исследуемого раствора прибавить 3-5 капель 2э раствора щелочи и 3-5 капель 3%-ного раствора перекиси . Раствор прокипятить до полного прекращения выделения пузырьков кислорода. В присутствии хрома раствор окрашивается в желтый цвет.
а) к 3-5 каплям исследуемого раствора прибавить 3-5 капель 2э раствора щелочи и 3-5 капель 3%-ного раствора перекиси водорода или кристаллик перекиси натрия. Раствор прокипятить до полного прекращения выделения пузырьков кислорода. В присутствии хрома раствор окрашиваемся в желтый цвет.
Характерные реакции ионов трехвалентного хрома
1. Едкие щелочи NaOH,KOH дают с Cr 3+ осадок серо-фиолетового или серо-зеленого цвета, обладающий амфотерными свойствами. Образующиеся, при действии щелочей на Cr(OH)3 хромиты NaCrO2 и KCrO2 окрашены в ярко-зеленый цвет. В отличие от алюминатов они необратимо разлагаются при кипячении (гидролиз) с образованием Cr(OH)3:
2. Аммиак NH4OH и соли слабых кислот (Na2CO3, (NH4)2S и др. также осаждают Сr 3+ в виде Cr(OH)3 , по-скольку полное осаждение достигает при рН=6, оно происходит так же и при действии аммонийной буферной смеси (NH4OH + NH4CI), создающей рН=8-10
3. Гидрофосфат натрия Na2HPO4 дает с Сr 3+ зеленоватый осадок CrPO4. Осадок растворим в минеральных кислотах и щелочах.
4. Окисление хрома (III) до хрома (VI) могут быть осуществленны действием различных окислителей, например H2O2,Na2O2,CI2, KMnO4, (NH4)2S2O8 и т.п. В щелочной среде образуются CrO4 2- –ионы. Окисление в кислой среде приводит к образованию Cr2O7 2- –ионов. Учитывая сказанное, рассмотрим оба случая окисления отдельно.
а) Окисление в щелочной среде. К 2-3 каплям раствора хрома (III) прибавляют 4-5 капель 2э раствора NaOH , 2-3 капли 3%-ого раствора перекиси водорода и нагревают несколько минут до тех пор, пока зеленая окраска раствора не перейдет в желтую. Перекись водорода можно заменить перекисью натрия (которая при взаимодействии с водой образует H2O2 и NaOH) или бромной (либо хлорной) водой.
При действии бромной водой реакция идет по уравнению:
б) Окисление в кислой среде может быть осуществлено действием , KMnO4, (NH4)2S2O8 и др. сильных окислителей. Рассмотрим, например, действие персульфата аммония (NH4)2S2O8 на Cr2(SO4)3
Реакция протекает по уравнению:
Аналогично персульфату действует на Cr 3+ перманганат калия:
Реакция сопровождается образованием бурого осадка марганцовистой кислоты MnO(OH)2 и идет при нагревании. То обстоятельство, что здесь образуется , а не соль марганца (II), как это бывает при реакции окисления перманганатом в кислой среде, объясняется тем, что реакцию проводят в слабокислой среде.
Железо
Реакции Fe 3+ –ионов.
Растворы солей железа III имеют желтую или красно-бурую окраску.
1. Едкие щелочи NaOH, KOH и аммиак NH4OH дают с Fe 3+ красно-бурый осадок Fe(OH)3. В отличие от AI(OH)3 и Cr(OH)3 гидроокись железа практически не обладает амфотерными свойствами и поэтому нерастворима в избытке щелочи (испытайте). Так как полное осаждение Fe(OH)3 достигается при рН = 3,5 она осаждается также при действии аммиака и смесей его с аммонийными солями.
2. Ацетат натрия CH3COONa дает с Fe 3+ на холоде растворимое в воде комплексное соединение красного цвета [Fe3(CH3COO)6O] + . При нагревании это соединение выпадает в осадок.
3. Карбонаты щелочных металлов и аммония образуют с Fe 3+ бурый осадок основных солей, которые при нагревании превращаются в гидроокись.
4. Роданид аммония или NH4SCN или KSCN дает с Fe 3+ роданиды железа, окрашивающие раствор в кроваво- красный цвет. Это одна из чувствительных и наиболее важнейших реакций Fe 3+ .
Fe 3+ + 6 SCN — →[Fe(SCN)6] 3-
5. Гексацианоферрат (II) калия K[Fe(CN)6] или «желтая кровяная соль» образует с Fe 3+ темно синий осадок «берлинской лазури».
Этой реакции благоприятствует умеренное подкисление раствора, при сильном подкислении осадок растворится. Щелочи разлагают «берлинскую лазурь» с выделением Fe(OH)3. Проверьте это, запишите уравнение реакции.
6. Гидрофосфат натрия Na2HPO4 образует с Fe 3+ бледно-желтый осадок FePO4,
растворимый в сильных кислотах, но нерастворимый в уксусной кислоте (испытайте).
Реакции Fe 2+ – ионов
Растворы солей железа (II) окрашены в бледно-зеленый цвет. Разбавленные растворы бесцветны.
1. Едкие щелочи NaOH, KOH и осаждают Fe 2+ в виде Fe(OH)2↓:
Без доступа воздуха выпадает осадок белого цвета. В обычных условиях в результате частичного окисления он имеет грязно-зеленую окраску. Конечный продукт окисления Fe(OH)3. Осадки Fe(OH)2 и Fe(OH)3 растворяются в щелочах. Убедитесь в этом.
2. Аммиак NH4OH также осаждает Fe(OH)2 , но осаждение это не полное. В присутствии солей аммиака Fe(OH)2 совсем не осаждается. Причина заключается в сравнительно большой величине произведения растворимости Fe(OH)2 (ПР =1·10 -15 ), которое не достигается при концентрации OH — , создаваемой аммонийной буферной смесью.
3. Карбонаты щелочных металлов и аммония дают с Fe 2+ белый осадок FeCO3 быстро буреющий на воздухе вследствие окисления с образованием Fe(OH)3 .
4. Гексацианоферрат (III) калия K3[Fe(CN)6 — «красная кровяная соль» образует с Fe 2+ синий осадок «турнбулевой сини». Осадок нерастворим в кислотах, но разлагается в щелочах. Эта реакция наиболее характерна для Fe 2+ . Запишите уравнение реакции:
К 2-3 каплям исследуемого раствора добавить 2-3 капли 2э раствора HCI и 2-3 капли раствора K3[Fe(CN)6] .
5. Окисление Fe 2+ до Fe 3+ . Ион Fe 2+ представляет собой довольно сильный восстановитель и способен окисляться при действии ряда окислителей, например H2O2, KMnO4, K2Cr2O7 в кислой среде. Остановимся подробнее на окислении азотной кислотой. Реакция идет по уравнению: 3Fe 2+ + 4H + + NO3 — →3Fe 3+ + 2H2O + NO↑
Для выполнения реакции берут 2-3капли раствора соли железа (II), прибавляют 2 капли 2э раствора H2SO4 и 1-2 капли 6э раствора HNO3. Нагревают до исчезновения бурой окраски, зависящей от образования нестойкого комплексного соединения [Fe(NO)]SO4, которое при нагревании разлагается.
Та же реакция происходит при растворении в азотной кислоте сульфида железа II:
FeS↓ + 4H + + NO3 — → Fe 3+ + S↓ +2H2O + NO↑
Окисление Fe 2+ в щелочной среде может быть осуществлено, например, действием H2O2:
Реакции –Mn 2+ ионов.
Растворы солей марганца имеют бледно-розовый цвет. Разбавленные растворы бесцветны.
1. Едкие щелочи NaOH,KOH образуют с Mn 2+ белый осадок Mn(OH)2, растворимый в кислотах, но не растворимый в щелочах:
Осадок быстро буреет на воздухе вследствие окисления Mn2+ до марганца (IV) т.е. вследствие образования марганцоватистой кислоты MnO(OH)2 (или H2MnO3). Если, кроме щелочи, подействовать на соль марганца (II) окислителем (перекисью водорода или бромной водой), то MnO(OH)2 образуется сразу, выпадая в виде темно- бурого осадка
Получите Mn(OH)2 по обменной реакции. Отметьте его цвет. Осадок вместе с раствором разлейте в четыре пробирки. Первую оставьте стоять на воздухе, в три другие прилейте: в первую -2э раствор соляной кислоты, во вторую – 2э раствор щелочи, в третью – 5-8 капель бромной воды: что наблюдается в каждом случае? В какой из пробирок осадок растворяется? Какие свойства проявляет гидроксид марганца (II)? Напишите уравнение реакции (в молекулярном и ионном виде).
2. Гидролиз солей марганца (II). Запишите уравнение реакции гидролиза солей марганца (II). Исследуйте реакцию среди растворов солей марганца (II).
3. Окисление Mn 2+ до MnO4 — . Соединение марганца (II), соответствующие низшей степени окисления, являются восстановителями:
🌟 Видео
Качественная реакция на ионы меди (II) №3Скачать

Качественная реакция на ионы меди (II) №1Скачать

Качественная реакция на ионы меди (II)Скачать

Качественная реакция на ион двухвалентной медиСкачать

Опыты по химии. Качественные реакции на нитрат-ион: взаимодействие нитрата с медью и серной кислотойСкачать

Катион меди(II) Cu2+. Качественная реакцияСкачать

Качественная реакция на альдегиды с гидроксидом медиСкачать

Химия 11 класс. Радуга осадков. Качественные реакции на ионы металловСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Качественные реакции на хлорид-, бромид- и йодид-ионыСкачать

Горения СУЛЬФАТА МЕДИ. Качественная реакция на ион меди. Опыты по химии.Скачать

Качественные реакции на ион аммонияСкачать

Качественные реакции на катионы. 9 класс.Скачать

качественная реакция на ионы бария с сульфатом меди 2Скачать

Опыты по химии. Качественные реакции на ионы железа (II) и (III)Скачать

Качественные реакции на катион меди 2+Скачать