- Положение в периодической системе химических элементов
- Электронное строение цинка и свойства
- Физические свойства
- Нахождение в природе
- Способы получения
- Качественные реакции
- Химические свойства
- Оксид цинка
- Способы получения
- Химические свойства
- Гидроксид цинка
- Способы получения
- Химические свойства
- Соли цинка
- Нитрат и сульфат цинка
- Комплексные соли цинка
- Гидролиз солей цинка
- Цинкаты
- Сульфид цинка
- Упражнения типа «мысленный эксперимент» по химии цинка (тренажер задания 32 ЕГЭ по химии)
- РЕАКЦИИ ОБНАРУЖЕНИЯ КАТИОНОВ IV АНАЛИТИЧЕСКОЙ ГРУППЫ В РАСТВОРЕ
- Химия, Биология, подготовка к ГИА и ЕГЭ
- Уравнения качественных реакций неорганической химии.
- 💥 Видео
Положение в периодической системе химических элементов
Цинк расположены в побочной подгруппе II группы (или в 12 группе в современной форме ПСХЭ) и в четвертом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение цинка и свойства
Электронная конфигурация цинка в основном состоянии :
+30Zn 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2
2s 
3s 

Характерная степень окисления цинка в соединениях +2.
Физические свойства
Цинк при нормальных условиях — хрупкий переходный металл голубовато-белого цвета (быстро тускнеет на воздухе, покрываясь тонким слоем оксида цинка).
Температура плавления цинка 420°С, температура кипения 906°С, плотность 7,13 г/см 3 .
Нахождение в природе
Среднее содержание цинка в земной коре 8,3·10 -3 мас.%. Основной минерал цинка: сфалерит (цинковая обманка) ZnS..
Цинк играет важную роль в процессах, протекающих в живых организмах.
В природе цинк как самородный металл не встречается.
Способы получения
Цинк получают из сульфидной руды. На первом этапе руду обогащают, повышая концентрацию сульфидов металлов. Сульфид цинка обжигают в печи кипящего слоя:
2ZnS + 3O2 → 2ZnO + 2SO2
Чистый цинк из оксида получают двумя способами.
При пирометаллургическом способе , который использовался издавна, оксид цинка восстанавливают углём или коксом при 1200—1300 °C:
ZnO + С → Zn + CO
Далее цинк очищают от примесей.
В настоящее время основной способ получения цинка — электролитический (гидрометаллургический) . При этом сульфид цинка обрабатывают серной кислотой:
При это получаемый раствор сульфата цинка очищают от примесей (осаждением их цинковой пылью) и подвергают электролизу.
При электролизе чистый цинк осаждается на алюминиевых катодах, с которых его удаляют и подвергают плавлению в индукционных печах. Таким образом можно получить цинк с высокой чистотой (до 99,95 %).
Качественные реакции
Качественная реакция на ионы цинка — взаимодействие избытка солей цинка с щелочами . При этом образуется белый осадок гидроксида цинка.
Например , хлорид цинка взаимодействует с гидроксидом натрия:
ZnCl2 + 2NaOH → Zn(OH)2 + 2NaCl
При дальнейшем добавлении щелочи амфотерный гидроксид цинка растворяется с образованием комплексной соли тетрагидроксоцинката:
Обратите внимание , если мы поместим соль цинка в избыток раствора щелочи, то белый осадок гидроксида цинка не образуется, т.к. в избытке щелочи соединения цинка сразу переходят в комплекс:
Химические свойства
1. Цинк – сильный восстановитель . Цинк – довольно активный металл, но на воздухе он устойчив, так как покрывается тонким слоем оксида, предохраняющим его от дальнейшего окисления. При нагревании цинк реагирует со многими неметаллами .
1.1. Цинк реагируют с галогенами с образованием галогенидов:
Реакция цинка с иодом при добавлении воды:
1.2. Цинк реагирует с серой с образованием сульфидов:
Zn + S → ZnS
1.3. Цинк реагируют с фосфором . При этом образуется бинарное соединение — фосфид:
1.4. С азотом цинк непосредственно не реагирует.
1.5. Цинк непосредственно не реагирует с водородом, углеродом, кремнием и бором.
1.6. Цинк взаимодействует с кислородом с образованием оксида:
2Zn + O2 → 2ZnO
2. Цинк взаимодействует со сложными веществами:
2.1. Цинк реагирует с парами воды при температуре красного каления с образованием оксида цинка и водорода:
Zn 0 + H2 + O → Zn +2 O + H2 0
2.2. Цинк взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой и др.). При этом образуются соль и водород.
Например , цинк реагирует с соляной кислотой :
Zn + 2HCl → ZnCl2 + H2↑
Демонстрация количества выделения водорода при реакции цинка с кислотой:
Цинк реагирует с разбавленной серной кислотой:
2.3. Цинк реагирует с концентрированной серной кислотой . В зависимости от условий возможно образование различных продуктов. При нагревании гранулированного цинка с концентрированной серной кислотой образуются оксид серы (IV), сульфат цинка и вода:
Порошковый цинк реагирует с концентрированной серной кислотой с образованием сероводорода, сульфата цинка и воды:
2.4. Аналогично: при нагревании гранулированного цинка с концентрированной азотной кислотой образуются оксид азота (IV) , нитрат цинка и вода :
При нагревании цинка с очень разбавленной азотной кислотой образуются нитрат аммония , нитрат цинка и вода :
2.5. Цинк – амфотерный металл, он взаимодействует с щелочами. При взаимодействии цинка с раствором щелочи образуется тетрагидроксоцинкат и водород:
Zn + 2KOH + 2H2O = K2[Zn(OH)4] + H2
Цинк реагирует с расплавом щелочи с образованием цинката и водорода:
В отличие от алюминия, цинк растворяется и в водном растворе аммиака:
2.6. Цинк вытесняет менее активные металлы из оксидов и солей .
Например , цинк вытесняет медь из оксида меди (II):
Zn + CuO → Cu + ZnO
Еще пример : цинк восстанавливает медь из раствора сульфата меди (II):
CuSO4 + Zn = ZnSO4 + Cu
И свинец из раствора нитрата свинца (II):
Восстановительные свойства цинка также проявляются при взаимодействии его с сильными окислителями: нитратами и сульфитами в щелочной среде, перманганатами, соединениями хрома (VI):
Оксид цинка
Способы получения
Оксид цинка можно получить различными методами :
1. Окислением цинка кислородом:
2Zn + O2 → 2ZnO
2. Разложением гидроксида цинка при нагревании:
3. Оксид цинка можно получить разложением нитрата цинка :
Химические свойства
Оксид цинка — типичный амфотерный оксид . Взаимодействует с кислотными и основными оксидами, кислотами, щелочами.
1. При взаимодействии оксида цинка с основными оксидами образуются соли-цинкаты.
Например , оксид цинка взаимодействует с оксидом натрия:
2. Оксид цинка взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—цинкаты, а в растворе – комплексные соли . При этом оксид цинка проявляет кислотные свойства.
Например , оксид цинка взаимодействует с гидроксидом натрия в расплаве с образованием цинката натрия и воды:
Оксид цинка растворяется в избытке раствора щелочи с образованием тетрагидроксоцинката:
3. Оксид цинка не взаимодействует с водой.
ZnO + H2O ≠
4. Оксид цинка взаимодействует с кислотными оксидами . При этом образуются соли цинка. В этих реакциях оксид цинка проявляет основные свойства.
Например , оксид цинка взаимодействует с оксидом серы (VI) с образованием сульфата цинка:
5. Оксид цинка взаимодействует с растворимыми кислотами с образованием солей.
Например , оксид цинка реагирует с соляной кислотой:
ZnO + 2HCl = ZnCl2 + H2O
6. Оксид цинка проявляет слабые окислительные свойства .
Например , оксид цинка при нагревании реагирует с водородом и угарным газом:
ZnO + С(кокс) → Zn + СО
ZnO + СО → Zn + СО2
7. Оксид цинка — твердый, нелетучий. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Например , из карбоната бария:
Гидроксид цинка
Способы получения
1. Гидроксид цинка можно получить пропусканием углекислого газа, сернистого газа или сероводорода через раствор тетрагидроксоцинката натрия:
Чтобы понять, как протекает эта реакция, можно использовать несложный прием: мысленно разбить исходное вещество Na2[Zn(OH)4] на составные части: NaOH и Zn(OH)2. Далее мы определяем, как реагирует углекислый газ с каждым из этих веществ, и записываем продукты их взаимодействия. Т.к. Zn(OH)2 не реагирует с СО2, то мы записываем справа Zn(OH)2 без изменения.
2. Гидроксид цинка можно получить действием недостатка щелочи на избыток соли цинка.
Например , хлорид цинка реагирует с недостатком гидроксида калия с образованием гидроксида цинка и хлорида калия:
Химические свойства
1. Гидроксид цинка реагирует с растворимыми кислотами .
Например , гидроксид цинка взаимодействует с азотной кислотой с образованием нитрата цинка:
2. Гидроксид цинка взаимодействует с кислотными оксидами .
Например , гидроксид цинка взаимодействует с оксидом серы (VI) с образованием сульфата цинка:
3. Гидроксид цинка взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—цинкаты, а в растворе – комплексные соли . При этом гидроксид цинка проявляет кислотные свойства.
Например , гидроксид цинка взаимодействует с гидроксидом калия в расплаве с образованием цинката калия и воды:
Гидроксид цинка растворяется в избытке щелочи с образованием тетрагидроксоцинката:
4. Г идроксид цинка разлагается при нагревании :
Соли цинка
Нитрат и сульфат цинка
Нитрат цинка при нагревании разлагается на оксид цинка, оксид азота (IV) и кислород:
Сульфат цинка при сильном нагревании разлагается аналогично — на оксид цинка, сернистый газ и кислород:
Комплексные соли цинка
Для описания свойств комплексных солей цинка — гидроксоцинкатов, удобно использоваться следующий прием: мысленно разбейте тетрагидроксоцинкат на две отдельные частицы — гидроксид цинка и гидроксид щелочного металла.
Например , тетрагидроксоцинкат натрия разбиваем на гидроксид цинка и гидроксид натрия:
Na2[Zn(OH)4] разбиваем на NaOH и Zn(OH)2
Свойства всего комплекса можно определять, как свойства этих отдельных соединений.
Таким образом, гидроксокомплексы цинка реагируют с кислотными оксидами .
Например , гидроксокомплекс разрушается под действием избытка углекислого газа. При этом с СО2 реагирует NaOH с образованием кислой соли (при избытке СО2), а амфотерный гидроксид цинка не реагирует с углекислым газом, следовательно, просто выпадает в осадок:
Аналогично тетрагидроксоцинкат калия реагирует с углекислым газом:
А вот под действием избытка сильной кислоты осадок не выпадает, т.к. амфотерный гидроксид цинка реагирует с сильными кислотами.
Например , с соляной кислотой:
Правда, под действием небольшого количества ( недостатка ) сильной кислоты осадок все-таки выпадет, для растворения гидроксида цинка кислоты не будет хватать:
Аналогично с недостатком азотной кислоты выпадает гидроксид цинка:
Если выпарить воду из раствора комплексной соли и нагреть образующееся вещество, то останется обычная соль-цинкат:
Гидролиз солей цинка
Растворимые соли цинка и сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть:
I ступень: Zn 2+ + H2O = ZnOH + + H +
II ступень: ZnOH + + H2O = Zn(OH )2 + H +
Более подробно про гидролиз можно прочитать в соответствующей статье.
Цинкаты
Соли, в которых цинк образует кислотный остаток (цинкаты) — образуются из оксида цинка при сплавлении с щелочами и основными оксидами:
Для понимания свойств цинкатов их также можно мысленно разбить на два отдельных вещества.
Например, цинкат натрия мы разделим мысленно на два вещества: оксид цинка и оксид натрия.
Na2ZnO2 разбиваем на Na2O и ZnO
Тогда нам станет очевидно, что цинкаты реагируют с кислотами с образованием солей цинка :
Под действием избытка воды цинкаты переходят в комплексные соли:
Сульфид цинка
Сульфид цинка — так называемый «белый сульфид». В воде сульфид цинка нерастворим, зато минеральные кислоты вытесняют из сульфида цинка сероводород (например, соляная кислота):
ZnS + 2HCl → ZnCl2 + H2S
Под действием азотной кислоты сульфид цинка окисляется до сульфата:
(в продуктах также можно записать нитрат цинка и серную кислоту).
Концентрированная серная кислота также окисляет сульфид цинка:
При окислении сульфида цинка сильными окислителями в щелочной среде образуется комплексная соль:
Z nS + 4NaOH + Br2 = Na2[Zn(OH)4] + S + 2NaBr
Упражнения типа «мысленный эксперимент» по химии цинка (тренажер задания 32 ЕГЭ по химии)
- Оксид цинка растворили в растворе хлороводородной кислоты и раствор нейтрализовали, добавляя едкий натр. Выделившееся студенистое вещество белого цвета отделили и обработали избытком раствора щелочи, при этом осадок полностью растворился. нейтрализация полученного раствора кислотой, например, азотной, приводит к повторному образованию студенистого осадка. Напишите уравнения описанных реакций.
- Цинк растворили в очень разбавленной азотной кислоте и в полученный раствор добавили избыток щелочи, получив прозрачный раствор. Напишите уравнения описанных реакций.
- Соль, полученную при взаимодействии оксида цинка с серной кислотой, прокалили при температуре 800°С. Твердый продукт реакции обработали концентрированным раствором щелочи, и через полученный раствор пропустили углекислый газ. Напишите уравнения описанных реакций.
- Нитрат цинка прокалили, продукт реакции при нагревании обработали раствором едкого натра. Через образовавшийся раствор пропустили углекислый газ до прекращения выделения осадка, после чего обработали избытком концентрированного нашатырного спирта, при этом осадок растворился. Напишите уравнения описанных реакций.
- Цинк растворили в очень разбавленной азотной кислоте, полученный раствор осторожно выпарили и остаток прокалили. Продукты реакции смешали с коксом и нагрели. Напишите уравнения описанных реакций.
- Несколько гранул цинка растворили при нагревании в растворе едкого натра. В полученный раствор небольшими порциями добавляли азотную кислоту до образования осадка. Осадок отделили, растворили в разбавленной азотной кислоте, раствор осторожно выпарили и остаток прокалили. Напишите уравнения описанных реакций.
- В концентрированную серную кислоту добавили металлический цинк. образовавшуюся соль выделили, растворили в воде и в раствор добавили нитрат бария. После отделения осадка в раствор внесли магниевую стружку, раствор профильтровали, фильтрат выпарили и прокалили. Напишите уравнения описанных реакций.
- Сульфид цинка подвергли обжигу. Полученное твердое вещество полностью прореагировало с раствором гидроксида калия. Через полученный раствор пропустили углекислый газ до выпадения осадка. Осадок растворили в соляной кислоте. Напишите уравнения описанных реакций.
- Некоторое количество сульфида цинка разделили на две части. Одну из них обработали соляной кислотой, а другую подвергли обжигу на воздухе. При взаимодействии выделившихся газов образовалось простое вещество. Это вещество нагрели с концентрированной азотной кислотой, причем выделился бурый газ. Напишите уравнения описанных реакций.
- Цинк растворили в растворе гидроксида калия. Выделившийся газ прореагировал с литием, а к полученному раствору по каплям добавили соляную кислоту до прекращения выпадения осадка. Его отфильтровали и прокалили. Напишите уравнения описанных реакций.
Видео:получение хлорида цинка /Скачать

РЕАКЦИИ ОБНАРУЖЕНИЯ КАТИОНОВ IV АНАЛИТИЧЕСКОЙ ГРУППЫ В РАСТВОРЕ
Цель работы: качественные реакции обнаружения различных ионов с целью их последующей идентификации из смеси.
Приборы и реактивы: штатив с пробирками, стеклянная палочка с впаянной платиновой проволокой, спиртовка, соли цинка и алюминия.
О п ы т 1. Обнаружение Zn 2+ -ионов
1. Реакция с сероводородом или растворимым сульфидом. Сероводород или растворимый сульфид с ионами Zn 2+ образует белый осадок сульфида цинка ZnS:
Сульфид цинка растворяется в минеральных кислотах. Из приведенного уравнения видно, что при реакции образуется соляная кислота, поэтому сероводород не может полностью осадить цинк. Осаждение иона Zn 2+ будет практически полным, если к раствору соли цинка добавить ацетат натрия, а затем пропустить сероводород. В присутствии ацетата натрия вместо сильной кислоты НСl образуется слабая уксусная кислота.
Выполнение реакции. К исследуемому раствору объемом 1 cм 3 добавляют раствор ацетата натрия объемом 1 cм 3 и сероводородной воды объемом 1 cм 3 . Наблюдают выделение белого осадка сульфида цинка.
2. Реакция со щелочами. Едкие щелочи с катионом Zn 2+ образуют белый осадок гидроксида цинка Zn(OH)2, который обладает амфотерными свойствами и поэтому растворяется в кислотах и щелочах.
Тетрагидроксоцинкат натрия Na2[Zn(OH)4] при нагревании разлагается:
Цинкаты, в отличие от алюминатов, при действии NH4Cl осадка не образуют, так Zn(OH)2 растворяется в солях аммония.
Выполнение реакции. Поместите в пробирку 1–2 cм 3 раствора соли цинка и прилейте несколько капель 2 н раствора щелочи. При этом выпадает белый творожистый осадок. Проверить поведение осадка под действием кислот и щелочей.
3. Реакция с аммиаком. Аммиак образует с катионом Zn 2+ осадок гидроксида, который растворяется в избытке аммиака и в солях аммония с образованием комплексного соединения [Zn(NH3)6](ОН)2:
Выполнение реакции. Поместите в пробирку 1–2 cм 3 раствора соли цинка и прилейте несколько капель раствора аммиака. При этом выпадает осадок. Проверить поведение осадка под действием аммиака или солей аммония.
4. Реакция с карбонатами щелочных металлов. Карбонаты щелочных металлов и аммония образуют с катионом Zn 2+ белый осадок основной соли переменного состава:
Состав основной соли зависит от концентрации раствора и от температуры.
Выполнение реакции. Поместите в пробирку 1–2 cм 3 раствора соли цинка и прилейте несколько капель раствора карбоната натрия, калия или аммония. При этом выпадает белый осадок.
5. Реакция с желтой кровяной солью. Гексациано-II-Ферат калия K4[Fe(CN)6] образует с катионом Zn 2+ белый осадок ферроцианида цинка и калия этот осадок нерастворим в кислотах, а растворяется в щелочах с образованием цинката:
Эта реакция дает возможность отделить катионы цинка от катионов алюминия.
Выполнение реакции. Поместите в пробирку 1–2 cм 3 раствора соли цинка и прилейте несколько капель желтой кровяной соли. При этом выпадает белый осадок. Проверить поведение осадка под действием кислот и щелочей.
О п ы т 2. Обнаружение Аl 3+ -ионов
1. Реакция со щелочами. Едкие щелочи с ионами А1 3+ образуют белый осадок гидроксида алюминия, который обладает амфотерными свойствами и растворяется в избытке щелочи и кислотах:
При растворении гидроксида алюминия в щелочах образуется комплексное соединение, которое может иметь переменный состав [NaAl(OH)4] или Na3[Al(OH)6]
Комплексный ион [Al(OH)4] — ‑ это ион АlO2 — , гидратированный двумя молекулами воды.
Алюминаты как соли слабых кислот гидролизуются:
Для предупреждения реакции гидролиза, в растворе должна быть большая концентрация гидроксид-ионов, и наоборот, чтобы гидролиз довести до конца, надо связать ионы ОН — , это достигается добавлением твердой соли NH4C1. Когда к алюминату добавляют хлорид аммония, равновесие реакции гидролиза нарушается и выпадает осадок:
Реакция гидролиза алюмината характерна для обнаружения ионов алюминия.
Выполнение реакции. К исследуемому раствору объемом 0,5 мл добавляют по каплям раствор едкого натра до тех пор, пока осадок А1(ОН)3, образовавшегося не растворится. К прозрачному раствору добавляют небольшими порциями твердый хлорид аммония, смесь кипятят. В присутствии А1 3+ выпадает белый осадок гидроксида алюминия.
2. Реакция с аммиаком. Аммиак осаждает из растворов солей алюминия белый осадок Al(OH)3, который немного растворяется в избытке NH4OH.
Выполнение реакции. Поместите в пробирку 1–2 cм 3 раствора соли алюминия и прилейте несколько капель раствора аммиака. При этом выпадает осадок. Проверить поведение осадка под действием аммиака.
3. Реакция с ализарином. Ализарин с ионами А1 3+ образует комплексное соединение АlOН[С14О3Н6(ОН)]2 красного цвета, не растворяется в уксусной кислоте. Это соединение называется «алюминиевым лаком». Ализарин мало растворим в воде, поэтому на практике используют ализариновый красный S-натриевую соль 1,2-диоксиантрахинон-3-сульфокислоты.
Ионы Fe 3+ , Cu 2+ , Вi 3+ т.д. мешают реакции А1 3+ с ализарином, они образуют окрашенные осадки.
Реакцию обнаружения А1 3+ ализарином лучше проводить в слабокислом растворе (рН = 4,2-4,6) ‑ в этих условиях ализарин имеет желтый цвет. В щелочной среде фиолетовый цвет самого ализарина маскирует красный цвет алюминиевого комплекса и влияет на результаты анализа.
Выполнение реакции. К исследуемому раствору объемом 0,5 см 3 добавляют 2 н раствор едкого натра до сильнощелочной реакции. Если выпадает осадок (присутствуют ионы Fe 3+ , Сu 2+ > Вi 3+ ), его отделяют и к прозрачному раствору каплями добавляют 0,2-процентный раствор ализарина объемом 0,5 см 3 , сначала появляется фиолетовое окрашивание, затем добавляют каплями 2 н раствор уксусной кислоты до тех пор, пока не исчезнет фиолетовая окраска. В присутствии алюминия (в зависимости от концентрации) раствор окрашивается в красный цвет или выпадает красный осадок.
Реакцию обнаружения катионов А1 3+ ализарином можно выполнить капельным методом. На полоску фильтровальной бумаги наносят каплю раствора гексациано-II-ферраты калия K4[Fe(CN)6] и в центр образованной пятна добавляют каплю исследуемого раствора. Если в исследуемом растворе присутствуют ионы Cr 3+ , Zn 2+ , Fe 3+ , Mn 2+ , Co 2+ , Ni 2+ и т.д., все они осаждаются в виде ферроцианидов и остаются в центре пятна, а ионы А1 3+ по капиллярам перемещаются дальше. Фильтровальная бумага с пятном держат над пробиркой с аммиаком и внешнюю зону пятна смачивают ализарином. Бумага высушивают, а внешнюю зону пятна смачивают 1 н раствором уксусной кислоты. В присутствии Аl 3+ появляется розовое кольцо.
4. Реакция сухим способом. Соединения алюминия при прокаливании разлагаются, образуя при этом оксид алюминия, который с солями кобальта при прокаливании образует алюминат кобальта Со(АlО2)2 синего цвета («тенарову синь»):
Ионы Zn 2+ мешают этой реакции, так с солями кобальта при прокаливании образуют зеленое соединение.
Выполнение реакции. Полоску фильтровальной бумаги смачивают исследуемым раствором, а затем 2-3 каплями раствора нитрата кобальта. В присутствии алюминия зона бумаги, смоченной исследуемым раствором, окрашивается в синий цвет.
О п ы т 3. Обнаружение Zn 2+ — и Аl 3+ -ионов
К четвертой группе относятся катионы Zn 2+ , Al 3+ , Sn 2+ , Sn (IV), As (III), As (V), которые образуют амфотерные гидроксиды (за исключением мышьяка). Групповым реактивом на эти катионы есть избыток едкой щелочи.
Амфотерные гидроксиды, образованные катионами четвертой группы, способные диссоциировать в растворе как основания и как кислоты:
Кислоты уменьшают диссоциацию амфотерных гидроксидов как кислот, а щелочи ‑ как оснований:
Алюминаты и хромиты устойчивые только в присутствии избытка щелочи.
Большинство солей катионов четвертой группы гидролизуются:
Для всех катионов четвертой группы (за исключением мышьяка) характерна реакция с едкими щелочами, при этом образуются гидроксиды, растворимые в избытке реактива.
Выполнение реакции. В две пробирки наливают растворы хлорида алюминия и хлорида цинка объемами по 0,5 см 3 . В каждую из пробирок добавляют раствор гидроксида натрия объемами по 0,5 см 3 , перемешивают и наблюдают образование осадков, обращают внимание на цвет осадков. Затем в каждую пробирку вливают еще щелочь объемами по 1 см 3 , содержимое пробирок перемешивают и проверяют растворимость осадков в избытке реактива.
Растворимые карбонаты (Na2CO3, К2СО3) осаждают катион А1 3+ в виде гидроксида, катион Zn 2+ ‑ в виде основной соли.
Результаты опытов оформить в виде таблицы:
Видео:Качественная реакция ионов цинка со щелочью. Получение и свойства гидроксида цинкаСкачать

Химия, Биология, подготовка к ГИА и ЕГЭ
Материал для задания 37 ЕГЭ (по-старому С2 ЕГЭ), для олимпиад, да и вообще для тех, кому нужны нормальные знания по химии
Автор статьи — Саид Лутфуллин
В статье приведены многие реакции, которые встречаются в ЕГЭ. Формулировки описания реакций тоже как в ЕГЭ, поэтому не удивляйтесь если встретите что-то вроде «…осадок растворяется в кислотах…», конечно же, он не растворяется, он реагирует с кислотой. Растворение – это немного другой процесс, но господа составители из ФИПИ со мной не согласны и упорно применяют в таких случаях именно этот термин.
Видео:Качественные реакции на хлорид-, бромид- и йодид-ионыСкачать

Уравнения качественных реакций неорганической химии.
(кликните на название категории, чтобы перейти в соответствующий раздел)
I. Элементы IA-группы (щелочные металлы)
– легкие металлы, настолько пластичные, что их можно разрезать ножом. Из-за чрезвычайной активности, на воздухе легко окисляются (некоторые со взрывом), поэтому их хранят в керосине, кроме лития. Литий хранить в керосине невозможно из-за физических свойств. Этот металл легче керосина, поэтому всплывает в нем. Литий хранят в вазелине или еще в чем-нибудь таком инертном и вязком.
Почти все соли щелочных металлов растворимы в воде.
Поэтому обнаружение их катионов выпадением осадка невозможно. Для определения катионов металлов используют метод пирохимического анализа.
Этот метод основан на способности ионов металлов, входящих в состав летучих солей, окрашивать пламя горелки в определенный цвет.
1) Li +
Окрашивает пламя горелки в карминово-красный цвет
Помимо этого, литий – один единственный щелочной металл, катион которого можно обнаружить с помощью осадка. Катион лития с фосфат-ионом дает белый осадок:
Сокращенное ионное уравнение:
3Li + + PO4 3- → Li3PO4↓
2) Na +
Окрашивает пламя горелки в желтый цвет.
3) K +
Окрашивает пламя горелки в фиолетовый цвет.
4) Rb +
Окрашивает пламя горелки в розово-фиолетовый цвет.
5) Cs +
Окрашивает пламя горелки в голубовато-фиолетовый цвет.
II. Щелочноземельные металлы (подгруппа кальция)
– металлы серого цвета. Твердые, ножом не режутся. На воздухе ведут себя спокойно: покрываются оксидной пленкой.
Определить катионы щелочноземельных металлов можно как с помощью выпадения осадка, так и с помощью пирохимического метода:
1. Ca 2+
Образует белый осадок с карбонат-ионом : CaCl 2 + K 2 CO 3 → CaCO 3 ↓ + 2 KCl
Сокращенное ионное уравнение: Ca 2+ + CO 3 2- → CaCO 3 ↓
Образуется карбонат кальция – мел. Так же карбонат кальция – составная часть накипи. Иногда можно встретить формулировку: «…белый осадок, растворимый в кислотах с выделением газа (без цвета, вкуса, запаха)…». Имеется в виду реакция карбонатов с кислотами:
Катион кальция окрашивает пламя горелки в оранжево-красный цвет .
2. Sr 2+
Образует белый нерастворимый в кислотах осадок с сульфат-ионом : SrCl 2 + K 2 SO 4 → SrSO 4 ↓ + 2 KCl
Сокращенное ионное уравнение: Sr 2+ + SO 4 2- → SrSO 4 ↓
Окрашивает пламя горелки в темно-красный цвет .
3. Ba 2+
Образует белый нерастворимый в кислотах осадок с сульфат-ионом : BaCl 2 + K 2 SO 4 → BaSO 4 ↓ + 2 KCl
Сокращенное ионное уравнение: Ba 2+ + SO 4 2- → BaSO 4 ↓
Катионы бария окрашивают пламя горелки в зеленый цвет
4. Mg 2+
Определяется, как и кальций, карбонат-ионами .
Карбонат магния – белый осадок: Mg ( NO 3 ) 2 + K 2 CO 3 → MgCO 3 ↓ + 2 KNO 3
Сокращенное ионное уравнение: Mg 2+ + CO 3 2- → MgCO 3 ↓
III. Be 0 (Be 2+ ), Zn 0 (Zn 2+ ), Al 0 (Al 3+ )
эти три металла объединяют амфотерные свойства. Поэтому если в задании встречается следующая формулировка: «…металл, растворимый в раствор е щелочи…», «…металл, который растворяется и в щелочах, и кислотах…» или «…металл, растворяющийся в щелочи с выделением горючего газа, легче воздуха…» , то имеют в виду один из этих трех металлов.
Ионы этих металлов в растворах тоже определяют добавлением щелочи.
Выпадает белый студенистый осадок (гидроксид металла), который в избытке щелочи растворяется (гидроксиды алюминия, цинка и бериллия реагируют со щелочами, образуя растворимые гидроксоалюминаты, гидроксоцинкаты и гидроксобериллаты соответственно):
BeCl 2 + 2 KOH → Be ( OH ) 2 ↓ + 2 KCl
(образование осадка) сокращенное ионное уравнение:
Be 2+ + 2 OH — → Be ( OH ) 2 ↓ Be ( OH ) 2 + 2 KOH → K 2 [ Be ( OH ) 4 ] (растворение осадка)
ZnCl 2 + 2 KOH → Zn ( OH ) 2 ↓ + 2 KCl (образование осадка)
сокращенное ионное уравнение: Zn 2+ + 2 OH — → Zn ( OH ) 2 ↓
Zn ( OH ) 2 + 2 KOH → K 2 [ Zn ( OH ) 4 ] (растворение осадка)
AlCl 3 + 3 KOH → Al ( OH ) 3 ↓ + 3 KOH (образование осадка)
сокращенное ионное уравнение:
Al 3+ + 3 OH — → Al ( OH ) 3 ↓
Al ( OH ) 3 + KOH → K [ Al ( OH ) 4 ] (растворение осадка)
Оксиды этих металлов, как и гидроксиды, растворяются в кислотах и щелочах, рассмотрим на примере оксида алюминия:
У гидроксида цинка есть характерная особенность: он растворяется в NH 3 (водн.)
Ион Zn 2+ с S 2+ образует белый осадок . Который растворяется в кислотах с выделением газа с запахом тухлых яиц – сероводорода (про него подробнее ниже, в разделе сера):
ZnSO 4 + K 2 S → ZnS ↓ + K 2 SO 4 (образование осадка)
Сокращенное ионное уравнение:
ZnS + H 2 SO 4 → ZnSO 4 + H 2 S ↑ (растворение осадка с выделением сероводорода)
Медь – пластичный розовато-красный металл.
Хороший проводник электрического тока.
Не вытесняет из кислот водород.
Реагирует только с кислотами-окислителями (азотной и концентрированной серной):
Оксид меди – CuO – черный – основный.
Растворяется в кислотах, окрашивая раствор в голубой цвет: CuO + 2HCl → CuCl 2 + H 2 O
Cu 2+
Летучие соли меди окрашивают пламя горелки в зеленый цвет. Соединения меди имеют голубоватую окраску , это можно использовать как диагностический признак.
В растворе ионы меди можно обнаружить добавлением щелочи выпадает растворимый в кислотах, голубой осадок, который используется в нескольких качественных реакциях органической химии.
Сокращенное ионное уравнение:
Осадок Cu ( OH ) 2 растворяется в избытке NH 3 (водн.) образуя интенсивно синий раствор:
Если нагреть осадок Cu ( OH ) 2 , то он почернеет. Потому что гидроксид меди( II ) – нерастворимое основание и разлагается:
Голубой – это фирменный цвет соединений меди, и если в задании ЕГЭ написано про этот цвет, то 90% вероятности, что говорят про соединение меди.
Серебро – мягкий благородный металл. Цвет серебристый.
Оксид серебра Ag 2 O- черный – основный.
Ag +
Катион серебра с хлорид-ионом дает белый творожистый осадок : AgNO 3 + KCl → AgCl ↓ + KNO 3
сокращенное ионное уравнение: Ag + + Cl — → AgCl ↓
Осадок хлорида серебра (и остальные галогениды) , как и гидроксида меди, растворяется в NH 3 * H 2 O
Еще одна особенность серебра, которая позволяет определить его ионы в растворе, – это его гидроксид, который нестабилен и быстро разлагается в водном растворе.
При добавлении к раствору соли серебра щелочи , выпадает черный осадок оксида серебра :
AgNO 3 + KOH → KNO 3 + AgOH
можно (и грамотнее) записать сразу:
То есть при добавлении к соли серебра щелочи выпадает черный осадок . Осадок оксида серебра , как и галогениды этого металла, растворяются в NH 3 (водн.) :
[ Ag ( NH 3 ) 2 ] OH – гидроксид диамминсеребра( I ) известен как раствор Толленса.
Он используется в качественной реакции на альдегиды (реакция серебряного зеркала).
Оксид серебра как основный гидроксид растворяется в кислотах (само собой, в тех, с которыми серебро может образовать растворимую соль):
Железо – серебристо-белый пластичный металл.
Обладает магнитными свойствами.
Вытесняет из растворов кислот водород (кроме азотной). Обратите внимание, что при взаимодействии с кислотами-неокислителями, и слабыми окислителями железо приобретает степень окисления +2, а при взаимодействии с сильными окислителями оно приобретет степень окисления +3:
2 Fe + 3 Cl 2 ( t )→ 2 FeCl 3
Катион Fe 3+
При добавлении к раствору, содержащему ионы трехвалентного железа , выпадает бурый осадок гидроксида железа ( III ):
Сокращенное ионное уравнение:
Оксид и гидроксид железа( III ) – амфотерные соединения, поэтому они растворяются в щелочах и кислотах:
Катион Fe 2+ с гидроксид ионом тоже образует осадок, только зеленоватого цвета .
Сокращенное ионное уравнение: Fe 2+ + 2 OH — → Fe ( OH ) 2 ↓
Оксид и гидроксид железа( II ) – основные.
В щелочах не растворяются. Осадок со временем буреет (меняет степень окисления с 2+ на +3):
На ионы железы есть еще две похожие канонические качественные реакции. Образуется одно и то же вещество: берлинская лазурь, или турнбулева синь.
Раньше считали, что это два разных вещества, в книжках писали: «не путайте», а потом оказалось, что это не так.
Ион Fe 2+ определяется добавлением красной кровяной соли (гексацианоферрат (III) калия):
4Fe 2+ + 3 [Fe III (CN) 6 ] 3− → Fe III 4 [Fe II (CN) 6 ] 3 ↓
Ион Fe 3+ определяется добавлением желтой кровяной соли (гексацианоферрат (II) калия):
4Fe 3+ + 3 [Fe II (CN) 6 ] 4− → Fe III 4 [Fe II (CN) 6 ] 3 ↓
Не очень активный, так как покрывается оксидной пленкой.
Название элемента переводится с греческого «цвет», потому что соединения хрома, как правило, окрашены. Простое вещество хром ведет себя как типичный металл, со щелочами не реагирует.
Реагирует с кислотами. Кислоты-неокислители ( в том числе разбавленная серная кислота) и вообще слабые окислители переводят хром в степень окисления +2:
Cr + S (t)→ CrS C окислителями приобретает степень окисления +3:
В общем тут все как у железа. Правило простое и вполне логичное.
С азотной и концентрированной серной кислотой не реагирует, так как пассивируется.
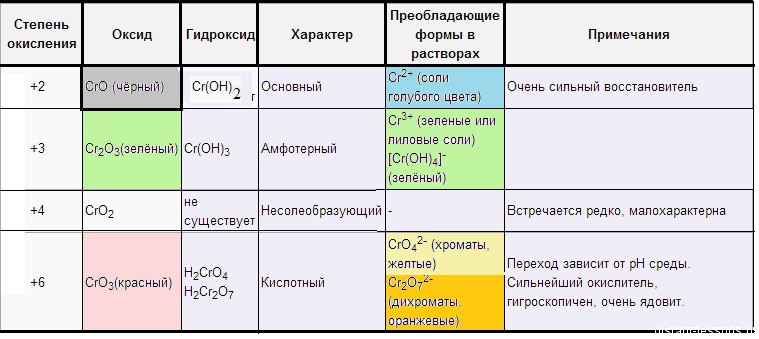
Проявляет несколько устойчивых степеней окисления.
Степень окисления +2
В этих соединениях хром проявляет сильные восстановительные свойства.
Оксид хрома ( II ) – CrO (основный) – черный.
Растворы солей Cr 2+ голубые . Если обработать черный оксид хрома( II ) соляной кислотой, образуется голубой раствор :
Если к раствору соли двухвалентного хрома добавить щелочь выпадет желтый осадок гидроксида хрома( II ), (осадок на воздухе зеленеет, об этом чуть позже):
Сокращенное ионное уравнение:
Гидроксид хрома( II ) основный,
поэтому он не растворяется в щелочах, зато прекрасно растворяется в кислотах, образуя все тот же синий раствор:
Степень окисления +3.
Оксид хрома( III ) – Cr 2 O 3 (амфотерный) – зеленый .
Как амфотерный оксид Cr 2 O 3 растворяется в кислотах и щелочах:
Соли трехвалентного хрома могут быть разного цвета (от фиолетового до темно-зеленого). Поэтому визуально опознать соль трехвалентного хрома со 100% уверенностью нельзя. Наличие катионов Cr 3+ в растворе определяется добавлением щелочи .
Cr 3+ с гидроксид-ионами образует зеленый осадок гидроксида хрома( III ) :
Сокращенное ионное уравнение:
Cr 3+ + 3 OH — → Cr ( OH ) 3 ↓
Выпавший осадок – гидроксид хрома( III ) амфотерный, поэтому растворяется в кислотах и щелочах, с образованием зеленых солей – гидроксохроматов :
Если оставить на некоторое время на воздухе желтый осадок гидроксида хрома( II ) , то он позеленеет . Cr +2 окисляется до Cr +3 ,
образуется зеленый гидроксид хрома( III ) :
Если подействовать на соединение хрома (+3) сильным окислителем, то произойдет смена окраски. Она станет желтой. Хром окислится до +6
Степень окисления +6.
В этих соединениях хром проявляет сильные окислительные свойства.
Оксид хрома( VI ) – CrO 3 (кислотный) – красный .
Окисляет многие органические соединения. Этот процесс описывают как «растворение [оксида хрома VI ] в спиртах (альдегидах, эфирах)»
Оксид кислотный, поэтому в кислотах не растворяется, растворяется в щелочах, с образованием хроматов:
Хроматы – это соли хромовой кислоты ( H 2 CrO 4 ). Они желтого цвета. Кроме хромовой (хром +6) образует дихромовую кислоту ( H 2 Cr 2 O 7 ), ее соли – бихроматы (дихроматы) оранжевые .
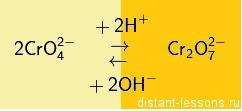
Хроматы и бихроматы переходят друг в друга при изменении кислотности среды (с щелочной на кислую и наоборот):
То есть в кислой среде более устойчивы бихроматы, в щелочной хроматы.
Хроматы и бихроматы так же являются сильнейшими окислителями.
При добавлении к раствору хромата катионов бария выпадает желтый осадок хромата бария BaCrO 4 :
Сокращенное ионное уравнение: Ва 2+ + СrO 4 2- → BaCr O 4 ↓
Полученный хромат бария растворяется в сильных неорганических кислотах. Потому что, как уже говорилось ранее, в кислой среде хроматы не устойчивы и переходят в бихроматы:
2 BaCrO 4 + 2 H + → 2 Ba 2+ + Cr 2 O 7 2- + H 2 O
Компактная таблица цветов соединения хрома, приведена у нас в статье “Хром”:
Как и хром малоактивен за счет пассивации.
Реагируя с кислотами (даже с кислотами-окислителями), окисляется до +2:
Mn + HCl → MnCl2 + H2↑
Mn + 2H2SO4(конц.) → MnSO4 + SO2↑ + 2H2O
В более агрессивных средах с кислотами-окислителями процесс окисления идет глубже: до +4 и +7.
Кислородом окисляется до +4 (там конечно есть другие варианты с другими температурами, но мы их рассматривать не будем):
Галогены (кроме фтора) до +2:
Mn + Cl2 (t)→ MnCl2
Проявляет различные степени окисления.
Степень окисления 2+.
Степень окисления 2+. Оксид марганца( II ) – MnO (основный) зеленого цвета .
На воздухе очень быстро окисляется до темно-бурого MnO 2 :
Соли, содержащие катион Mn 2+ как правило имеют бледный светло-розовый цвет .
Катион Mn 2+ обнаруживают гидроксид-ионами, с которыми он образует розовато-белый осадок гидроксида марганца( II ), который окисляется на воздухе и буреет (превращается в бурый оксид марганца( II )):
MnCl 2 + 2 KOH → Mn ( OH ) 2 ↓ + 2 KCl
Сокращенное ионное уравнение:
Mn 2+ + 2 OH — → Mn ( OH ) 2 ↓
Степень окисления 4+. Оксид марганца( IV ) – MnO 2 (амфотерный) т емно-бурый – одно из самых устойчивых и встречаемых соединений марганца.
Mn +4 O 2 + 4 HCl → Mn +2 Cl 2 + Cl 2 ↑ + 2 H 2 O
Степень окисления +6. Оксид марганца( VII ) – Mn 2 O 7 (кислотный) зелено-бурая жидкость.
Очень не стабильное и агрессивное вещество, может спонтанно взорваться. Сильный окислитель.
Оксиду марганца( VII ) соответствует марганцевая кислота HMnO 4 .
Она существует только в водном растворе, который как и растворы ее солей (перманганатов) имеет фиолетово-малиновую окраску .
Перманганаты так же являются сильными окислителями.
В ЕГЭ часто встречаются реакции окисления органических веществ перманганатом калия – это классика:
Приведенное выше уравнение – это качественная реакция на кратные связи – обесцвечивание раствора перманганата и выпадение темно-бурого осадка.
Это весьма необычное вещество. Может быть, трудно представить, но среди всех простых веществ есть только два, которые при нормальных условиях находятся в жидком агрегатном состоянии. Это бром и ртуть.
В нормальных условиях ртуть – серебристо-белая жидкость, с высокой плотностью, поэтому она тонет в воде.
Сама по себе металлическая ртуть вреда не представляет, а вот ее пары и соединения (в особенности органические) чрезвычайно ядовиты.
Качественная реакция на Hg 2+ : при добавлении к раствору соли ртути( II ) щелочи выпадает оранжевый осадок ОКСИДА ртути , гидроксид не образуется, его не существует:
NH 4 + – ион аммония
Если добавить к раствору аммония (иногда нужно нагреть) щелочь образуется нестабильный гидроксид аммония, который разлагается. В ыделяется аммиак – газ с реким запахом (запах нашатырного спирта) :
Можно записать сразу: NH 4 NO 3 + KOH → NH 3 ↑ + H 2 O + KNO 3
Сокращенное ионное уравнение: NH 4 + + NO 3 — → NH 3 ↑ + H 2 O
Выделившийся газ (аммиак) может быть поглощен растворами кислот, с образованием солей аммония: NH 3 + HCl → NH 4 Cl
H +
– частица, в которую превращается атом водорода, отдав электрон.
Получается протон, понятное дело, такая частица в воде не существует.
Частица эта прикреплена по донорно-акцепторному механизму к атому кислорода в молекуле воды, получается ион гидроксония: H 3 O + .
О чем свидетельствует наличие в растворе такого иона?
Конечно же о том, что среда раствора кислая.
А для определения кислотности используют индикаторы.
Рассмотрим несколько индикаторов: лакмус фиолетовый , метиловый оранжевый , фенолфталеин .
Лучше учить названия индикаторов именно так, ведь в таких названиях заключена информации о цвете индикатора в нейтральной среде:
метиловый оранжевый – оранжевый,
| Индикатор | Цвет в кислой среде pH | Цвет в нейтральной среде pH = 7 Цвет в щелочной среде pH > 7 | |
| Лакмус фиолетовый | Красный | Фиолетовый | Синий |
| Метиловый оранжевый | Красный | Оранжевый | Желтый |
| Фенолфталеин | Нет (бесцветный) | Нет (бесцветный) | Малиновый |
Существует несколько мнемонических правил для запоминания цветов индикаторов:
Фенолфталеиновый в щелочах малиновый, но несмотря на это в кислотах он без цвета.
В кислотах лакмус красный – цвет такой прекрасный, а в щелочах он синий как январский иней, а в нейтральной среде фиолетовый, как нигде. (Этот стишок сочинили когда-то мы с товарищем. Хоть он не совсем складный и мы так и не можем объяснить, с чего бы это иней, который обычно белый, в январе вдруг станет синим, стишок как-то по-особенному запал в мою память, всегда им пользуюсь)
Кислота – начинается на букву К, как и слово «кислый» — помогает вспомнить цвет лакмуса и метилоранжа в кислотах.
– элементы VIIA -группы( F , Cl , Br , I ), типичные неметаллы.
Пойдем по порядку:
Фтор – F 2 – желтый газ с легким зеленым отливом. Самый электроотрицательный неметалл, поэтому с кислородом образует не оксид фтора, а фторид кислорода: OF 2 степень окисления кислорода в нем равна +2. Чрезвычайно активное вещество, реагирует со всем, с чем не лень. И большинство реакций протекает бурно, взрывообразно.
Фторид-ионы ( F — ) в растворе определяются добавлением катионов кальция ( Ca 2+ ), наблюдается выпадение белого осадка :
2 KF + CaCl 2 → 2 KCl + CaF 2 ↓
Сокращенное ионное уравнение: Ca 2+ + 2 F — → CaF 2 ↓
- Хлор – Cl 2 – зеленый газ, с характерным резким запахом, сильный яд, тяжелее воздуха (при химической атаке стелется по земле):
Хлорид-ионы ( Cl — ) в растворе определяются добавлением катионов серебра ( Ag + ), наблюдается выпадение белого творожистого осадка (об этой реакции говорилось ранее в разделе серебро):
KCl + AgNO 3 → AgCl ↓ + KNO 3
Сокращенное ионное уравнение: Ag + + Cl — → AgCl ↓
- Бром – Br 2 – красно-бурая летучая жидкость, имеющая очень резкий неприятный запах.
Бромд-ионы ( Br — ) в растворе определяются добавлением катионов серебра ( Ag + ), наблюдается выпадение слегка желтоватого осадка :
KBr + AgNO 3 → AgBr ↓ + KNO 3
Сокращенное ионное уравнение: Ag + + Br — → AgBr ↓
- Иод – I 2 – летучие черно-серые с фиолетовым отливом кристаллы. Пары фиолетовые, имеют характерный запах.
Иодид-ионы ( I — ) в растворе определяются добавлением катионов серебра ( Ag + ), наблюдается выпадение желтоватого осадка (цвет интенсивнее, чем у бромида серебра) :
Сокращенное ионное уравнение: Ag + + I — → AgI ↓
Осадки-галогениды не растворяются в разбавленных кислотах.
Простое вещество сера – хрупкие желтые кристаллы.
Сера может проявлять различные степени окисления:
Степень окисления -2:
в сульфИД-ионе ( S 2- ) и гидросульфИД-ионе ( HS — ).
СульфИДы (и гидросульфИДы) – это соли сероводородной кислоты, которая является слабым электролитом. Поэтому сильные кислоты вытесняют ее из растворов солей. Выделяется H 2 S – сероводород, газ с неприятным запахом тухлых яиц :
K 2 S + 2HCl → 2KCl + H 2 S↑
Сокращенное ионное уравнение: 2 H + + S 2- → H 2 S ↑
Выделившийся газ ( H 2 S ) на воздухе сгорает синим пламенем (не в смысле, что выделился и сразу сгорел, а если начать сжигать):
Так же сероводород ( H 2 S ) может быть поглощен растворами щелочей: H 2 S + 2 NaOH →
Сероводород является хорошим восстановителем, так как сера в нем в низшей степени окисления.
Еще одна особенность ионов S
2- позволяет легко определить их в растворе. Ионы S 2- образуют осадки со многими тяжелыми металлами:
- Классическая реакция с ионами Pb2+ . Образуется черный осадок сульфида серы :
- С ионами Cu 2+ , Fe 2+ , Ni 2+ , Cu 2+ , Pb 2+ , Hg 2+ , Ag + и ионами многих других металлов тоже образуются осадки черного цвета .
- С ионом Zn 2+ образуется белый осадок (один из немногих нечерных нерастворимых сульфидов):
Так как сера в сульфид-ионе в низшей степени окисления, она может окислиться. При действии сильных окислителей на сульфиды они окисляются до сульфатов (как правило). Классическая ЕГЭ-шная реакция, цитата из С2: «…черный осадок побелел после обработки его пероксидом водорода… ». Речь идет о
черном осадке сульфида свинца ( PbS ). Пероксид водорода H 2 O 2 (сильный окислитель) превращает черный сульфид свинца в белый (тоже нерастворимый) сульфат свинца ( PbSO 4 ):
Степень окисления + 4:
встречается в оксиде серы ( IV ) (сернистом газе – SO 2 ), в соответствующей этому оксиду кислоте – сернистой ( H 2 SO 3 , существующей только в растворе) и в солях сернистой кислоты – сульфИТах и гидросульфИТах.
Сернистый газ ( SO 2 ) – бесцветный газ с резким запахом (по легендам – запахом ада). Его можно почувствовать чиркнув спичку. Образуется при сжигании серы, сероводородов, сульфидов, серосодержащих органических веществ. Классическое школьное уточнение: « обесцвечивает раствор фуксина и фиолетовые чернила », при этом совсем не обязательно знать, что такое фуксин, и какие реакции протекают. Просто хорошо бы запомнить эту формулировку.
Так как является кислотным оксидом, реагирует с растворами щелочей. (формулировка из задания ЕГЭ: «…выделившийся газ с резким запахом был поглощен раствором щелочи…» ). Образуются соли сернистой кислоты – сульфиты:
СульфИТ-ионы и гидросульфИТ-ионы в растворе можно обнаружить добавлением сильной кислоты. При этом из раствора сульфита (гидросульфита) вытесняется сернистая кислота: H 2 SO 3 , которая не стабильная, поэтому быстро разлагается на воду и соответствующий оксид ( SO 2 ). То есть, если совсем коротко: при действии на сульфиты и гидросульфиты кислот выделяется SO 2 – газ с резким запахом (обесцвечивающий раствор фуксина и фиолетовые чернила):
Можно (и грамотнее) записать сразу:
Степень окисления +6
встречается в серном ангидриде (оксиде серы( VI ) – SO 3 ), в соответствующей ему серной кислоте ( H 2 SO 4 ) и в ее солях, сульфАТах.
Серный ангидрид ( SO 3 ) и серная кислота( H 2 SO 4 ) содержат серу в высшей степени окисления, поэтому являются сильными окислителями.
Сульфаты в растворе определяются добавлением катионов бария ( Ba 2+ ). Сульфат-ион с катионом бария образует белый осадок ( нерастворимый в кислотах ):
Сокращенное ионное уравнение: Ва 2+ + S O 4 2- → BaS O 4 ↓
CO 3 2-
– карбонат-ион и HCO 3 — – гидрокарбонат-ион
являются анионом слабой, нестабильной, существующей только в растворе, угольной кислоты. Поэтому она легко вытесняется сильными кислотами из растворов солей (карбонатов и гидрокарбонатов).
Вытесняется и тут же распадается на воду и углекислый газ.
При действии кислот на карбонаты выделяется бесцветный газ без вкуса и запаха :
Можно (и грамотнее) записать сразу: K 2 CO 3 + 2 HCl → 2 KCl + CO 2 ↑ + H 2 O
Эта качественная реакция вам хорошо известна, вы наверняка проводили ее у себя дома. Добавим уксус к соде, и как раз будет выделяться газ, в чем можно убедиться если поднести спичку, она погаснет, так как CO 2 не поддерживает горения:
Выделившийся углекислый газ может быть поглощен раствором щелочи:
В связи со способностью поглощаться щелочами для описания углекислого газа часто встречается следующая формулировка: «… газ, при пропускании его через известковую воду, вызвал ее помутнение… ». Известковая вода – это профильтрованный раствор гидроксида кальция (гидроксид кальция полностью не растворяется в воде, образуется взвесь, и чтобы получить прозрачный раствор – его фильтруют, для очищения от не растворившихся частиц гидроксида кальция). При взаимодействии гидроксида кальция с углекислым газом образуется нерастворимый карбонат кальция, который и обеспечивает мутность:
PO 4 3-
– анион ортофосфорной кислоты (H 3 PO 4 ). В растворе его можно определить добавлением катионов серебра , при этом выпадает интенсивно-желтый осадок :
Сокращенное ионное уравнение: 3 Ag + + PO 4 3- → Ag 3 PO 4 ↓
SiO 3 2-
– анион кремниевой кислоты ( H 2 SiO 3 ) , которая являясь слабым электролитом, вытесняется из растворов ее солей. Кроме того, кремниевая кислота малорастврима в воде, поэтому в момент вытеснения ее из раствора соли, появляется гелеобразный осадок – это и будет H 2 SiO 3 :
Кремниевая кислота настолько слабая, что вытесняется даже угольной:
– оксид азота ( VI ).
Ядовитый газ с неприятным запахом бурого цвета.
В ЕГЭ его обычно именно так и обзывают – бурый газ .
Химически очень активное вещество:
- при взаимодействии не очень активных металлов с HNO 3 концентрированной;
- при разложении нитратов этих металлов.
В реакции с водой диспропорционируется, образуя азотную и азотистую кислоты:
Похожая реакция диспропорционирования происходит при растворении NO 2 в щелочах (образуются не кислоты, а соли этих кислот, нитраты и нитриты соответственно):
В присутствии избытка кислорода реакция идет без образования азотистой кислоты (диспропорционирования не происходит):
OH —
Наличие в растворе ионов OH — указывает на щелочную реакцию среды ( pH >7).
Определить pH можно с помощью индикаторов.
Окраски индикаторов в разных средах указаны в пункте про ион H + . Щелочную среду имеют не только щелочи, но и растворы аммиака и аминов, растворы солей, образованных сильными основаниями и слабыми кислотами.
Если нужно определить щелочь, то к раствору надо добавить соль металла, образующего слабое основание. Щелочь с такой солью даст осадок гидроксида металла:
CuCl 2 + 2NaOH → Cu(OH) 2 ↓ + 2NaCl
💥 Видео
Кадмий - Cd. Реакция Хлорида Кадмия и Цинка. Реакция Zn и CdCl2.Скачать

Качественная реакция на хлорид, бромид, йодид ион.Скачать

Получение осадка гидроксида цинка и растворение его в избытке щёлочиСкачать

Zn + 2HCl → ZnCl2 + H2 | Реакция цинка и соляной кислотыСкачать

Опыты по химии. Амфотерность гидроксида цинкаСкачать

Качественная реакция ионов хрома(III) со щелочью. Получение и свойства гидроксида хромаСкачать

Качественная реакция на ион трехвалентного железаСкачать

Опыты по химии. Качественная реакция на хлорид-ионСкачать

Опыты по химии. Растворение цинка в кислотах и щелочахСкачать

Гидролиз солей. 9 класс.Скачать

Гексацианоферрат(3) Цинка - Zn3[Fe(CN)6]2. Реакция Гексацианоферрата(3) Калия и Сульфата Цинка.Скачать
![Гексацианоферрат(3) Цинка - Zn3[Fe(CN)6]2. Реакция Гексацианоферрата(3) Калия и Сульфата Цинка.](https://i.ytimg.com/vi/B_wDQrg0GKo/0.jpg)
РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

качественная реакция на хлорид-ионы и ионы серебраСкачать

Химическая реакция цинка и медного купоросаСкачать

Никель - Ni. Реакция Сульфата Никеля и Цинка. Реакция NiSO4 и Zn. Получение Никеля.Скачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Обнаружение ионов в растворе. Качественные реакцииСкачать