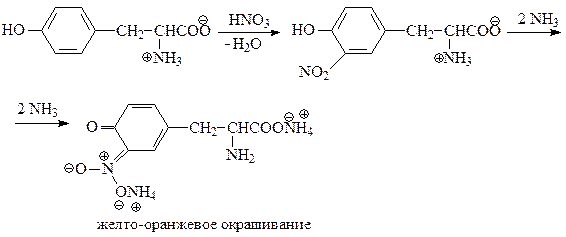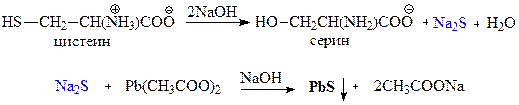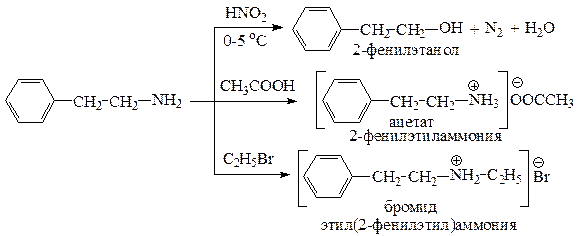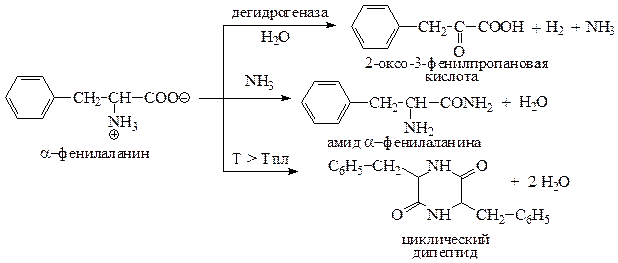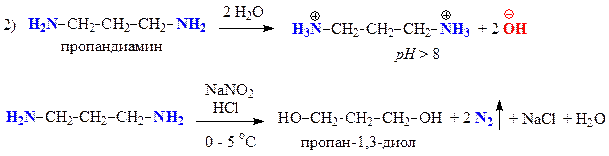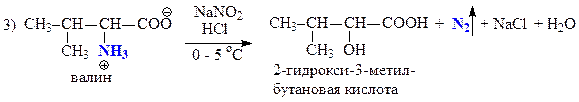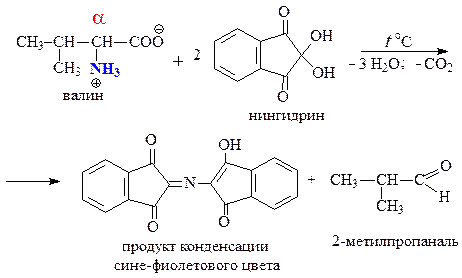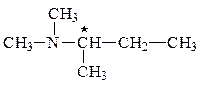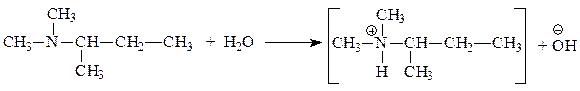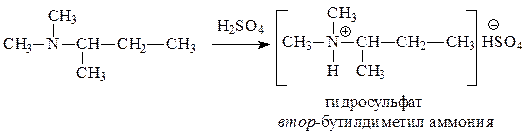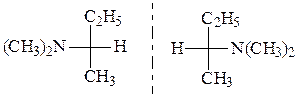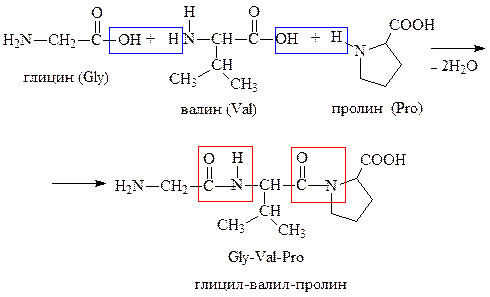История химии в школьном курсе
РЕАКЦИЯ ПИОТРОВСКОГО (БИУРЕТОВАЯ РЕАКЦИЯ)
В белках аминокислоты связаны друг с другом по типу полипептидов и дикетопиперазинов. Образование полипептидов из аминокислот происходит путем отщепления молекулы воды от аминогруппы одной молекулы аминокислоты и карбоксильной группы другой молекулы:
Образующаяся группа –С(О)–NН– называется пептидной группой, связь С–N, соединяющая остатки млекул аминокислот, – пептидной связью.
При взаимодействии дипептида с новой молекулой аминокислоты получается трипептид и т. д.
Дикетопиперазины образуются при взаимодействии двух молекул аминокислот с отщеплением двух молекул воды:
Дикетопиперазины были выделены из белков Н.Д.Зелинским и В.С.Садиковым в 1923 г.
Наличие в белке повторяющихся пептидных групп подтверждается тем, что белки дают фиолетовое окрашивание при действии небольшого количества раствора медного купороса в присутствии щелочи (биуретовая реакция).
Описание опыта. 2–3 мл раствора белка нагревают с 2–3 мл 20%-го раствора едкого кали или натра и несколькими каплями раствора медного купороса. Появляется фиолетовое окрашивание вследствие образования комплексных соединений меди с белками.
- РЕАКЦИЯ РУЭМАННА (НИНГИДРИНОВАЯ РЕАКЦИЯ (1911))
a -Аминокислоты реагируют с нингидрином, образуя сине-фиолетовый комплекс (пурпур Руэманна), интенсивность окраски которого пропорциональна количеству аминокислоты.
Реакция идет по схеме:
Реакция с нингидрином используется для визуального обнаружения a -аминокислот на хроматограммах (на бумаге, в тонком слое), а также для колориметрического определения концентрации аминокислот по интенсивности окраски продукта реакции.
Описание опыта. В пробирку наливают 1 мл 1%-го раствора глицина и 0,5 мл 1%-го раствора нингидрина. Содержимое пробирки осторожно нагревают до появления сине-фиолетового окрашивания.
- Реакция Сакагучи
Эта реакция на аминокислоту аргинин основана на взаимодействии аргинина с a -нафтолом в присутствии окислителя. Ее механизм еще полностью не выяснен. По-видимому, реакция осуществляется по следующему уравнению:
Поскольку производные хинониминов (в данном случае нафтохинона), у которых водород иминогруппы –NH– замещен на алкильный или арильный радикал, всегда окрашены в желто-красные тона, то, по-видимому, оранжево-красный цвет раствора при проведении реакции Сакагучи объясняется возникновением именно производного нафтохинонимина. Не исключена, однако, вероятность образования еще более сложного соединения за счет дальнейшего окисления оставшихся NH-групп аргининового остатка и бензольного ядра a -нафтола:
Описание опыта. В пробирку наливают 2 мл 0,01%-го раствора аргинина, затем добавляют 2 мл 10%-го раствора едкого натра и несколько капель 0,2% спиртового раствора a -нафтола. Содержимое пробирки хорошо перемешивают, приливают 0,5 мл раствора гипобромита и вновь перемешивают. Немедленно добавляют 1 мл 40%-го раствора мочевины для стабилизации быстро развивающегося оранжево-красного окрашивания.
- РЕАКЦИЯ ФОЛЯ
Это реакция на цистеин и цистин. При щелочном гидролизе «слабосвязанная сера» в цистеине и цистине достаточно легко отщепляется, в результате чего образуется сероводород, который, реагируя со щелочью, дает сульфиды натрия или калия. При добавлении ацетата свинца(II) образуется осадок сульфида свинца(II) серо-черного цвета.
Описание опыта. В пробирку наливают 1 мл раствора цистина, прибавляют 0,5 мл 20%-го раствора гидроксида натрия. Смесь нагревают до кипения, а затем добавляют 0,5 мл раствора ацетата свинца(II). Наблюдается выпадение серо-черного осадка сульфида свинца(II):
- РЕАКЦИЯ С ФОРМАЛЬДЕГИДОМ
При взаимодействии a -аминокислот с формальдегидом образуются относительно устойчивые карбиноламины – N-метилольные производные, содержащие свободную карбоксильную группу, которую затем титруют щелочью:
Эта реакция лежит в основе количественного определения a -аминокислот методом формального титрования (метод Сёренсена).
Описание опыта. В пробирку наливают 5 капель 1%-го раствора глицина и прибавляют 1 каплю индикатора метилового красного. Раствор окрашивается в желтый цвет (нейтральная среда). К полученной смеси добавляют равный объем 40%-го раствора формальдегида (формалин). Появляется красное окрашивание (кислая среда):
- РЕАКЦИЯ Циммермана
Это реакция на аминокислоту глицин.
Описание опыта. К 2 мл 0,1%-го раствора глицина, доведенного добавлением 10%-го раствора щелочи до рН = 8, приливают 0,5 мл водного раствора о-фталевого диальдегида. Реакционная смесь начинает медленно окрашиваться в ярко-зеленый цвет. Через несколько минут выпадает зеленый осадок.
- ОБРАЗОВАНИЕ КОМПЛЕКСОВ С МЕТАЛЛАМИ
a -Аминокислоты образуют с катионами тяжелых металлов внутрикомплексные соли. Со свежеприготовленным гидроксидом меди(II) все a -аминокислоты в мягких условиях дают хорошо кристаллизующиеся внутрикомплексные (хелатные) соли меди(II) синего цвета:
В таких солях ион меди координационными связями соединен с аминогруппами.
Описание опыта. В пробирку наливают 3 мл 3%-го раствора сульфата меди(II), добавляют несколько капель 10%-го раствора гидроксида натрия до образования голубого осадка. К полученному осадку гидроксида меди(II) приливают 0,5 мл концентрированного раствора глицина. При этом образуется темно-синий раствор глицината меди:
- КСАНТОПРОТЕИНОВАЯ РЕАКЦИЯ
Эта реакция используется для обнаружения a -аминокислот, содержащих ароматические радикалы. Тирозин, триптофан, фенилаланин при взаимодействии с концентрированной азотной кислотой образуют нитропроизводные, имеющие желтую окраску. В щелочной среде нитропроизводные этих a -аминокислот дают соли, окрашенные в оранжевый цвет.
Описание опыта. В пробирку наливают 1 мл раствора тирозина и добавляют 0,5 мл концентрированной азотной кислоты. Смесь нагревают до появления желтой окраски. После охлаждения добавляют 1–2 мл 20%-го раствора гидроксида натрия до появления оранжевой окраски раствора:
- ОСАЖДЕНИЕ БЕЛКА СОЛЯМИ ТЯЖеЛЫХ МЕТАЛЛОВ
Описание опыта. В две пробирки наливают по 1–2 мл раствора белка и медленно, при встряхивании, добавляют по каплям в одну пробирку насыщенный раствор сульфата меди, а в другую – 20%-й раствор ацетата свинца. Образуются осадки труднорастворимых солеобразных соединений белка. Опыт иллюстрирует применение белка как противоядия при отравлении солями тяжелых металлов.
- Открытие аминного азота в белках
Описание опыта. В сухую пробирку помещают немного сухого белка, например желатины. Прибавляют пятикратное количество натронной извести (смесь едкого натра и гидроксида кальция), перемешивают встряхиванием и подогревают. Выделяется аммиак, вызывающий посинение розовой лакмусовой бумажки, смоченной водой. Одновременно ощущается запах жженого волоса, что всегда наблюдается при сжигании белковых веществ.
- Открытие серы в белках
Описание опыта. В пробирку наливают около
0,5 мл раствора уксуснокислого свинца и прибавляют раствор едкого кали до растворения образовавшегося осадка гидроксида свинца. В другую пробирку наливают
2–3 мл раствора белка и приливают такой же объем полученного раствора плюмбита. Нагревают смесь до кипения в течение 2–3 мин. Появление темного окрашивания указывает на образование сульфида свинца.
- РЕАКЦИЯ НА ПРИСУТСТВИЕ СЕРОСОДЕРЖАЩИХ a -АМИНОКИСЛОТ В БЕЛКЕ
Качественной реакцией на серосодержащие a -аминокислоты является реакция Фоля. Белки, содержащие остатки цистеина или цистина, также дают эту реакцию.
Описание опыта. В пробирку наливают 10 капель раствора яичного белка и вдвое больший объем 20%-го раствора гидроксида натрия. Содержимое пробирки нагревают до кипения (1–2 мин). К полученному щелочному раствору добавляют 5 капель раствора ацетата свинца(II) и вновь кипятят реакционную смесь. Наблюдается появление серо-черного осадка.
- РЕАКЦИЯ НА ТРИПТОФАН
Триптофан, реагируя в кислой среде с альдегидами, образует окрашенные продукты конденсации. Например, с глиоксиловой кислотой (являющейся примесью к концентрированной уксусной кислоте) реакция протекает по уравнению:
По аналогичной схеме протекает и реакция триптофана с формальдегидом.
В ходе проведенного исследования мы выявили по литературным источникам имеющуюся информацию о цветных качественных реакциях на белковые аминокислоты; выполнили ряд перечисленных реакций и составили базу данных. Эта база может быть использована в школьной практике как в теоретическом плане, так и в практическом, т. к. мы приводим краткие, но подробные описания выполнения всех опытов.
Из предложенных 18 качественных реакций каждая практически осуществима в школьном курсе химии и имеет важное практическое значение. Сопровождение реакций химическими уравнениями конкретизирует и углубляет знания по биологической и органической химии, особенно знания учащихся специализированных биологических и химических классов.
Использованная литература
Ермаков А.Н., Арасимович В.В., Смирнова-Иконникова М.И., Мирри И.К. Методы биохимического исследования растений. М.,1952, 520 с.
Полянская А.С., Шевелева А.О. Методическая разработка по лабораторным работам: «Аминокислоты» и «Белки». Л., 1976, 37 с.
Пустовалова Л.М. Практикум по биохимии. 1999, 541 с.
Руководство к практическим занятиям по органической химии. Под ред. В.М.Родионова. М., 1954, 111 с.
Соловьев Н.А. Лабораторные работы по биологической химии. Методическая разработка. СПб., 1996, 70 с.
Филиппович Ю.Б., Егорова Т.А., Севастьянова Г.А. Практикум по общей биохимии. М., 1982, 311 с.
З.Саитов, С.В.Телешов, Б.Харитонцев,
секция «Юный химик» РХО им. Д.И.Менделеева (г. Тобольск)
Видео:Мастер-класс по изучению качественных реакций на белки и отдельные аминокислоты.Скачать

Качественные реакции на аминокислоты
1) Нингидриновая реакция — качественная реакция на a-аминокислоты — при взаимодействии с нингидрином происходит окислительное дезаминирование a-аминокислот с образованием продукта конденсации сине-фиолетового цвета.
2) Ксантопротеиновая реакция — качественная реакция на ароматические и гетероциклические аминокислоты — появление желто-оранжевой окраски после добавления аммиака к продукту нитрования ароматического кольца
3) Реакция Фоля — качественная реакция на серосодержащие аминокислоты (цистеин, метионин) — образование черного осадка PbS при добавлении ацетата свинца к продуктам щелочного гидролиза серосодержащих аминокислот.
Решение
Приведем уравнения реакций 2-фенилэтанамина с HNO2; CH3COOH; С2Н5Br.
Приведем уравнения реакций α-фенилаланина с дегидрогеназой; NH3; T > Tпл.
Пример решения задачи 36
Решение
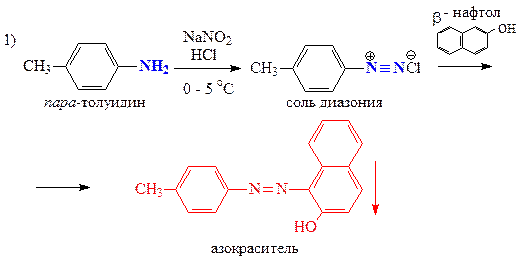
С помощью качественных проб и реакций отличите между собой три вещества пара-толуидин (А), дипропиламин (Б) и валин (В).
А — пара-толуидин — первичный ароматический амин

Б — пропандиамин — первичный алифатический амин
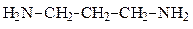
В — валин — алифатическая a-аминокислота
Составим план эксперимента в виде таблицы:
| Опыт | Реагент | Наблюдаемый результат и вывод | |
| Пробирка 1 | Пробирка 2 | Пробирка 3 | |
| Н2О NaNO2+HCl, 0-5 °C + β-нафтол нингидрин | Не растворяется Гомогенный раствор Красно-оранжевое окрашивание — первичная ароматическая аминогруппа Без изменений | Растворяется рН > 8 — сильное основание Выделение газа — первичная алифатическая аминогруппа — Без изменений | Растворяется рН = 5 Выделение газа — первичная алифатическая аминогруппа — Фиолетовое окрашивание — a-аминокислота |
| Общий вывод | пара-толуидин | пропандиамин | валин |
Запишем уравнения соответствующих реакций:
Пример решения задачи 37
Установите строение соединения с молекулярной формулой А, которое соответствует приведенному описанию
| Вариант | Молекулярная формула соединения А | Описание свойств соединения А |
| Х | С6Н15N | а) в водном растворе имеет рН > 8; б) с H2SO4 образует соль; в) алкилируется, но не ацилируется; г) с азотистой кислотой при 0-5 °С заметно не реагирует; д) может существовать в виде энантиомеров |
Сделаем выводы о строении соединения из условия задачи
| Экспериментальный факт | Выводы о строении |
| С6Н15N а) в водном растворе имеет рН > 8; б) с H2SO4 образует соль; в) алкилируется, но не ацилируется; г) с азотистой кислотой при 0-5 °С заметно не реагирует; д) может существовать в виде энантиомеров | насыщенное алифатическое азотсодержащее соединение а) сильные основные свойства — алифатический амин; б) амин; в) алкилируются все амины, но если не ацилируется, значит третичный амин; г) третичный алифатический амин; д) содержит асимметрический С-атом (хиральный центр) |
Искомое вещество является третичным алифатическим амином, содержащим хиральный центр (*):
а) в водном растворе имеет рН > 8:
д) может существовать в виде энантиомеров:
Пример решения задачи 38
Пептиды — это природные или синтетические соединения, молекулы которых построены чаще всего из остатков α-аминокислот, соединённых в цепь пептидными (амидными) связями —C(O)NH-.
Полипептиды состоят из сотен аминокислот, олигопептиды — из небольшого числа аминокислот (от 10 до 50), и простые пептиды до 10.
Решение
Из соответствующих аминокислот (табл. 53) постройте формулу трипептида Gly-Val-Pro. Обозначьте пептидные связи, назовите образованный трипептид.
Перечислм, качественные реакции, которые могут протекать для полученного трипептида:
а) выделение газа при добавлении NaHCO3 — качественная реакция на карбоксильную группу;
б) моментальное выделение газа при добавлении HNO2 при 0-5 °С — качественная реакция на первичную алифатическую аминогруппу;
в) фиолетовое окрашивание при взаимодействии с нингидрином (нингидриновая реакция) — качественная реакция на a-аминокислоты;
г) биуретовая реакция — возникновение синей или розово-фиолетовой окраски при взаимодействии с Сu(OH)2 — качественная реакция на a-аминокислоты и пептидные связи.
Видео:Качественные реакции на белки в сравнении с реакциями на аминокислоты. Химический опытСкачать

Лабораторная работа №1. Качественные реакции на аминокислоты и белки
Лабораторная работа №1
КАЧЕСТВЕННЫЕ РЕАКЦИИ НА АМИНОКИСЛОТЫ И БЕЛКИ
Белки представляют собой высокомолекулярные полимерные органические соединения, построенные из аминокислот. В природе известно более 500 различных аминокислот, однако белки формируются всего лишь из 20, при этом аминокислоты белков представляют собой α-аминокислоты. Это кислоты, аминированные в α-положении; амино — и карбоксильная группа присоединены к одному и тому же атому углерода, который называют α-углеродом. Аминокислоты в молекуле белка соединены между собой пептидными связями. Соединение, образованное сравнительно небольшим числом аминокислот, называют пептидом или полипептидом. Если молекулярный вес полипептида достигает или превышает 5000, то говорят собственно о белке.
Аминокислоты различаются друг от друга природой радикала. Это разнообразие дает возможность обнаружения большинства аминокислот с помощью цветных реакций. Многие из них весьма чувствительны и высокоспецифичны, что позволяет открывать ничтожные количества той тили иной индивидуальной аминокислоты в составе сложных смесей, биологических жидкостях, гидролизатах белков и т. п. некоторые цветные реакции находят применение для количественного определения аминокислот.
Методы качественного обнаружения белков основаны на двух типах реакций: а) по пептидным связям белковой молекулы; б) по её аминокислотным радикалам.
Примером реакции первого типа служит биуретовая реакция. Примерами реакций второго типа являются многочисленные цветные реакции на радикалы аминокислот. По характеру цветных реакций второго типа можно судить до некоторой степени о составе белков.
Оборудование, реактивы. Встряхиватель; баня водяная; термометр лабораторный; фильтры бумажные; марля; колбы конические на 250 мл; набор пробирок стеклянных химических; пипетки, цилиндры; стаканы стеклянные лабораторные с носиком на 100 и 250 мл; воронки стеклянные; лакмусовая бумага; свежее яйцо; свежее говяжье мясо; молоко; пшеничная мука; хлорид натрия (10%-ный); сульфат аммония (насыщ.); гидроксид натрия (10%-ный и 30%-ный); сульфат меди (1%-ный); нингидрин (0,5 и 1%-ный) в этаноле (95%-ном); α-нафтол (0,1 и 0,2%-ный спиртовой раствор); ледяная уксусная кислота; серная, соляная и азотная кислоты (конц.); желатина (раствор 1%); формальдегид (2,5%-ный); нитрит натрия (0,05%-ный и 0,5%-ный); сульфаниловая кислота (1%-ная); карбонат натрия (10%-ный); соляная кислота (5%-ная).
Работа 1. Приготовление растворов белка для проведения качественных реакций
Неразбавленный белок куриного яйца. Отделяют белок трех куриных яиц от желтков. Считая, что масса белка в одном яйце в среднем равна 33 г, получают около 100 мл неразбавленного раствора белков куриного яйца. Этот раствор содержит 88% воды, 1 % углеводов и 0,5% минеральных веществ; остальное приходится на белок. Таким образом, полученный неразбавленный белок куриного яйца представляет собой примерно 10%-ный раствор белка.
Разбавленный раствор яичного альбумина. Белок одного куриного яйца после отделения от желтка хорошо взбивают и затем смешивают в колбе при встряхивании с десятикратным объемом дистиллированной воды. Раствор фильтруют через двойной слой смоченной водой марли, помещенной в воронку. Отфильтровывают раствор яичного альбумина; в осадке (на марле) остается яичный глобулин. Учитывая, что концентрация альбумина в белке куриного яйца составляет около 6%, полученный разбавленный раствор яичного альбумина является примерно 0,5%-ным.
Белки мяса. Помещают в стакан 40-50 г пропущенного через мясорубку мяса (постного), добавляют 80-100 мл 10%-ного раствора хлорида натрия и оставляют смесь стоять 15-20 мин при частом помешивании. Отфильтровывают через бумажный складчатый фильтр или через двойной слой марли окрашенную в красный цвет жидкость. В растворе содержится главным образом мышечный альбумин и глобулин.
Белки молока. К 50 мл свежего молока добавляют равный объем насыщенного раствора сульфата аммония. При этом выпадают в осадок глобулины и казеин. Отфильтровывают через складчатый бумажный фильтр раствор альбуминов.
Растительный альбумин. 25 г пшеничной муки смешивают со 100 мл дистиллированной воды и смесь встряхивают в течение 1 ч с помощью встряхивателя. Взвесь муки центрифугируют и надосадочную жидкость фильтруют через складчатый фильтр. Отфильтрованный прозрачный раствор содержит преимущественно альбумин пшеничных зерен.
Работа 2. Качественные реакции на аминокислоты
При добавлении к раствору белка незначительных количеств глиоксиловой кислоты в присутствии крепкой серной кислоты получается красно-фиолетовое окрашивание. Эта реакция связана с присутствием в молекуле белка аминокислоты триптофана и основана па способности триптофана в кислой среде вступать в реакцию е альдегидами, образуя при этом окрашенные продукты конденсации.
Глиоксиловая кислота всегда присутствует в небольших количествах в ледяной уксусной кислоте, поэтому последнюю используют в реакции как источник глиоксиловой кислоты.
Триптофан в этой реакции конденсируется с формальдегидом, выделяющимся из глиоксиловой кислоты под действием концентрированной серной кислоты. Продукт конденсации окисляется до бис-2-триптофанилкарбинола. Последний в присутствии минеральных кислот образует окрашенные в сине-фиолетовый цвет соли.
Ход работы. В пронумерованные пробирки наливают по 5 капель приготовленных растворов. В каждую пробирку добавляют по 5 капель концентрированной уксусной кислоты. Раствор сначала слегка нагревают, затем охлаждают и по стенке пробирки, сильно наклонив её, чтобы жидкости не смешивались (подслаивание), приливают 10 капель концентрированной серной кислоты. При стоянии на границе двух слоев жидкости наблюдается красно-фиолетовое окрашивание в виде кольца. Появление окраски можно ускорить, поместив пробирку в кипящую водяную баню.
Реакция Вуазене протекает только с теми белками, которые содержат в своем составе триптофан. Химизм ее аналогичен химизму реакции Адамкевича (Гопкинса – Коле); и в том, и в другом случае в конденсацию с триптофаном вступает формальдегид.
Ход работы. К 2 мл разбавленного раствора белка в пробирке добавляют одну каплю 2,5%-ного раствора формальдегида. Смешивают и прибавляют 6 мл чистой концентрированной соляной кислоты (плотность не менее 1,175), после чего снова перемешивают. Через 10 мин прибавляют при взбалтывании 10 капель 0,5%-ного раствора нитрита натрия. Развивается интенсивное сине-фиолетовое окрашивание.
При взаимодействии кислого раствора сульфаниловой кислоты с нитритом натрия осуществляетоя реакция диазотирования и образуется диазобензолсульфоновая кислота. При реакции последней с гистидином образуется соединение вишнево-красного цвета.
Ход работы. К 1 мл 1%-ного раствора сульфанйловой кислоты в 5%-ном растворе соляной кислоты приливают 2 мл 0,5%-ного раствора нитрита натрия, сильно встряхивают и немедленно добавляют сначала 2 мл разбавленного раствора белка, а затем, после перемешивания содержимого, пробирки, 6 мл 10%-ного раствора карбоната натрия. После смешивания растворов развивается вишнево-красное окрашивание.
При добавлении к раствору белка крепкой едкой щелочи, уксуснокислого свинца и последующем кипячении раствор начинает темнеть. Реакция обусловлена присутствием в белке серусодержащих аминокислот: цистина, цистеина и метионина. Эти аминокислоты при нагревании в присутствии крепкой щелочи разрушаются, образуя сернистый натрий:
Уксуснокислый свинец реагирует со щелочью с образованием плюмбита натрия:
(CH3COO)2Pb + 2NaOH → Pb(ONa)2 + 2CH3COOH
Сернистый натрий при взаимодействии с плюмбитом образует черный осадок сернистого свинца.
Na2S + Pb(ONa)2 + 2H2O → PbS↓ + 4NaOH
Ход работы. В пронумерованные пробирки наливают по 5 капель приготовленных растворов. В каждую пробирку добавляют по 5 капель 30% раствора едкого натра и по 1 капле 5% раствора уксуснокислого свинца. При интенсивном кипячении жидкость, содержащая серусодержащие аминокислоты, темнеет, образуя черный осадок сернистого свинца.
Работа 3. Обнаружение в молекулах белков пептидных связей
В щелочной среде в присутствии солей меди растворы белка приобретают фиолетовый цвет с красным или синим оттенком, зависящим от количества пептидных связей в молекуле белка. Такую реакцию дают все белки, а также продукты их неполного гидролиза — пептоны и полипептиды, содержащие не менее двух пептидных связей. Биуретовая реакция обусловлена наличием в белке пептидных связей, которые в щелочной среде образуют с сернокислой медью окрашенные комплексы.
Группа, образующая пептидную связь (—СО—NН—), в щелочной среде присутствует в своей таутомерией енольной форме.
При избытке щелочи происходит диссоциация ОН-группы, появляется отрицательный заряд, с помощью которого кислород взаимодействует с медью, возникает солеобразная связь; кроме того, медь образует дополнительные координационные связи с атомами азота, участвующими в пептидной связи, путем использования их неподеленных электронных пар. Возникающий таким образом комплекс очень стабилен (см. далее). Интенсивность окраски комплекса зависит от концентрации белка и количества медной соли в растворе. Биуретовую реакцию дают также некоторые небелковые вещества, например, биурет (NН2—СО—NН—СО—NН2), оксамид (NН2—СО—СО—NН2), ряд аминокислот (гистидин, серии, треонин, а также аспарагин).
Ход работы. В пронумерованные пробирки наливают по 5 капель приготовленных растворов. В каждую пробирку добавляют по 10 капель 10% раствора едкого натра и по 1 капле 1% раствора сульфата меди.
При малом содержании белка чувствительность реакции можно повысить, наслаивая на раствор белка в щелочи 1 мл 1%-ного раствора сульфата меди. При стоянии на границе двух слоев появляется фиолетовое кольцо.
Белки, полипептиды, а также свободные α-аминокислоты дают синее или фиолетовое окрашивание с нингидрином (трикетогидринденгидратом). Реакция характерна для аминогрупп в α-положении и обусловлена наличием α-аминокислот в молекуле белка.
Сначала в результате взамиодействия аминокислоты с нингидрином возникает Шиффово основание. Затем оно претерпевает перегруппировку, декарбоксилируется и расщепляется на альдегид и аминодикетогидринден.
Аминодикетогидринден конденсируется еще с одной молекулой нингидрина, и образовавшееся соединение, енолизируясь, переходит в окрашенную форму, получившую название «Сине-фиолетовый Руэмана», по имени исследователя, впервые в 1910 г изучившего эту реакцию.
В присутствии органических растворителей (ацетона, этанола, пиридина и др.), на которых обычно готовят раствор нингидрина, протекает реакция.
Продукт этой реакции содержит в своем составе радикал (R) исходной аминокислоты, который обусловливает различную окраску (голубую, красную и т. п.) соединений, возникших при реакции аминокислот с нингидрином.
Нингидриновая реакция широко используется как для открытия отдельных аминокислот, так и для определения их количества.
Ход работы. В пронумерованные пробирки наливают по 5 капель приготовленных растворов. В каждую пробирку добавляют по 3 капли 0,5% раствора нингидрина и нагревают до кипения.
При добавлении к раствору белка концентрированной азотной кислоты белок сначала выпадает в осадок, а затем при нагревании растворяется и жидкость окрашивается в желтый цвет. Эта реакция называется ксантопротеииовой; она указывает на присутствие в белке ароматических аминокислот (фенилаланина, тирозина, триптофана) и основана на образовании нитропроизводных этих аминокислот.
Реакция характерна для бензольного ядра циклических аминокислот, которые при обработке концентрированной азотной кислотой подвергаются нитрованию:
Желтое окрашивание можно наблюдать при попадании крепкой азотной кислоты на кожу, ногти, шерсть и т. д.
Нитропроизводные аминокислот в щелочной среде образуют соли хиноидной (хромофорной) структуры, окрашенные в оранжевый цвет.
Аналогично протекает реакция нитрования триптофана и фенилаланина (последний нитруется труднее).
Ход работы. В пронумерованные пробирки наливают по 5 капель приготовленных растворов. В каждую пробирку добавляют по 5 капель концентрированной азотной кислоты до появления белого осадка или мути от свернувшегося белка, и (осторожно!) нагревают. При нагревании раствор и осадок окрашиваются в ярко-желтый цвет, при этом осадок почти полностью растворяется. Пробирки охлаждают, после этого в них осторожно добавляют по 10 капель концентрированного раствора аммиака или 30% раствора едкого натра.
Результаты работы оформляют в виде таблицы 1.
Таблица 1 – Цветные реакции на аминокислоты и белки
📺 Видео
Качественные реакции на белки и аминокислоты биохимияСкачать

Биохимия. Качественные реакции для определения белков, аминокислот и углеводов (С. Смирнов)Скачать

Опыты по химии. Цветные реакции белка: биуретовая; ксантопротеиноваяСкачать

Реакция Фоля на цистеин и цистинСкачать

Качественные реакции на белкиСкачать

Ксантопротеиновая реакцияСкачать

ЛЕКЦИЯ 4. АМИНОКИСЛОТЫ, БЕЛКИСкачать

Нингидриновая реакцияСкачать

качественные реакции на белокСкачать

Опыты по химии. Аминокислоты: агрегатное состояние; отношение к воде; отношение к индикаторуСкачать

10 класс Качественные реакции на белкиСкачать

Аминокислоты. Реакции декарбоксилирования. БиохимияСкачать

Видеоурок: Практическая работа № 4. Цветные реакции на белкиСкачать

НШ | Химия. Химические свойства белков и качественные реакции на белкиСкачать

Видеоурок «Качественные реакции в химии»Скачать

Качественные реакции на белкиСкачать

Ninhydrin Reaction (Нингидриновая реакция на α-аминокислоты)Скачать