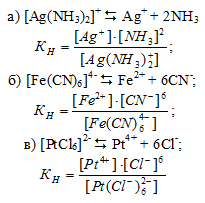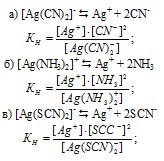- Ваш ответ
- решение вопроса
- Похожие вопросы
- Выражения для констант нестойкости комплексных ионов
- Решение задач по химии на константу нестойкости комплексных соединений
- Please wait.
- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- 🔍 Видео
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Ваш ответ
Видео:Химическая реакция FeCl3 с K4[Fe(CN)6]Скачать
![Химическая реакция FeCl3 с K4[Fe(CN)6]](https://i.ytimg.com/vi/5HC2NO_JvcA/0.jpg)
решение вопроса
Видео:Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

Похожие вопросы
- Все категории
- экономические 43,415
- гуманитарные 33,633
- юридические 17,906
- школьный раздел 608,066
- разное 16,856
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Видео:The hybridization of `Fe` in `K_4[Fe(CN)_6]` complex is:Скачать
![The hybridization of `Fe` in `K_4[Fe(CN)_6]` complex is:](https://i.ytimg.com/vi/2E532r8xHTg/0.jpg)
Выражения для констант нестойкости комплексных ионов
Видео:Number of ions present in `K_4[Fe(CN)_6]`Скачать
![Number of ions present in `K_4[Fe(CN)_6]`](https://i.ytimg.com/vi/Ydz11Xjk4pE/0.jpg)
Решение задач по химии на константу нестойкости комплексных соединений
Задание 312
Напишите выражения для констант нестойкости комплексных ионов [Аg(NH3)2] + , [Fe(CN)6] 4- , [РtCl6] 2- . Чему равны степень окисления и координационное число комплексообразователей в этих ионах?
Решение:
Комплексная соль в водном растворе диссоциирует по типу сильного электролита, т. е. практически полностью до комплексного иона (внутренняя сфера) и иона внешней сферы. Обратимый распад внутренней сферы комплексного соединения называют вторичной диссоциацией. В результате вторичной диссоциация и устанавливается равновесие между комплексной частицей (комплексным ионом), центральным ионом и лигандами. Константа равновесия диссоциации комплексного иона называется константой нестойкости комплексного иона . Чем меньше численное значение константы нестойкости (КН), тем более прочен данный комплексный ион.
Выражения для констант нестойкости комплексных ионов :
2. Степень окисления комплексообразователя определяется так же как и степень окисления элемента в любом химическом соединении исходя из того, что сумма степеней окисления всех атомов элементов в молекуле вещества равна нулю. Координационное число комплексообразователя равно числу лигандов, координированных вокруг него.
Степень окисл. Координ. Число
Задание 314
Напишите выражения для констант нестойкости следующих комплексных ионов: [Аg(CN)2] — , [Аg(NH3)2] + , [Аg(SCN)2] — . Зная, что они соответственно равны 1,0 . 10 -21 ; 6,8 . 10 -8 ; 2,0 . 10 -11 , укажите, в каком растворе, содержащем эти ноны, при равной молярной концентрации ионов Аg + больше.
Решение:
Известно, что чем устойчивее комплексный ион, тем меньшее численное значение имеет константа нестойкости данного комплексного иона и наоборот – чем большее численное значение имеет константа нестойкости комплексного иона, тем мене он устойчив. Так как константа нестойкости комплексного иона [Аg(NH3)2] + (6,8 . 10 -8 ) имеет наибольшее значение, чем ионов [Аg(CN)2] – (1,0 . 10 -21 ) и [Аg(SCN)2] – (2,0 . 10 -11 ), то при равной молярной концентрации ионов Ag + больше в растворе [Аg(NH3)2] + .
Обратимый распад внутренней сферы комплексного соединения называют вторичной диссоциацией. В результате вторичной диссоциация и устанавливается равновесие между комплексной частицей (комплексным ионом), центральным ионом и лигандами. Константа равновесия диссоциации комплексного иона называется константой нестойкости комплексного иона. Чем меньше численное значение константы нестойкости (КН), тем более прочен данный комплексный ион.
Задание 320
Константы нестойкости комплексных ионов [Со(NH3)6] 3+ , [Fe(CN)6] 4– , [Fe(CN)6] 3– соответственно равны 6,2 . 10 -36 ; 1,0 . 10 -37 ; 1,0 . 10 -44 . Какой из этих ионов является более прочным? Напишите выражения для констант нестойкости указанных комплексных ионов и формулы соединений, содержащих эти ноны.
Решение:
Известно, что чем устойчивее комплексный ион, тем меньшее численное значение имеет константа нестойкости данного комплексного иона и наоборот – чем большее численное значение имеет константа нестойкости комплексного иона, тем мене он устойчив. Так как константа нестойкости комплексного иона [Fe(CN)6] 3- (1,0 . 10 -44 ) имеет наименьшее значение, чем ионов [Со(NH3)6] 3+ (6,2 . 10 -36 ) и [Fe(CN)6] 4- (1,0 . 10-37), то более прочным ионом будет [Fe(CN)6] 3-.
Обратимый распад внутренней сферы комплексного соединения называют вторичной диссоциацией. В результате вторичной диссоциации и устанавливается равновесие между комплексной частицей (комплексным ионом), центральным ионом и лигандами. Константа равновесия диссоциации комплексного иона называется константой нестойкости комплексного иона. Чем меньше численное значение константы нестойкости (КН), тем более прочен данный комплексный ион.
Выражения для констант нестойкости комплексных ионов:
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ кислот оснований и солей | Как писать УРАВНЕНИЯ ДИССОЦИАЦИЙСкачать

Please wait.
Видео:№ 86. Неорганическая химия. Тема 10. Электролитическая диссоциация. Часть 7. Константа диссоциацииСкачать

We are checking your browser. gomolog.ru
Видео:In `K_4[Fe(CN)_6]` the EAN of Fe isСкачать
![In `K_4[Fe(CN)_6]` the EAN of Fe is](https://i.ytimg.com/vi/JDEPOSB4N00/0.jpg)
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Механизм электролитической диссоциацииСкачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 702d77506a000c65 • Your IP : 87.119.247.227 • Performance & security by Cloudflare
🔍 Видео
Электролитическая диссоциация | Химия ЕГЭ, ЦТСкачать

The oxidation number of Fe in `K_(4)[Fe(CN))(6)]` isСкачать
![The oxidation number of Fe in `K_(4)[Fe(CN))(6)]` is](https://i.ytimg.com/vi/b1pWRLdubQ0/0.jpg)
`K_(4)[Fe(CN)_(6)]` is _________. (i) potassium hexacyanoferrous (II) (ii)Скачать
![`K_(4)[Fe(CN)_(6)]` is _________. (i) potassium hexacyanoferrous (II) (ii)](https://i.ytimg.com/vi/Z7Lb4Tc51cc/0.jpg)
The IUPAC name of `K_4[Fe(CN)_6]` isСкачать
![The IUPAC name of `K_4[Fe(CN)_6]` is](https://i.ytimg.com/vi/apXJmPt7rIQ/0.jpg)
72. Электролитическая диссоциацияСкачать

Теория электролитической диссоциацииСкачать

Основные положения теории электролитической диссоциации | Химия 8 класс #41 | ИнфоурокСкачать

Электролитическая диссоциация | Химия 8 класс #40 | ИнфоурокСкачать

Основные положения теории электролитической диссоциации. Свойства ионов. 9 класс.Скачать

`[Fe(CN)_(6)]^(4-)` and `[Fe(H_(2)O)_(6)]^(2+)` are of different colours in dilute solutions why?Скачать
![`[Fe(CN)_(6)]^(4-)` and `[Fe(H_(2)O)_(6)]^(2+)` are of different colours in dilute solutions why?](https://i.ytimg.com/vi/74kur_IprCU/0.jpg)